产低温脂肪酶菌株鉴定、发酵条件优化及酶学性质分析
2023-10-19刘思远申东晨鲁丽颖董爱荣
刘思远,申东晨,刘 峥,鲁丽颖,徐 恒,董爱荣
(东北林业大学 林学院,黑龙江哈尔滨 150040)
脂肪酶(Lipase)是一类特殊的酯酶,能水解三酰甘油酯为脂肪酸、甘油二酯、单酸甘油酯及甘油[1],广泛应用于各个领域,如食品[2-3],医药[4-5],生活[6],能源[7]等。脂肪酶来源广泛,目前可以从一些油料种子[8],动物的胰脏[9]及微生物[10]中获取。相对于动植物所产生的脂肪酶,微生物产生的脂肪酶具有来源广泛、生产周期短、产量高、易提取、对外界环境要求低等特点,更易工业化生产。
近些年国内外关于产脂肪酶菌株发酵条件优化的研究报道层出不穷,如Behera 等[11]通过CCD 实验设计,得到了葡萄球菌(Staphylococcus)产脂肪酶的最佳的pH 值、温度和搅拌速度,优化后的最大酶活为1.82 U/mL,柳萌等[12]通过单因素实验对灰霉菌(Botrytis cinerea)的培养基成分和发酵条件进行优化,筛选出其产胞外脂肪酶的最优发酵条件。Salgado 等[13]从橄榄磨废水中分离出产孢外脂肪酶的菌株Magnusiomyces capitatus,并通过氧气利用率和氮浓度双因素的正交试验实现了脂肪酶产量的优化,并在培养基中添加了一定浓度的橄榄油,来提高脂肪酶的产量,最高可达3.96 U/mL。林仙菊等[14]从海鳗肠道内容物中筛选到洋葱伯克霍尔德菌(Burkholderia cepacia),采用单因素实验和均匀实验设计进行发酵条件优化,优化后的脂肪酶活力较之前提高了4.7 倍。刘元利等[15]通过优化碳源、氮源、温度、盐度等条件,优化后产脂肪酶可达1326 U/mL。但大多数研究集中在中高温脂肪酶方面,对于低温脂肪酶的研究较少[16],普通脂肪酶的适合反应温度通常在30~50 ℃,但低温脂肪酶的最适反应温度为40 ℃以下[17],且其最大特点是在0 ℃下依旧具有一定的活性。
随着各个领域对脂肪酶的需求日益增加,开发低温脂肪酶,探寻最优发酵条件及工业化生产显得尤为重要。本研究拟从漠河土壤中分离出一株产低温脂肪酶活性较高的菌株,通过形态学及分子生物学鉴定,确定其分类地位,通过单因素实验,Plackett-Burman实验,爬坡试验及响应曲面设计,探究温度、pH、装液量、接种量、碳源、氮源、金属离子、诱导剂对脂肪酶酶活的影响,从而筛选出最优发酵条件,以达到高产优势菌株的目的。并对该菌株产的脂肪酶进行初步纯化,探究其酶学性质。对开发低温脂肪酶及工业化生产提供了理论依据。
1 材料与方法
1.1 材料与仪器
土壤样品 采样地点位于黑龙江省漠河县洛古河村的林下土壤(53°21'21" N,121°37’15" E),观音山林下土壤(53°25'2" N,122°15’36" E)以及北极村林下土壤(53°25'2"N,122°15’36" E),在每个样地分别随机设置三个采样点,采样前除去地表枯落物,采集距地表5 cm 左右的土壤,每份50 g 置于密封袋中,编号记录并于保温箱中保存,于实验室进行后续处理;牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂15 g,蒸馏水1000 mL,pH7.4~7.6;脂肪酶筛选培养基:蛋白胨10 g,酵母提取物5 g,氯化钠5 g,氯化钙0.1 g,Tween-80 10 mL,蒸馏水1000 mL,琼脂15 g;LB 培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1000 mL,pH7.4,固体LB 培养基再加入15 g 琼脂;液体发酵培养基:麦芽糖5 g,蛋白胨10 g,七水硫酸镁0.5 g,橄榄油20 mL,蒸馏水1000 mL;DNA 试剂盒 上海生工生物工程有限公司;脂肪酶(LPS)活性检测试剂盒 苏州格锐思生物科技有限公司;牛肉膏、蛋白胨、胰蛋白胨、琼脂、酵母提取物、氯化钠、麦芽糖、蔗糖、葡萄糖、七水硫酸镁、硫酸亚铁等 分析纯,哈尔滨兆奎致远生物科技有限公司。
SE402F 型电子天平 奥豪斯仪器有限公司;DL-CJ-2NDI 型超净工作台 哈尔滨东联电子技术开发有限公司;T-100 型PCR 仪 BioRad;HC-3016R型低温超速冷冻离心机 安徽中科中佳仪器有限公司;SuPerMax 3100 型酶标仪 上海闪普生物科技有限公司;ZQZY-B8 型恒温振荡培养箱 上海知楚仪器有限公司。
1.2 实验方法
1.2.1 细菌菌株的分离与纯化 菌株分离采用平板稀释法[18],将5 g 土样与45 mL无菌水混合后加入玻璃珠,160 r/min 振荡30 min,制成浓度为10-1的菌悬液。之后用无菌水分别稀释成浓度梯度为10-2、10-3、10-4、10-5的菌悬液。分别取150 μL 各浓度梯度菌悬液至牛肉膏蛋白胨培养基上,涂布均匀,标记后在恒温培养箱中16 ℃培养。3 d 后,用接种环分别挑取不同的细菌菌落,采用划线法接种至细菌选择培养基上,以获得纯化的细菌菌落,16 ℃培养3 d,进行后续试验。
1.2.2 产脂肪酶菌株的初筛与复筛 将上述分离纯化得到的细菌菌株接种于LB 培养基上活化,活化后点接于脂肪酶筛选培养基上,16 ℃培养。根据脂肪酶能够分解吐温80 且产物能够与Ca2+结合而在菌落周围形成白色沉淀圈[19],初筛出能产脂肪酶的菌株。将初筛得到的细菌菌株以1%的接种量接种至发酵培养基,16 ℃,160 r/min 条件下培养32 h,取发酵液,在12000 r/min、4 ℃离心10 min,取上清液为粗酶液,进行酶活力测定。筛选出活性最高的菌株进行后续实验。
1.2.3 脂肪酶活性的测定 依据苏州格锐思脂肪酶(LPS)活性试剂盒进行脂肪酶活性测定(对硝基苯酚法[20]),具体操作详见说明书。
1.2.4 菌株的鉴定及生理生化特性 形态学鉴定:观察产酶菌落形状、颜色、表面、边缘、隆起情况,并对菌株进行革兰氏染色以及相应的生理生化实验如VP 实验、甲基红(MR)实验、明胶水解实验、产H2S实验等[21]。
分子生物学鉴定:采用16S rDNA 通用引物27F和1492R 进行PCR 扩增,将PCR 产物送至上海生工生物工程有限公司进行测序,将测序结果在NCBI网站上进行BLAST 比对,构建系统发育树。
1.2.5 产脂肪酶菌株发酵条件优化
1.2.5.1 单因素实验 以酶活为指标进行单因素实验测定,以液体发酵培养基,温度16 ℃,2%接种量,pH 为7,装液量30 mL 为基础。分别研究温度、pH、装液量、接种量、碳源、氮源、金属离子、诱导剂对脂肪酶酶活的影响。分别选取温度:10、15、20、25、30、35 ℃;pH:6.0、6.5、7.0、7.5、8.0、8.5;装液量10、20、30、40、50 mL 的培养基倒入50 mL 锥形瓶;接种量0.5%、1%、2%、3%、4%、5%;碳源:葡萄糖、蔗糖、麦芽糖、可溶性淀粉,确定最佳碳源后,配制添加量分别为0、5、10、15、20 g/L;氮源:蛋白胨、胰蛋白胨、牛肉膏、酵母粉,确定最佳氮源后,配制添加量分别为0、5、10、15、20 g/L;金属离子:Mg2+、Mn2+、Cu2+、Fe2+的硫酸盐,确定最佳金属离子后,配制添加量分别为0、0.5、1.0、1.5、2.0、2.5、3.0 g/L 的发酵培养基;诱导剂:不添加诱导剂和分别添加橄榄油、葵花籽油、亚麻籽油。确定最佳诱导剂后,配制添加量分别为10、20、30、40、50 mL/L。
1.2.5.2 Plackett-Burman 试验 对八个单因素(温度、pH、装液量、接种量、碳源、氮源、金属离子、诱导剂)进行Plackett-Burman 设计,每个因素取高低两个水平,如表1。
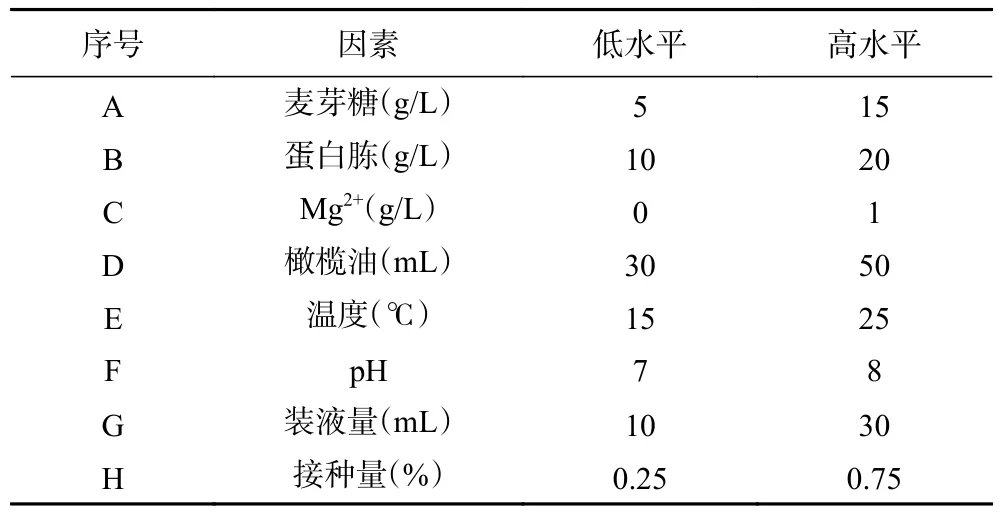
表1 Plackett-Burman 试验设计Table 1 Plackett-Burman experimental design
1.2.5.3 爬坡试验 根据上述单因素实验确定的单因素正负效应,在PB 试验的基础上,依据显著性分析结果确定3 个显著因素的最陡爬坡。
1.2.5.4 响应曲面试验优化 对PB 试验结果进行显著性分析,选取显著性最高的三个因素(蛋白胨、装液量、橄榄油),以脂肪酶为响应值,设计Box-Behnken 试验,如表2 所示,得出菌株产脂肪酶的最优发酵条件。

表2 Box-Behnken 试验因素水平Table 2 Box-Behnken experimental factor level
1.2.6 脂肪酶的纯化 以实验所得最优发酵条件进行菌株发酵,将发酵液离心取上清得到粗酶液。在冰水浴及磁力搅拌条件下缓慢加入研磨好的硫酸铵粉末,按饱和度(10%~90%)依次添加,静止1 h 后冷冻离心,得到第一个分级沉淀,以相同的方式吸取上清液加入硫酸铵,得到多个分级沉淀,将沉淀收集。沉淀置于pH7.5 的磷酸缓冲液中溶解,利用透析袋脱盐至滤液中加入BaCl2没有沉淀析出为止。所得沉淀进行后续酶学性质研究。
1.2.7 酶学性质分析
1.2.7.1 温度对酶活的影响及酶的热稳定性 在磷酸缓冲液中加入纯化后酶液,在不同温度下(0、4、15、20、25、30、35、40 ℃)置于水浴锅中保温15 min,测定各温度下的酶活;同时在不同温度下(20、30、40、50、60 ℃)保存1 h,每10 min 测定酶活。
1.2.7.2 pH 对酶活的影响及酶对pH 的耐受性 配制浓度为50 mmol/L 的不同pH 缓冲液:柠檬酸缓冲液(pH3.0~5.0)、磷酸盐缓冲液(pH6.0~8.0)、Tris-HCl 缓冲液(pH9.0)、碳酸钠缓冲液(pH10.0~11.0),在缓冲液中加入纯化后的酶液,30 min 后测定各pH 下的酶活;同时将酶液与各缓冲液按1:3 的比例混合后,在最适温度下保温4 h,每30 min 测定酶活。
1.2.7.3 金属离子对酶活的影响 配制浓度10 mmol/L的含Mg2+、Ca2+、Cu2+、Fe2+、Zn2+、Mn2+的磷酸盐缓冲液,在缓冲液中加入纯化后的酶液,以不添加金属离子为对照,测定酶活。
1.2.7.4 有机溶剂对酶活的影响 在酶活测定体系中分别加入甲醇、乙醇、异丙醇、乙酸乙酯、正己烷、三氯乙烷等有机溶剂[22],有机溶剂体积分数为10%,对照组为不添加有机溶剂,最适温度处理1 h,测定酶活。
1.3 数据处理
实验数据均平行测定3 次,采用Microsoft Excel 2017 进行数据统计,采用SPSS.25 进行单因素方差分析及显著性分析,采用Design-expert 8.0 进行Plackett-Burman 和Box-Behnken 响应面优化试验设计及分析验证,使用Origin 2021 进行图像绘制。
2 结果与分析
2.1 产脂肪酶菌株的初筛和复筛
经过初筛,有5 株菌株(X1、X2、X4、X16、X21)能够在筛选培养基上产生白色沉淀圈,表明这5 株菌株均能产生脂肪酶。对初筛结果中的5 株菌株进行复筛,提取粗酶液,通过测定酶活大小(图1),菌株X16 酶活最高,为8.47 U/mL,因此选取X16 进行后续实验。

图1 5 株产低温脂肪酶菌株活力Fig.1 5 strains producing cold-active lipase
2.2 菌株鉴定结果
2.2.1 菌株形态学鉴定 由图2A 可以看出菌株X16 在筛选培养基上产生的白色沉淀圈,由图2B 可知,X16 菌株呈粉红色,边缘光滑整齐,表面呈凸起状,表面湿润。

图2 菌株形态学图片Fig.2 Morphological pictures of the strains
2.2.2 菌株生理生化特性 菌株X16 生理生化结果显示(表3),该菌株为革兰氏阴性菌,可分解葡萄糖、蔗糖、麦芽糖,不产气,VP 实验为阳性,MR 实验阴性,可产生蛋白酶与脂肪酶。

表3 菌株X16 生理生化鉴定Table 3 Physiological and biochemical identification of strain X16
2.2.3 菌株分子生物学鉴定 将测序结果在NCBI上进行BLAST 同源性比对,通过形态学与分子生物学鉴定,并结合《伯杰氏细菌鉴定手册》,使用MEGA11构建系统发育树(图3),比较不同菌株间的同源性,确定菌株X16 为普城沙雷氏菌(Serratia plumuthica)。

图3 菌株X16 及其相似序列的进化树分析Fig.3 Phylogenetic tree analysis of strain X16 and its similar sequences
2.3 产低温脂肪酶菌株发酵条件优化
在10~20 ℃之间,菌株X16 的酶活逐渐增加,在20 ℃时,酶活达到最大值,为9.66 U/mL,随着温度逐渐上升,酶的活性呈现下降的趋势(图4A)。随着pH 从6 升至7.5 时,酶活逐渐增大,在pH 7.5 时达到最大值,为18.35 U/mL,当pH 大于7.5 后,酶活逐渐下降(图4B)。当装液量为20 mL/50 mL 时,酶活最大为14.25 U/mL,随着装液量逐渐增加,酶活呈下降趋势(图4C)。当接种量为0.5%时,酶活最大为12.43 U/mL,当接种量大于0.5%时,酶活逐渐降低(图4D)。
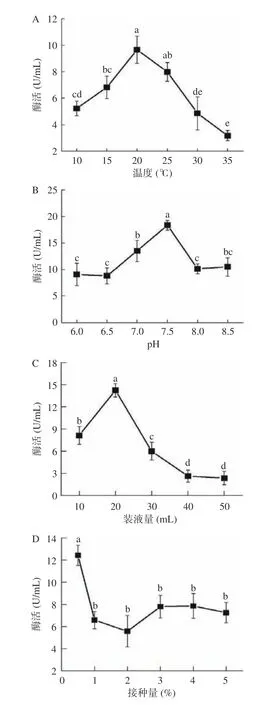
图4 菌株发酵条件优化Fig.4 Optimization of fermentation conditions of strains
探究不同碳源对菌株X16 产酶的影响,结果如图5A 所示,当以麦芽糖为单一碳源时,酶活最高,其次为蔗糖,无碳源,葡萄糖,淀粉。同时麦芽糖的添加量对酶活也有显著影响,当麦芽糖浓度为20 g/L 时酶活最高。如图5B,当分别添加胰蛋白胨,牛肉膏,酵母粉为氮源时,菌株酶活很低,以蛋白胨为唯一氮源时酶活最高。蛋白胨浓度对菌株酶活影响如图表明,当蛋白胨浓度为15 g/L 时,菌株酶活最高。金属离子同样会对菌株的产酶情况存在影响,由图5C 所示,在发酵培养基中添加不同成分的金属离子均对菌株的酶活存在促进效应,当Mg2+为唯一金属离子时,菌株酶活最高。当Mg2+浓度达到0.5 g/L 时,此时菌株酶活达到最高值。诱导剂的添加会促进酶活的提高,如图5D 所示,当添加橄榄油和亚麻籽油时,菌株酶活显著提高,当添加橄榄油时,菌株的酶活有最大值,当诱导剂为葵花籽油时,菌株酶活并没有明显上升。进一步探究橄榄油浓度对酶活的影响时,发现当橄榄油浓度为40 mL/L 时,菌株酶活达到最大。

图5 菌株培养基优化Fig.5 Optimization of strain culture medium
2.4 响应面试验设计
2.4.1 Plackett-Burman 试验设计 采用 Plackett-Burman 试验设计进行脂肪酶活性测定,试验设计及结果见表4,各试验因素显著性分析见表5。

表4 Plackett-Burman 试验设计及结果Table 4 Plackett-Burman experimental design and results

表5 Plackett-Burman 试验各因素显著性分析Table 5 Significance analysis of each factor in Plackett-Burman
各因素P值由表可知,该线性回归模型显著。在发酵条件优化实验中,各个因素对产酶影响的重要性排序为:橄榄油>装液量>蛋白胨>接种量>温度>镁离子>pH>麦芽糖,其中装液量,蛋白胨添加量,橄榄油添加量三者P值均小于0.05,表明3 个因素对菌株产脂肪酶有显著影响,因此选择这3 个因素进行后续爬坡实验。
2.4.2 最陡爬坡试验设计及结果 根据上述PB 试验确定的单因素正负效应,确定爬坡试验设计。由表6 可知,第4 组酶活最高,选定第4 组为中心点进行响应曲面优化。

表6 最陡爬坡试验设计及结果Table 6 Experimental design and results of steepest climbing
2.4.3 响应面设计及结果 以装液量、蛋白胨、橄榄油为响应面设计的三个因素,以脂肪酶活力为响应值,通过三因素三水平的Box-Behnken 试验设计和响应面分析方法,探究菌株的最优发酵条件,设计及结果如表7 所示。

表7 响应面设计方案及结果Table 7 Response surface design scheme and results
如表8 所示,响应曲面整体模型十分显著,但是失拟项并不显著,说明该模型可以真实反应装液量、蛋白胨、橄榄油与脂肪酶酶活之间的关系,可以用该模型进行分析与最优值预测。响应曲面结果如图6所示,酶活随着装液量、蛋白胨、橄榄油的变化先上升后下降,其中装液量和橄榄油的交互作用极为显著,但是蛋白胨与橄榄油的交互作用不显著。通过响应器优化得到的优化结果为装液量42.17 mL,蛋白胨13.95 g/L,橄榄油45.60 mL/L,优化后的脂肪酶酶活预测值为98.79 U/mL。考虑到实际操作的便捷性,将装液量调整为42 mL,蛋白胨调整为14 g/L,橄榄油为46 mL/L,其余因素为温度20℃,pH7.5,接种量0.5%,20g/L 麦芽糖及0.5g/L MgSO4·7H2O,经过验证得到脂肪酶平均酶活为98.05 U/mL,与预测值拟合性较好。

图6 各因素交互作用对菌株产酶影响Fig.6 Response surface plots showing the interactive effects on lipase production

表8 响应面设计方差及结果Table 8 Response surface design variance and results
2.5 硫酸铵沉淀结果
硫酸铵沉淀法对酶活损伤小,且沉淀能长时间保存,不同饱和度硫酸铵对酶脂肪酶纯化效果存在差异,沉淀结果如表9 所示,当硫酸铵饱和度为50%~80%时,酶活性较高,其中饱和度为70 时酶活性最高,为93.18 U/mL,饱和度低于40%时,纯化效果降低。

表9 硫酸铵沉淀结果Table 9 Results of ammonium sulfate precipitation
2.6 低温脂肪酶酶学性质
2.6.1 酶最适反应温度及温度对酶稳定性的影响取纯化后的酶液,在0~40 ℃条件下分别进行酶活测定。结果如图7A 所示,菌株所产的脂肪酶活性在30 ℃达到最高,且在0 ℃时仍有30%的相对活性,证明该酶属于低温脂肪酶。将酶液在不同温度下保存一定时间后,酶的活性如图7B 所示,该脂肪酶在30 ℃条件下相对酶活性最好,且热稳定性较好,处理60 min 后仍有80%以上的相对活性。60 ℃时热稳定性最差,60 ℃下处理10 min 酶活就损失了60%。

图7 不同处理对酶的影响Fig.7 Effect of different treatments on enzyme
2.6.2 酶最适反应pH 及其酸碱稳定性 30 ℃下,将纯化后的酶液置于不同pH 反应体系中,分别测定酶活。pH 为7~8 时相对酶活达到了80%以上,最适反应pH 为7(图7C)。将酶液在不同pH 的缓冲液中处理3 h,每隔30 min 测定酶活,结果显示该脂肪酶在pH 为7 和8 时的稳定性最好,过酸或者过碱对酶的稳定性影响很大,pH 为3 时处理240 min 酶活几乎完全丧失(图7D)。
2.6.3 金属离子对酶活的影响 配制浓度为10 mmol/L的含有Mg2+、Ca2+、Cu2+、Fe2+、Zn2+、Mn2+的磷酸盐缓冲液,在缓冲液中加入纯化后的酶液,以不添加金属离子为对照。结果如图8A,不同的金属离子均对酶活有促进作用,其中Mg2+对酶活的促进作用最为显著,相对酶活性达到了224%。

图8 不同添加物质对酶活的影响Fig.8 Effect of different added substances on enzyme activity
2.6.4 有机溶剂对酶活的影响 不同的有机溶剂也会对酶活产生影响。由图8B 可见,异丙醇,乙酸乙酯,三氯乙烷对酶活影响并不显著,但正己烷对酶活有明显的促进作用,经正己烷处理后相对酶活达到了142%,甲醇与乙醇对该酶有一定的抑制作用。
3 讨论
脂肪酶在生产生活等多个领域中均起到重要的作用,近年来对脂肪酶的需求日益增加,微生物因其速生,种类繁多,易工业化等优点,已成为工业生产脂肪酶的重要来源。目前,细菌脂肪酶主要源自沙雷氏菌属,假单胞菌属(Pseudomonas),芽胞杆菌属(Bacillus),耶尔森菌属(Yersinia),红酵母属(Rhodotorula)等[23-29],而本文筛选的普城沙雷氏菌为沙雷氏菌属,与刘元利[15],李长春等[25]的研究有一定相似之处。
本研究利用Plackett-Burman 实验,爬坡试验及响应曲面设计对普城沙雷氏菌产脂肪酶进行发酵条件优化,最终得到的酶活为98.05 U/mL。相比于程爽等[30]从油污污染土壤中筛选出的产脂肪酶粗酶活为2.39 U/mL 的沙雷氏菌属,刘延波等[31]从酒曲筛选出产脂肪酶活为15.09 U/mL 的枯草芽孢杆菌(Bacillus subtilis),本实验筛选的菌株有一定的产酶优势。但对比刘元利[15]从青海污染原油筛选出产低温脂肪酶酶活1326 U/mL 的沙雷氏菌LHY-1,吴子君[32]从发酵芝麻饼中筛选得到产脂肪酶活262.81 U/mL 的铜绿假单胞菌(Pseudomonas aeruginosa)和Neihaya 等[33]从土壤分离的产脂肪酶活122 U/mL 的粘质沙雷氏菌(Serratia marcescens)有一定不足。
酶学性质研究表示,该脂肪酶在0 ℃时仍有活性,且最适反应温度为30 ℃,属于低温脂肪酶,该最适温度与史程风[34]的研究结果一致。在pH 稳定性方面,该酶在较宽的pH 范围内(7~9)均比较稳定。同样,腐生链霉菌(S.saprophyticus)的脂肪酶在pH 6~9 范围内表现出稳定性,低于或高于这一范围均严重失活[35]。本研究表明Mg2+可显著提高脂肪酶活性,因其可参与底物活化和酶的静电稳定,对脂肪酶有较强的刺激作用[36]。该酶在正己烷处理下活性显著提高,同样溶酪链霉菌EX-17 的胞外脂肪酶在正己烷存在下活性提高了1.5 倍[37],与本实验结果有良好的一致性。
4 结论
经过形态学、生理生化实验及分子生物学鉴定,确定本实验筛选菌株为普城沙雷氏菌。该菌株产脂肪酶的最优发酵条件为20 ℃、pH7.5、装液量42 mL、接种量0.5%、20 g/L 麦芽糖,14 g/L 蛋白胨、0.5 g/L的MgSO4·7H2O 及46 mL/L 橄榄油。在此优化条件下,脂肪酶活为98.05 U/mL,是优化前的5.85倍。酶学性质显示该脂肪酶最适温度为30 ℃,属于低温脂肪酶,最适反应pH 为7,Mg2+明显可以促进酶活,甲醇和乙醇明显抑制酶活性,而正己烷明显促进酶活性。本研究筛选菌株酶活虽高于部分报道,但是其工业生产有待扩大研究,本实验后续可从盐度、摇床转速、高产脂肪酶基因等方面进一步优化脂肪酶活性及产量。该研究结果可以为微生物资源开发利用,工业生产低温脂肪酶提供一定的理论依据及方法指导。
