血清HSP70、VEGF联合检测对可切除胰腺癌诊断及术后生存预测价值
2023-10-18熊六妹王桂良邱萍徐林芳龚敏李兴文剑波
熊六妹,王桂良,邱萍,徐林芳,龚敏,李兴,文剑波
血清HSP70、VEGF联合检测对可切除胰腺癌诊断及术后生存预测价值
熊六妹,王桂良,邱萍,徐林芳,龚敏,李兴,文剑波
南方医科大学附属萍乡医院消化内科,江西萍乡 337000
探讨血清热休克蛋白70(heat shock protein 70,HSP70)、血管内皮生长因子(vascular endothelial growth factor,VEGF)联合检测对可切除胰腺癌诊断及术后生存预测价值。选取2015年12月至2018年10月南方医科大学附属萍乡医院124例行手术治疗的Ⅰ~Ⅲ期原发性胰腺癌患者作为胰腺癌组,另选取16例同期于本院进行健康体检者作为对照组,检测胰腺癌组患者手术前和手术后以及对照组血清HSP70、VEGF水平,分析两项指标相关性,研究其与临床病理及预后的关系。血清HSP70、VEGF 含量:术前>术后7d>术后1个月>对照组(<0.05),胰腺癌组患者术前、术后7d、术后1个月血清HSP70水平与血清VEGF含量呈正相关(<0.05)。胰腺癌组患者术前肿瘤>3cm、肿瘤分化程度低、临床分期Ⅲ期、淋巴结转移患者血清 HSP70、VEGF含量分别高于肿瘤≤3cm、肿瘤分化程度高、临床分期Ⅰ期或Ⅱ期、未发生淋巴结转移者(<0.05)。血清HSP70和VEGF对胰腺癌的诊断均有较好的特异性,联合诊断效果更好(<0.05)。HSP70浓度和VEGF浓度均与胰腺癌患者术后生存时间呈负相关(<0.05)。单因素回归分析和多因素Cox回归分析显示肿瘤直径、淋巴结转移、肿瘤淋巴结转移(tumor-node-metastasis,TNM)分期、分化程度、远处转移、HSP70和VEGF浓度均是胰腺癌预后的独立危险因素(<0.05)。胰腺癌患者血清 HSP70和VEGF与恶性生物学行为呈正相关,与生存时间呈负相关,是胰腺癌术后预后的独立危险因素。
胰腺癌;HSP70;VEGF;预测价值
胰腺癌是一种恶性程度极高、预后极差、转移率高的消化系统肿瘤,据Siegel等[1]统计其5年生存期约10%,发病率以每年0.5%~1.0%速度增长。胰腺属于腹膜后位器官,因此胰腺癌患者早期症状隐匿,很难发现,而当患者出现腹痛、黄疸等不适时,已经发展至晚期,错失手术治疗时机。目前临床上诊断的患者,可手术切除的仅为10%~15%,而转移的可达50%~55%[2]。寻找敏感的肿瘤标志物,对胰腺癌早期诊断和治疗监测,是十分迫切而重要的课题。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种高度特异性促血管内皮生长因子,包括VEGFA、VEGFB、VEGFC、VEGFD、VEGFE等5个成员,其中研究最多并重要的是VEGFA,它在1983年首次被Senger等[3]所认识并提取。VEGF可以在血管内皮细胞、免疫相关细胞及其他细胞起重要作用,在正常生理下可以维持血管稳态、介导血管生成,而在肿瘤环境中参与肿瘤的发生、发展、侵袭、血管通透性、癌细胞转移[4]。学者提出阻断VEGF作为肿瘤治疗新靶点,如贝伐珠单抗治疗非小细胞肺癌、晚期结直肠癌、多形性成胶质细胞瘤、卵巢癌和宫颈癌等众多实体瘤[5]。热休克蛋白70(heat shock protein 70,HSP70)是一种应激蛋白,机体在缺血、感染、缺氧、热刺激等应激原打击下,HSP70表达升高,提高机体的应激能力。其生理作用包括蛋白质跨膜运输、蛋白质折叠、聚合、装配、拆卸及维持细胞内环境稳态。崔晓梅等[6]及Vostakolaei等[7]研究发现HSP70在很多癌症中表达升高,可作为肿瘤标志物。本研究旨在联合检测胰腺癌患者血清VEGF与HSP70水平,比较手术前后胰腺癌患者血清HSP70、VEGF含量差异,分析两项指标的相关性,分析其与临床病理与预后的关系,为胰腺癌的诊断和术后检测提供新的分子标志物。
1 资料与方法
1.1 一般资料
选取2015年1月至2018年10月南方医科大学附属萍乡医院Ⅰ~Ⅲ期原发性胰腺癌行手术治疗的患者124例作为胰腺癌组,纳入标准:①符合《中国胰腺癌综合诊治指南(2020版)》[8]中关于胰腺癌的诊断标准;②Karnofsky评分>60分;③术前未接受过化疗、放疗或生物治疗。排除标准:①严重凝血功能障碍患者;②感染急性期;③合并心、肺、肝、肾功能严重障碍;④妊娠或哺乳期妇女;⑤合并认知障碍或精神疾病。其中男68例,女56例;高分化46例,中分化30例,低分化48例;临床分期[9]:Ⅰ期40例,Ⅱ期36例,Ⅲ期48例。另选取16例同期于本院健康体检者作为对照组,其中男10例,女6例。两组患者性别、年龄、临床分期等基本资料比较,差异无统计学意义(>0.05),具有可比性。本研究经过南方医科大学附属萍乡医院伦理委员会审核批准(伦理审批号:2020A170-KSO1),患者及其家属签署知情同意书。
1.2 ELISA检测血清HSP70和VEGF
HSP70试剂盒和VEGF试剂盒购于武汉博士德生物工程有限公司,对照组于体检当日、胰腺癌组于术前、术后7d、术后1个月抽取空腹静脉血4ml,室温下4000g/min离心分离血清,酶联免疫吸附法操作按试剂盒说明书进行。
1.3 随访
所有胰腺癌患者随访3年。生存起始时间为胰腺癌手术后,主要终点事件为死亡时间,次要终点事件为随访结束。生存期的计算方法为术后到死亡或随访结束所历经的时间。
1.4 统计学方法
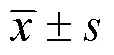
2 结果
2.1 血清HSP70、VEGF含量比较
术前与术后两组血清HSP70、VEGF含量比较,差异均有统计学意义(<0.05),见表1。

表1 血清HSP70、VEGF含量比较()
注:与正常对照组比较,*<0.001;与术前比较,#<0.001;与术后7d比较,△<0.001
2.2 血清HSP70、VEGF对胰腺癌的诊断效能评价
血清HSP70诊断胰腺癌的AUC为0.779,敏感度为66.3%,特异性为93.8%。血清诊断胰腺癌的AUC为0.884,敏感度为86.9%,特异性为74.4%。两者联合诊断胰腺癌的AUC为0.913,敏感度为90.8%,特异性为89.9%。血清HSP70和VEGF对胰腺癌的诊断均有较好的特异性,联合诊断效果更好,见图1。
2.3 胰腺癌组患者血清HSP70、VEGF浓度相关性分析
胰腺癌组患者术前血清HSP70浓度与VEGF浓度、术后7d血清HSP70浓度与VEGF浓度、术后1个月血清HSP70浓度与VEGF浓度均呈现正相关,见图2。
2.4 胰腺癌组患者术前血清 HSP70、VEGF含量与临床病理特征的关系分析
胰腺癌组患者术前肿瘤>3cm、肿瘤分化程度低、临床分期Ⅲ期、淋巴结转移患者血清HSP70、VEGF含量高于肿瘤≤3cm、肿瘤分化程度高、临床分期Ⅰ期或Ⅱ期、未发生淋巴结转移者,差异均有统计学意义(<0.05),见表2。
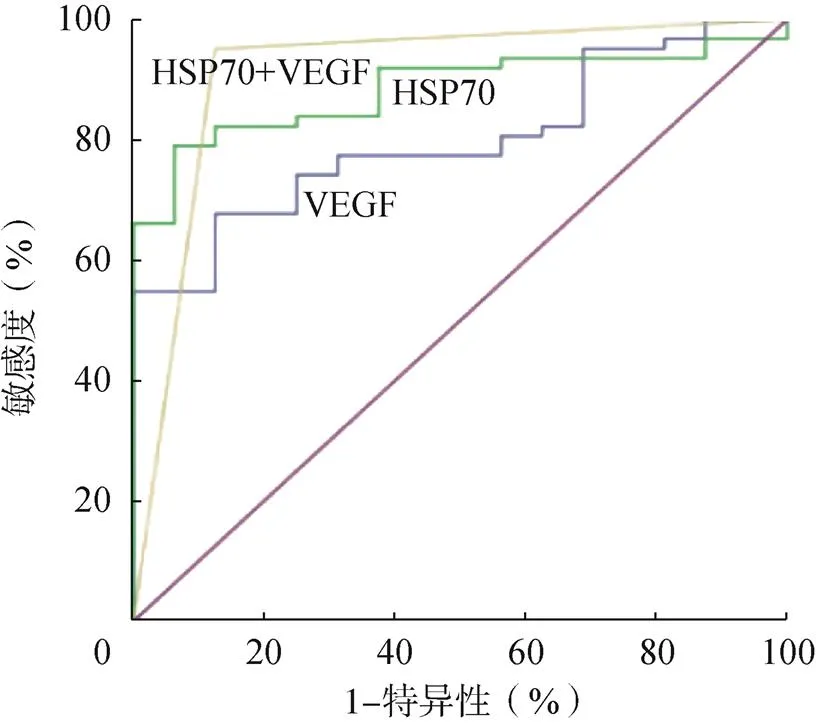
图1 血清HSP70、VEGF对胰腺癌的诊断价值

图2 胰腺癌组患者血清HSP70、VEGF含量相关性分析

表2 患者术前血清HSP70、VEGF含量与临床病理特征的关系分析()
注:与高分化组比较,*<0.05;与中分化组比较,#<0.05;与Ⅰ期比较,△<0.05;与Ⅱ期比较,▲<0.05
2.5 胰腺癌组患者术前血清 HSP70、VEGF含量与生存时间相关性分析
HSP70和VEGF浓度均与胰腺癌患者术后生存时间呈负相关,浓度越低,生存时间越长,浓度越高,生存时间越短,见图3。
2.6 HSP70和VEGF对胰腺癌预后的危险因素分析
单因素回归分析显示,性别、年龄、肿瘤位置与胰腺癌预后相关不相关;肿瘤直径、淋巴结转移、TNM分期、分化程度、远处转移、HSP70和VEGF浓度与胰腺癌预后显著相关。进一步多因素Cox回归分析显示肿瘤直径、淋巴结转移、TNM分期、分化程度、远处转移、HSP70和VEGF浓度均是胰腺癌预后的独立危险因素,见表3。
3 讨论
胰腺癌是最致命的癌症类型之一,由于胰腺癌细胞的分子异质性,它始终具有增殖潜力,侵袭性,具有较高的转移率和复发率,其发生是个多基因、多步骤、多阶段的演变过程。寻找可靠的胰腺癌预后标志物是重要的课题。癌抗原199(cancer antigen 199,CAl99)作为胰腺癌诊断的重要标志物,其敏感度度高,但其他疾病(胰腺炎、胆管相关疾病)也常升高,容易出现假阳性结果。VEGF是目前熟知的肿瘤标志物,如结直肠癌、卵巢癌、胃癌、膀胱癌、非小细胞肺癌等。同时有大量有关其在与肿瘤预后及治疗相关研究,研究发现VEGF在乳腺癌中临床病理差异及预后明显相关,Xu等[10]研究发现VEGF在肝细胞肝癌这种血管丰富的肿瘤表达明显增高并作为驱动因素。Pistol-tanase等[11]在其研究中发现VEGF与胰腺癌的临床病理特征密切相关,可以作为胰腺癌诊断的候选标志物,本研究也进一步证实此结论。HSP70是一种常见且重要的伴侣蛋白,与肿瘤增殖、转移、血管生成、肿瘤免疫逃逸方面密切相关。大量研究发现过表达HSP70作为肿瘤诊断的一个敏感的生物标志物,如结肠癌、前列腺癌、乳腺癌、肺癌。同时也监测肿瘤的治疗效果及反映预后,Li等[12]发现过表达HSP70抑制了肿瘤细胞对顺铂的敏感度,从而可预测卵巢癌化疗的敏感度及不良结局。Giri等[13]及Saluja等[14]研究认为HSP70在包括肿瘤在内的胰腺疾病中显著增加,阻断HSP70可以抑制肿瘤增殖,为胰腺癌的治疗提供新方向。Dutta等[15]认为血清HSP70可作为胰腺癌早期诊断的标志物,但在临床上运用还需要更多研究进一步证实,目前有关HSP70与胰腺癌的研究多集中在反映放化疗敏感度研究[16-18],对于术后监测、预后评估价值的研究目前尚缺乏。
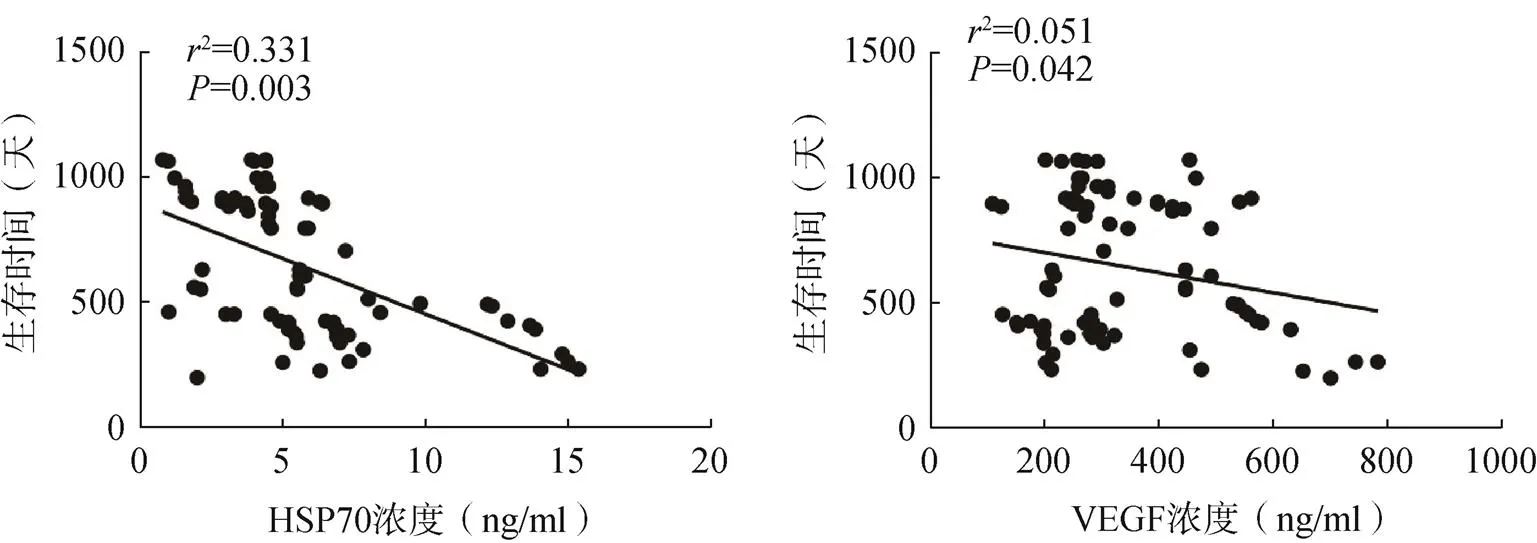
图3 胰腺癌组患者术前血清HSP70、VEGF含量与生存时间相关性分析

表3 HSP70和VEGF对胰腺癌预后的危险因素分析
因此,本研究探索了血清HSP70、VEGF在胰腺癌患者术后监测与预估评估的价值,结果是血清HSP70、VEGF含量术前>术后7d>术后1个月>对照组,差异均有统计学意义。胰腺癌组患者术前、术后7d、术后1个月血清HSP70水平与血清VEGF含量呈正相关。这一结果说明血清HSP70、VEGF与胰腺癌治疗转归相关,HSP70、VEGF水平两者呈正相关。胰腺癌组患者术前肿瘤>3cm、肿瘤分化程度低、临床分期Ⅲ期、淋巴结转移患者血清HSP70、VEGF含量高于肿瘤≤3cm、肿瘤分化程度高、临床分期Ⅰ期或Ⅱ期、未发生淋巴结转移者,差异均有统计学意义。结果说明随着肿瘤直径增大、临床分期升高、出现淋巴结转移,患者血清HSP70、VEGF表达水平也随之增高,可进一步说明可作为胰腺癌诊断、预测预后的重要生物学标志物。血清HSP70和VEGF对胰腺癌的诊断均有较好的特异性,联合诊断效果更好。HSP70浓度和VEGF浓度均与胰腺癌患者术后生存时间呈负相关,浓度越低,生存时间越长,浓度越高,生存时间越短。单因素回归分析和多因素Cox回归分析显示肿瘤直径、淋巴结转移、TNM分期、分化程度、远处转移、HSP70和VEGF浓度均是胰腺癌预后的独立危险因素。同时也说明HSP70、VEGF可能参与胰腺癌的发生、发展及转归,阻断HSP70、VEGF可能成为胰腺癌的新靶点,为下一步临床研究提高新思路。
综上所述,可切除胰腺癌患者术前血清HSP70、VEGF高表达与临床病理相关。HSP70和VEGF与恶性生物学行为呈正相关,与生存时间呈负相关,是胰腺癌预后的独立危险因素。
[1] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer Statistics, 2021[J]. CA Cancer J Clin2021, 71(1): 7–33.
[2] VONHOFF D D, ERVIN T, ARENA F P, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine[J]. N Engl J Med, 2013, 369(18): 1691–1703.
[3] SENGER D R, GALLO S J, DVORAK A M, et al. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid[J]. Science, 1983, 219(4587): 983–985.
[4] BIRKENHAUER E, NEETHIRAJAN S. A double- edged sword: the role of VEGF in wound repair and chemoattraction of opportunist pathogens[J]. Int J Mol Sci.,2015, 16(4): 7159–7172.
[5] ZIRLIK K, DUYSTER J. Anti-angiogenics: current situation and future perspectives[J]. Oncol Res Treat, 2018, 41(4): 166–171.
[6] 崔晓梅, 张惠洁, 郭卫东. P53、Fas、HSP70在乳腺癌中的表达及其相关性研究[J]. 中国地方病防治杂志, 2017, 32(12): 1431+1434.
[7] VOSTAKOLAEI M A, HATAMI-BAROOGH L, BABAEI G, et al. Hsp70 in cancer: A double agent in the battle between survival and death[J]. J Cell Physiol, 2021, 236(5): 3420–3444.
[8] 中国抗癌协会胰腺癌专业委员会. 中国胰腺癌综合诊治指南(2020版)[J]. 中华外科杂志,2021, 59(2): 81–100.
[9] LIU L, XU H X, HE M, et al. A novel scoring system predicts postsurgical survival and adjuvant chemotherapeutic benefits in patients with pancreatic adenocarcinoma: Implications for AJCC-TNM staging[J]. Surgery,2018, 163(6): 1280–1294.
[10] XU K, WU C L, WANG Z X, et al. VEGF family gene expression as prognostic biomarkers for Alzheimer’s disease and primary liver cancer[J]. Comput Math Methods Med, 2021, 2021: 3422393.
[11] PISTOL-TANASE C, RADUCAN E, DIMA S O, et al. Assessment of soluble angiogenic markers in pancreatic cancer[J]. Biomark Med, 2008, 2(5): 447–455.
[12] LI X F, HUA T, LI Y, et al . The HSP70 gene predicts prognosis and response to chemotherapy in epithelial ovarian cancer[J]. Ann Transl Med, 2021, 9(9): 806.
[13] GIRI B, SETHI V, MODI S, et al. “Heat shock protein 70 in pancreatic diseases: Friend or foe”[J]. J Surg Oncol,2017, 116(1): 114–122.
[14] SALUJA A, DUDEJA V. Heat shock proteins in pancreatic diseases[J]. J Gastroenterol Hepatol,2008, 23 Suppl 1: S42–45.
[15] DUTTA S K, GIROTRA M, SINGLA M, et al. Serum HSP70: a novel biomarker for early detection of pancreatic cancer[J]. Pancreas,2012, 41(4): 530–534.
[16] GOPAL U, MOWERY Y, YOUNG K, et al. Targeting cell surface GRP78 enhances pancreatic cancer radiosensitivity through YAP/TAZ protein signaling[J]. J Biol Chem, 2019, 294(38): 13939–13952.
[17] Yoshidomi K, Murakami A, Yakabe K, et al. Heat shock protein 70 is involved in malignant behaviors and chemosensitivities to cisplatin in cervical squamous cell carcinoma cells[J]. J Obstet Gynaecol Res, 2014, 40(5): 1188–1196.
[18] Mori Y, Terauchi R, Shirai T, et al. Suppression of heat shock protein 70 by siRNA enhances the antitumor effects of cisplatin in cultured human osteosarcoma cells[J]. Cell Stress Chaperones, 2017, 22(5): 699–706.
Value of combined detection of serum HSP70 and VEGF in the diagnosis and prediction of post-operative survival of resectable pancreatic cancer
Department of Gastroenterology, Southern Medical University Affiliated Pingxiang Hospital, Pingxiang 337000, Jiangxi, China
To investigate the value of combined detection of serum heat shock protein 70 (HSP70) and vascular endothelial growth factor (VEGF) in the diagnosis and prediction of postoperative survival of stage Ⅰ to Ⅲ resectable pancreatic cancer.A total of 124 patients with primary resectable pancreatic cancer undergoing surgery in the Southern Medical University Affiliated Pingxiang Hospitalwere enrolled as the pancreatic cancer group from December 2015 to October 2018, while other 16 healthy controls during the same period were enrolled as the control group. The levels of serum HSP70 and VEGF in two groups were detected. The correlation between the two indicators was analyzed. The relationship with clinicopathology and prognosis was studied.The levels of serum HSP70 and VEGF in the pancreatic cancer group were higher than those in the control group before and after surgery (<0.05). The levels of serum HSP70 and VEGF at 7 d and 1 month after surgery were lower than those before surgery in the pancreatic cancer group (<0.05). In pancreatic cancer group, level of serum HSP70 was positively correlated with serum VEGF before surgery, at 7 d and 1 month after surgery (<0.05). There were statistically significant differences in preoperative tumor >3cm, low differentiation degree of tumor, clinical stage Ⅲ serum HSP70 and VEGF levels in patients with lymph node metastasis were higher than those with ≤3cm tumor, high differentiation degree of tumor, clinical stage Ⅰor Ⅱ and no lymph node metastasis (<0.05). Both serum HSP70 and VEGF have good specificity for the diagnosis of pancreatic cancer, and the combined diagnosis effect is better (<0.05). Both HSP70 concentration and VEGF concentration were negatively correlated with postoperative survival time of patients with pancreatic cancer (<0.05). Univariate regression analysis and multivariate Cox regression analysis showed that tumor diameter, lymph node metastasis, tumor-node-metastasis (TNM) stage, differentiation degree, distant metastasis, HSP70 and VEGF concentration were independent risk factors for prognosis of pancreatic cancer (<0.05).Serum HSP70 and VEGF in patients with pancreatic cancer are positively correlated with malignant biological behavior, and negatively correlated with survival time, which are independent risk factors for postoperative prognosis of pancreatic cancer.
Pancreatic cancer; Heat shock protein70; Vascular endothelial growth factor; Predictive value effect
R735.35
A
10.3969/j.issn.1673-9701.2023.26.016
萍乡市科技局课题(2022PY011)
王桂良,电子信箱:guiliangwang@126.com
(2022–10–18)
(2023–08–30)
