氨基脱氧分支酸合成酶对谷氨酸棒杆菌生长和产L-丝氨酸的影响
2023-10-18刘安倩颜文斌肖文翰张晓梅史劲松许正宏
刘安倩,颜文斌,肖文翰,张晓梅*,史劲松,许正宏
1(江南大学 生命科学与健康工程学院,江苏 无锡,214112)2(宜兴市食品与生物技术研究院,江苏 无锡,214122)3(江南大学 生物工程学院,江苏 无锡,214112)4(江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)
L-丝氨酸被广泛应用于医药、食品及化妆品等领域。目前,全球L-丝氨酸需求量约为3 000 t,市场价格约为20万元/t[1-4]。L-丝氨酸也是世界氨基酸行业中工业化生产难度较大的氨基酸。目前国内多采用蛋白水解法工业化生产,该方法引起的环境污染问题不容忽视[5]。微生物利用廉价的糖质原料发酵生产L-丝氨酸正成为研究热点[6]。
目前微生物发酵法生产L-丝氨酸的研究主要集中于谷氨酸棒杆菌和大肠杆菌[1-6]。MUNDHADA等[7-8]将大肠杆菌进行代谢改造及适应性进化,经补料分批发酵,L-丝氨酸的产量达到50 g/L。谷氨酸棒杆菌是FDA认可生产食品及药品的安全菌株[9-10],L-丝氨酸在谷氨酸棒杆菌中的代谢涉及3个合成途径关键酶和2个降解途径关键酶[11],即甘油酸脱氢酶(PGDH,编码基因serA)、磷酸丝氨酸氨基转移酶(PSAT,编码基因serC)和磷酸丝氨酸磷酸化酶(PSP,编码基因serB)[8];丝氨酸脱氢酶(SerDH,编码基因sdaA)及丝氨酸羟甲基转移酶(SHMT,编码基因glyA)[12]。目前对L-丝氨酸重组菌株的构建集中于合成途径关键酶的加强表达与降解途径关键酶的敲除,同时研究也发现降解途径关键酶SHMT对L-丝氨酸产量影响最为重要[3,12],而在谷氨酸棒杆菌中敲除SHMT会导致菌株无法生长。德国PETERS-WENDISCH研究发现,在L-丝氨酸合成过程中,四氢叶酸(tetrahydrogen folic acid,THFA)是SHMT的辅酶,pabAB编码的氨基脱氧分支酸合成酶(aminodeoxychorismate synthase,ADC synthase)是叶酸合成途径的关键酶,他们通过敲除pabAB减少辅酶构建了重组菌,但是该重组菌为叶酸缺陷型,在添加0.1 mmol/L叶酸时L-丝氨酸的产量为8.51 g/L,在20 L发酵罐L-丝氨酸的最终产量为36.26 g/L[3-4]。本课题组以1株能够直接利用糖发酵生产L-丝氨酸的谷氨酸棒杆菌SSAAI为出发菌株[13],通过常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变得到高产突变菌株A36[14],对出发菌株SSAAI和突变菌株A36进行全基因组测序及比较基因组学分析,发现高产菌株A36中叶酸代谢途径关键酶氨基脱氧分支酸合成酶编码基因pabAB426位发生突变(T426I),而氨基脱氧分支酸合成酶基因突变对酶活力、菌株生长及产L-丝氨酸影响尚未见报道。
本文在以谷氨酸棒杆菌SSAAI及其诱变菌株A36作为研究对象,根据诱变前后基因测序的结果对SSAAI中氨基脱氧分支酸合成酶编码基因pabAB426位进行定点突变(T426I),构建突变重组菌Kp,通过酶活力及发酵实验评价pabAB基因点突变对酶活力、菌株生长和产L-丝氨酸的影响。同时采用不同强度启动子替换高产菌株A36中氨基脱氧分支酸合成酶的启动子,考察调控氨基脱氧分支酸合成酶的酶活力对菌株生长和产L-丝氨酸的影响,为进一步构建L-丝氨酸高产菌株奠定基础。
1 材料与方法
1.1 菌株和引物
产L-丝氨酸的谷氨酸棒杆菌SSAAI与突变菌株A36为本实验室前期构建保藏[15-17],敲除质粒pK18 mobsacB和大肠杆菌JM109为本实验室保藏。本文所用引物如表1,所用菌株与质粒如表2所示。所用重组酶购自南京诺唯赞生物科技有限公司,胶回收和质粒提取试剂盒购自上海捷瑞生物工程有限公司。限制性内切酶EcoR I,XbaI,NdeI,BamH I和BglII购于TaKaRa公司。

表1 本文使用的引物Table 1 Primers used in this paper

表2 本文使用的菌株与质粒Table 2 Strains and plasmids used in this paper
1.2 培养基及培养方法
(1)种子固体培养基(g/L):脑心浸液(brain heart infusion,BHI) 37,葡萄糖20,(NH4)2SO410,K2HPO40.2,NaH2PO40.3,MgSO4·7H2O 0.5,琼脂粉20。
(2)种子液体培养基(g/L):BHI 37,葡萄糖20,(NH4)2SO410,K2HPO40.2,NaH2PO40.3,MgSO4·7H2O 0.5;装液量20 mL/250 mL三角瓶。
(3)发酵培养基(g/L):蔗糖100,(NH4)2SO430,KH2PO43,MgSO4·7H2O 0.5,FeSO4·7H2O 0.02,MnSO4·H2O 0.02,原儿茶酸(PCA) 0.03,生物素5×10-5,维生素B14.5×10-4,CaCO360。
(4)培养方法:挑取种子接种至种子液体培养基中,于30 ℃,120 r/min往复式摇床培养至对数生长期,接种至发酵培养基中,装液量为25 mL/250 mL三角瓶,初始OD562值约为1,于30 ℃,120 r/min往复式摇床培养120 h,每隔12 h取样测定生物量及L-丝氨酸产量。
1.3 pabAB基因定点突变质粒构建
以菌株A36的基因组为模板,选择pabAB基因点突变前500 bp和后500 bp为扩增目标,利用引物pabAB-F、pabAB-R扩增含点突变的同源臂基因片段。通过单片段同源重组酶将含同源臂的目的片段与经EcoRI和XbaI双酶切的质粒pK18 mobsacB连接,构建定点突变质粒。
1.4 替换启动子质粒的构建
以替换pabAB启动子为Pkan为例,采用质粒pK18 mobsacB,以A36的基因组为模板,分别利用pK-18-Pkan-1/2,pK-18-Pkan-3/4(引物上设计替换启动子序列)分别扩增除去pabAB启动子的上下游同源臂片段,片段与酶切过的质粒回收方法具体见试剂盒说明书,回收得到的上下游同源片段用多片段同源重组酶与经EcoR I和XbaI双酶切的质粒pK18 mobsacB连接得到重组质粒。
1.5 氨基脱氧分支酸合成酶的酶活力测定
总蛋白浓度的测定:参照碧云天的Bradford蛋白浓度测定试剂盒所示方法,对蛋白标准品进行测定,绘制标准曲线。蛋白浓度与OD曲线方程为y=0.575 2x+0.461,R2=0.996 1。
氨基脱氧分支酸合成酶的酶活力测定:采用科晶生物科技有限公司氨基脱氧分支酸合成酶ELISA试剂盒进行酶活力测定,酶活力与OD曲线方程为y=0.101 3x-0.005 3,R2=0.998。菌液于4 ℃,12 000 r/min离心10 min,用0.9%的生理盐水清洗3~4次,除去培养基,称取菌体约0.25 g,用5 mL 0.9%的生理盐水充分悬浮菌体,使用超声波破碎约30 min,4 ℃,12 000 r/min离心10 min,弃去沉淀取上清液,将上清液稀释一定倍数,采用Synergy H4多功能酶标仪测定OD450值,利用标准曲线换算得到对应的酶活力。
1.6 分析方法
生物量的测定:采用1 mol/L的盐酸稀释发酵液至适当浓度,然后利用紫外分光光度计于562 nm处测定OD562值作为生物量。
L-丝氨酸的测定:采用HPLC测定样品中L-丝氨酸的含量[16]。
2 结果与分析
2.1 氨基脱氧分支酸合成酶编码基因pabAB突变菌株的构建
以谷氨酸棒杆菌SSAAI及其诱变菌株A36作为研究对象,根据诱变前后基因测序的结果对SSAAI中氨基脱氧分支酸合成酶编码基因pabAB426位进行定点突变(T426I),构建突变重组菌Kp。即以菌株A36基因组为模板,利用相应引物进行PCR扩增相应基因片段pabAB,扩增片段经琼脂糖凝胶电泳验证;将线性化的pK18 mobsacB质粒连接pabAB基因片段构建重组质粒,转化大肠杆菌JM109感受态细胞;提取质粒进行琼脂糖凝胶电泳验证,并将扩增片段进行测序验证,验证正确的质粒转化谷氨酸棒杆菌SSAAI,电泳验证结果如图1所示,经过测序比对,成功获得pabAB突变株,将其命名为Kp。

M-Marker;1-pabAB PCR片段
菌株A36是本课题组前期对出发菌株SSAAI进行ARTP诱变结合高通量筛选得到的高产突变株,其生物量和L-丝氨酸产量比出发菌株SSAAI均有提高[13-14]。本课题组通过对突变菌株A36与出发菌株SSAAI进行全基因组测序及比较基因组学分析,发现诱变菌株A36中有11个基因发生非同义突变,分别为假定的转座酶编码基因K07497、UPF0176和K07146,腺苷琥珀酸裂解酶编码基因purB,假定的ABC转运蛋白编码基因ABC.CD.P,内膜转运蛋白编码基因rhtA,酪氨酸转运蛋白编码基因tyrP,DNA氧化脱甲基酶编码基因alkB,ATP结合蛋白编码基因cydC,脂肪酸合酶编码基因fas,叶酰聚谷氨酸合酶编码基因folC以及氨基脱氧分支酸合成酶编码基因pabAB[7]。其中pabAB编码的氨基脱氧分支酸合成酶是叶酸合成途径的关键酶,其与L-丝氨酸降解密切相关,PETERS-WENDISCH通过敲除pabAB构建的重组菌L-丝氨酸的产量有显著提高[3-4],而氨基脱氧分支酸合成酶基因突变对酶活力、菌株生长及产L-丝氨酸的影响有待进一步研究。
2.2 pabAB基因点突变对其酶活力的影响
出发菌株SSAAI及其突变株Kp在发酵60 h(对数生长期)和120 h(发酵结束)时氨基脱氧分支酸合成酶的酶活力如图2所示。从图2-a可以看出,在60 h时,出发菌株SSAAI与pabAB突变株Kp的比酶活力分别为1.45和1.23 U/g,突变株Kp的比酶活比SSAAI下降15.2%。从图2-b可以看出,在120 h时,出发菌株SSAAI与定点突变株Kp的比酶活力分别为0.59和0.51 U/g,定点突变后氨基脱氧分支酸合成酶的比酶活下降13.6%;说明pabAB基因426位的点突变(T426I)导致其酶活力下降。
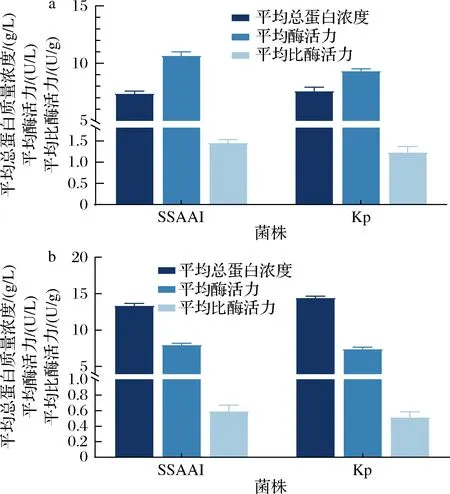
a-60 h;b-120 h
本课题组前期研究比较了产L-丝氨酸的谷氨酸棒杆菌SYPS-062以及模式菌株谷氨酸棒杆菌ATCC 13032中氨基脱氧分支酸合成酶的活力,发现产L-丝氨酸菌株中该酶的比活力比模式菌株低46.6%;同时采用反义RNA技术下调控叶酸合成关键酶基因pabAB的表达,构建的重组菌与出发菌株SYPS-062相比生长缓慢,L-丝氨酸产量却有所提高[18]。这些研究说明氨基脱氧分支酸合成酶与菌株的生长及产L-丝氨酸密切相关。
2.3 pabAB基因定点突变对菌株生长和产L-丝氨酸的影响
pabAB基因426位的点突变(T426I)对菌株生长和产L-丝氨酸的影响如图3所示。从图3-a可以看出,突变菌株Kp在120 h时最大OD562为32,比出发菌株SSAAI下降29.3%。从图3-b可以看出,突变菌株Kp在0~36 h时的比生长速率高于出发菌株SSAAI,但在36~120 h则显著低于出发菌株SSAAI。
出发菌株SSAAI及其突变菌株KpL-丝氨酸产量情况如图3-c所示。从图3-c可以看出,突变株Kp的L-丝氨酸产量为30.4 g/L,而出发菌株SSAAI的L-丝氨酸产量为26.25 g/L;说明pabAB基因426位的点突变(T426I)导致L-丝氨酸产量有所提高。从图3-c还可以看出,与出发菌株SSAAI相比,在发酵前期,Kp菌株L-丝氨酸产量变化不明显;而在发酵72 h后,L-丝氨酸产量逐渐提高,最终突变菌株Kp的L-丝氨酸产量提高15.9%。
以上研究表明,氨基脱氧分支酸合成酶的酶活力降低有利于产L-丝氨酸,而不利于菌株生长。该结果与本实验室前期及PETERS-WENDISCH的研究结果相一致[4],pabAB基因单点突变导致的酶活力及菌株生长变化为其他研究提供了参考。
2.4 调控氨基脱氧分支酸合成酶对菌株生长和产L-丝氨酸的影响
采用不同强度启动子在L-丝氨酸高产突变株A36中调控氨基脱氧分支酸合成酶的酶活力,考察其对菌株生长和产L-丝氨酸的影响。首先登陆http://www.fruitfly.org/seq-tools/ promoter.html在线网站,预测基因氨基脱氧分支酸合成酶的启动子,然后在已报道谷氨酸棒杆菌启动子库中选取强度不同的两个启动子(启动子强度差异如图4-a所示)替换菌株A36中氨基脱氧分支酸合成酶的启动子。
从图4-a可以看出,启动子Pkan强度明显弱于启动子Dap-e。利用pK18 mobsacB-Pkan/Dap-e敲除质粒在A36上进行pabAB启动子的替换,得到重组菌株A36-Pkan和A36-Dap-e。菌株在120 h时氨基脱氧分支酸合成酶的比酶活力测定结果如图4-b所示,重组菌株A36-Pkan和A36-Dap-e的氨基脱氧分支酸的比酶活力比出发菌株A36分别提高16.9%和32.6%。而采用启动子Dap-e替换导致重组菌株A36-Dap-e平均蛋白浓度有所下降,分析原因可能是蛋白测定过程中细胞的破碎程度不完全一致所导致;尽管总蛋白含量偏低,但是替换后氨基脱氧分支酸合成酶的总酶活力及比酶活力仍然较高。
重组菌株A36-Pkan和A36-Dap-e发酵结果如图5所示。从图5-a可以看出,重组菌株A36-Pkan和A36-Dap-e的最大OD562值比出发菌株A36分别提高8.3%和16%。从图5-b可以看出,重组菌株A36-Pkan在96 h前L-丝氨酸积累量高于A36,96 h后开始下降,发酵120 h时L-丝氨酸下降18.2%;重组菌株A36-Dap-e在72 h前L-丝氨酸积累量高于A36,在72 h时开始下降,发酵120 h时L-丝氨酸的积累量下降22.6%。

a-菌株生长的;b-L-丝氨酸产量
以上研究结果说明,较高的氨基脱氧分支酸合成酶的酶活力有利于菌株生长,但不利于菌株生产L-丝氨酸;该结果与本实验室前期及PETERS-WENDISCH的研究结果相一致[4,18]。尽管本文采用了实验室保藏的最弱的启动子Pkan替换改造了菌株A36,但是启动子替换后氨基脱氧分支酸合成酶的酶活力仍然比A36高,说明谷氨酸棒杆菌A36氨基脱氧分支酸合成酶的启动子强度较弱,这也为谷氨酸棒杆菌提供了新的可以选择的弱启动子。有研究表明启动子强度受到背景基因的影响较大,同时基因表达还受到多元件的协同调控[19-22]。今后可以研究采用多元件调控氨基脱氧分支酸合成酶,为构建高产L-丝氨酸的菌株奠定基础。
3 结论与讨论
本文以谷氨酸棒杆菌SSAAI及其诱变菌株A36为研究对象,根据诱变前后基因测序的结果对SSAAI中氨基脱氧分支酸合成酶编码基因pabAB426位进行定点突变(T426I),研究该突变对酶活力、L-丝氨酸产量及菌株生长的影响。结果发现氨基脱氧分支酸合成酶426位的T426I突变导致酶比活力下降,同时发现该点突变有利于菌株产L-丝氨酸,不利于菌株生长。进一步选择不同强度的启动子调控高产菌株A36中氨基脱氧分支酸合成酶的酶活力,结果发现弱启动子Pkan替换后氨基脱氧分支酸合成酶的酶活力仍然比A36高,说明菌株A36中氨基脱氧分支酸合成酶的启动子强度更弱。本研究的结果为谷氨酸棒杆菌提供了新的可以选择的弱启动子,同时为进一步构建L-丝氨酸高产菌株奠定了基础。
