贝利尤单抗治疗中重度系统性红斑狼疮的临床疗效和安全性研究
2023-10-17胥清娟刘媛媛李艳菊马凤莲郭东更
胥清娟, 刘媛媛, 陈 旭, 李艳菊, 马凤莲, 郭东更
(1.宁夏医科大学,银川 750001; 2.宁夏回族自治区人民医院风湿免疫科,银川 750001; 3.宁夏回族自治区精准医学重点实验室,银川 750001)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种复杂的慢性自身免疫性疾病,育龄期女性高发,发病率呈逐年上升趋势[1],临床表现主要为多器官、多系统受累,异质性强,易反复发作,感染和器官受累是患者死亡的主要原因[2],及时、有效和准确治疗临床中重度SLE 患者对缓解器官和系统损伤、提高其生存率极为重要。既往中重度SLE 治疗主要依靠大剂量糖皮质激素和免疫抑制剂,部分患者因长期大剂量用药导致感染、多器官功能严重损害,部分因异质性强而治疗效果不佳,影响生活质量和疾病预后。目前SLE 病因尚未明确,通常认为B 细胞高免疫活性是其重要疾病标志[3],而B 细胞激活因子(B-cellactivating factor of the TNF family,BAFF)对于B细胞的异常激活至关重要[4]。贝利尤单抗是用于SLE治疗的特异性靶向可溶性BAFF(又称BLyS)的生物抑制剂,静脉给药,通过阻断BAFF 与B 细胞上受体的结合,抑制B 细胞的存活,促进自身反应性B 细胞凋亡而减少血清中的自身抗体[5],在抑制B 淋巴细胞活化和自身免疫反应方面发挥着重要作用[6],临床联合贝利尤单抗治疗可改善症状、减少糖皮质激素用量及降低病情活动度[7]。尽管多项临床试验证实其在SLE 治疗中有效且安全性良好[8],但临床中研究报道较少,且治疗后多个时间节点实验室指标及病情活动度研究甚少。本研究通过评价贝利尤单抗在中重度SLE 治疗后不同时间节点的实验室指标和疾病活动度的改善及临床缓解率,统计不良事件发生率,评估其疗效及安全性,以期为临床用药提供一定的理论依据。
1 资料与方法
1.1 研究对象
1.1.1 研究对象的选择 本研究纳入64 例自2019 年11 月至2022 年6 月宁夏回族自治区人民医院收治的SLE 疾病活动指数(SLEDAI)评分≥10 分的SLE 患者,依据是否加用贝利尤单抗分为对照组(34 例)和贝利尤治疗组(30 例)。所有纳入研究的患者随访时间不少于6 个月。
1.1.2 纳入、排除标准 纳入标准:1)符合1997年美国风湿病学会SLE 的诊断分类标准[9];2)临床资料完整;3)获得患者知情同意。排除标准:1)狼疮危象(如精神神经狼疮、重症血小板减少性紫癜、弥漫性出血性肺泡炎、严重的肠系膜血管炎等)需大剂量激素冲击或血浆置换的患者;2)并发类风湿关节炎等其他自身免疫性疾病的患者;3)伴有非SLE 所致的严重脑、肾、心、消化道等重要器官功能不全的患者;4)近1 年内参加过其他B 细胞靶向药物治疗的患者;5)合并感染、肿瘤等疾病的患者;6)孕妇及对贝利尤单抗过敏的患者。
1.1.3 病例退出(脱落)标准 患者可以中途自愿退出用药方案。退出原因包括:撤回知情同意;患者自行退出(疗效差、有不良反应等);治疗失败、病情复发;不规律回访;怀孕;研究者判定患者不适于继续完成试验;严重并发症;严重的不良事件,如肺结核、病毒感染、败血症等。
1.2 治疗方案
所有患者均使用糖皮质激素(泼尼松或甲泼尼龙)联合免疫抑制剂治疗,糖皮质激素的用量依据为SLE 患者疾病活动度与器官受累严重程度。免疫抑制剂由临床医生根据患者具体病情选择,包括羟氯喹、环磷酰胺、吗替麦考酚酯、他克莫司、环孢素、来氟米特和甲氨蝶呤。贝利尤治疗组的治疗方案是在原有糖皮质激素联合免疫抑制剂治疗的基础上加用贝利尤单抗,剂量为10 mg·kg-1,在第0、2、4、8、16、20、24 周静脉输液治疗。
1.3 临床疗效评价指标
记录患者一般特征(性别、年龄、体质量、体表面积、病程),评估两组患者在治疗前及治疗后4、8、12、24 周的SLEDAI 评分、医生整体评估(PGA)、每日口服泼尼松剂量(或其等效剂量)及实验室检查指标:血沉(ESR)、补体C3、补体C4、免疫球蛋白G(IgG)、抗双链DNA 抗体(抗dsDNA 抗体)及外周血淋巴细胞亚群。
1.4 SLE 临床缓解评估
评估两组患者的带药临床缓解及带药完全缓解[10],见表1。

表1 SLE 临床缓解定义
1.5 安全性评估
随访24 周,记录两组患者在治疗期间发生的相关不良事件,包括上呼吸道感染、泌尿系感染、肝肾功能毒性、带状疱疹、肌肉疼痛。
1.6 统计学方法
采用SPSS 21.0 统计学软件进行数据处理。相关统计图采用GraphPad Prism 9 软件进行可处理。所有变量均进行正态性检验,对于符合正态分布的计量资料以均数±标准差(±s)表示,组内治疗前后比较采用配对t 检验,组间比较采用独立样本t 检验。不符合正态分布的计量资料以中位数和四分位间距M(P25,P75)表示,组间比较采用Wilcoxon 秩和检验。计数资料用例数或百分比(%)表示,组间比较采用χ2检验。以P≤0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前特征
贝利尤治疗组共30 例患者,其中男性2 例,女性28 例,病程0.8~204 个月,平均36(12,96)个月;对照组共34 例,其中男性2 例,女性32例,病程0.3~212 个月,平均30(7,72)个月。两组治疗前特征比较,差异均无统计学意义(P 均>0.05),见表2。
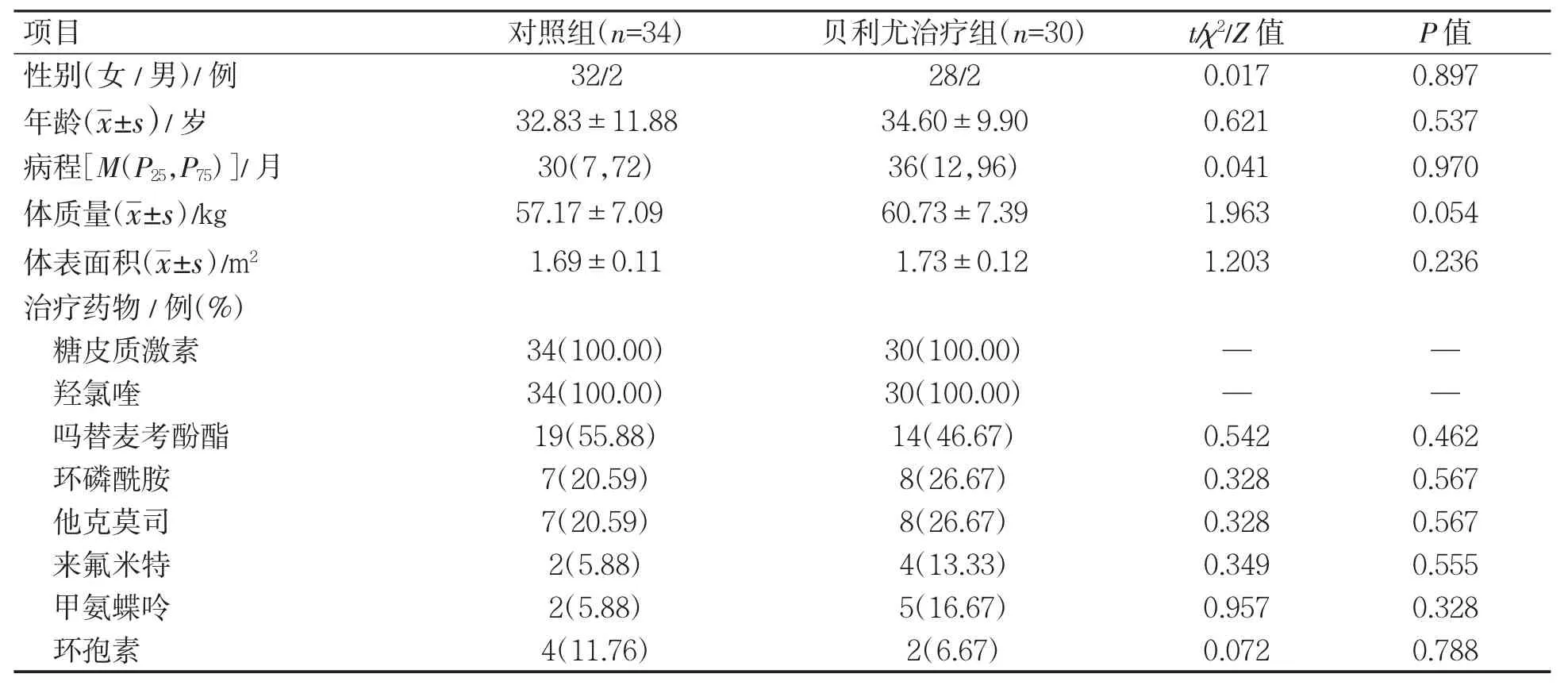
表2 两组患者治疗前特征比较
2.2 两组患者随访情况
贝利尤治疗组中3 例退出(1 例因肾脏损害缓解不明显调整用药,2 例分别在第8 周和第12周时因无法调整用药方案而退出)。对照组中有3 例退出(2 例治疗过程中失访,1 例因病情新发合并症调整用药)。贝利尤治疗组24 周失访率与对照组差异无统计学意义(P=0.872)。
2.3 两组患者治疗前后临床指标比较
2.3.1 治疗前后抗dsDNA 抗体的比较 两组患者治疗24 周后抗dsDNA 抗体均降低,贝利尤治疗组在治疗后12 周(P=0.033)、24 周(P=0.041)抗dsDNA 抗体均低于对照组,见图1。

图1 两组治疗前后抗dsDNA 抗体比较
2.3.2 治疗前后实验室指标、活动度评分及每日泼尼松剂量比较 与治疗前相比,贝利尤治疗组患者ESR 在治疗后4 周降低,对照组在治疗后8周降低(P 均<0.05);贝利尤治疗组患者ESR 在治疗后12 周和24 周均低于对照组(P 均<0.05)。贝利尤治疗组C3、C4 于治疗后8 周开始高于治疗前(P 均<0.05),对照组C3 于治疗后12 周开始高于治疗前,C4 于治疗后8 周开始高于治疗前(P 均<0.05);贝利尤治疗组C3 在治疗后4 周开始高于对照组(P 均<0.05),两组间C4 差异无统计学意义(P>0.05)。两组IgG 在治疗后第4、8、12、24 周均低于治疗前(P 均<0.05)。两组SLEDAI评分在治疗后4、8、12、24 周均降低(P 均<0.05);贝利尤治疗组在治疗后8 周开始低于对照组(P均<0.05)。两组每日泼尼松剂量在治疗后4 周均开始减少,贝利尤治疗组每日泼尼松剂量在治疗8 周后低于对照组(P 均<0.05),见图2。
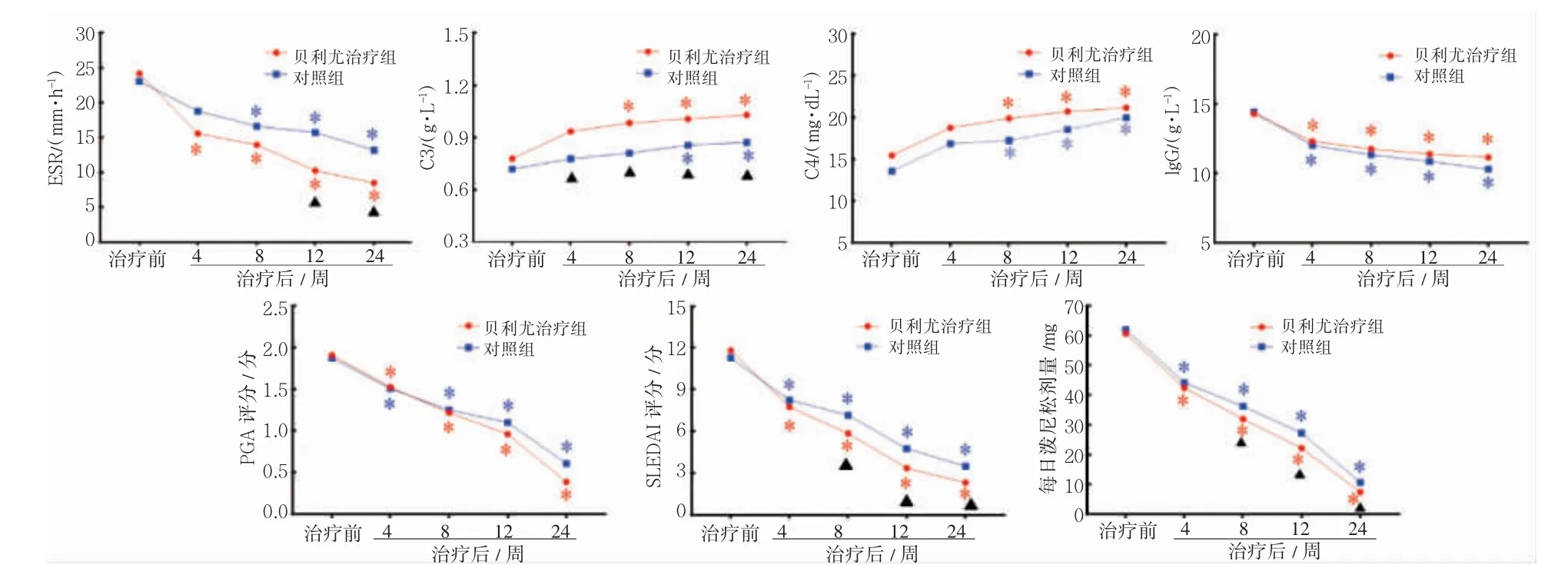
图2 两组治疗前后实验室指标、活动度评分及每日泼尼松剂量比较
2.3.3 治疗前后淋巴细胞亚群水平比较 贝利尤治疗组和对照组总B 细胞在治疗后4、8、12、24周均低于治疗前(P 均<0.05),贝利尤治疗组总B细胞数仅在第8 周低于对照组(P<0.05)。贝利尤治疗组CD4+T 细胞在治疗后第4、8、12 周均低于治疗前(P 均<0.05),对照组在治疗后与治疗前差异无统计学意义(P 均>0.05);贝利尤治疗组CD4+T 细胞在治疗后第4、8 周均低于对照组(P 均<0.05)。贝利尤治疗组CD4+/CD8+水平在治疗后第4、8、12 周均低于治疗前(P 均<0.05),对照组在治疗后各时差异无统计学意义(P 均>0.05);贝利尤治疗组CD4+/CD8+水平在治疗后第4、8 周均低于对照组(P 均<0.05)。总T 细胞、CD8+T 细胞和NK 细胞的组内和组间比较差异均无统计学意义(P 均>0.05),见图3。
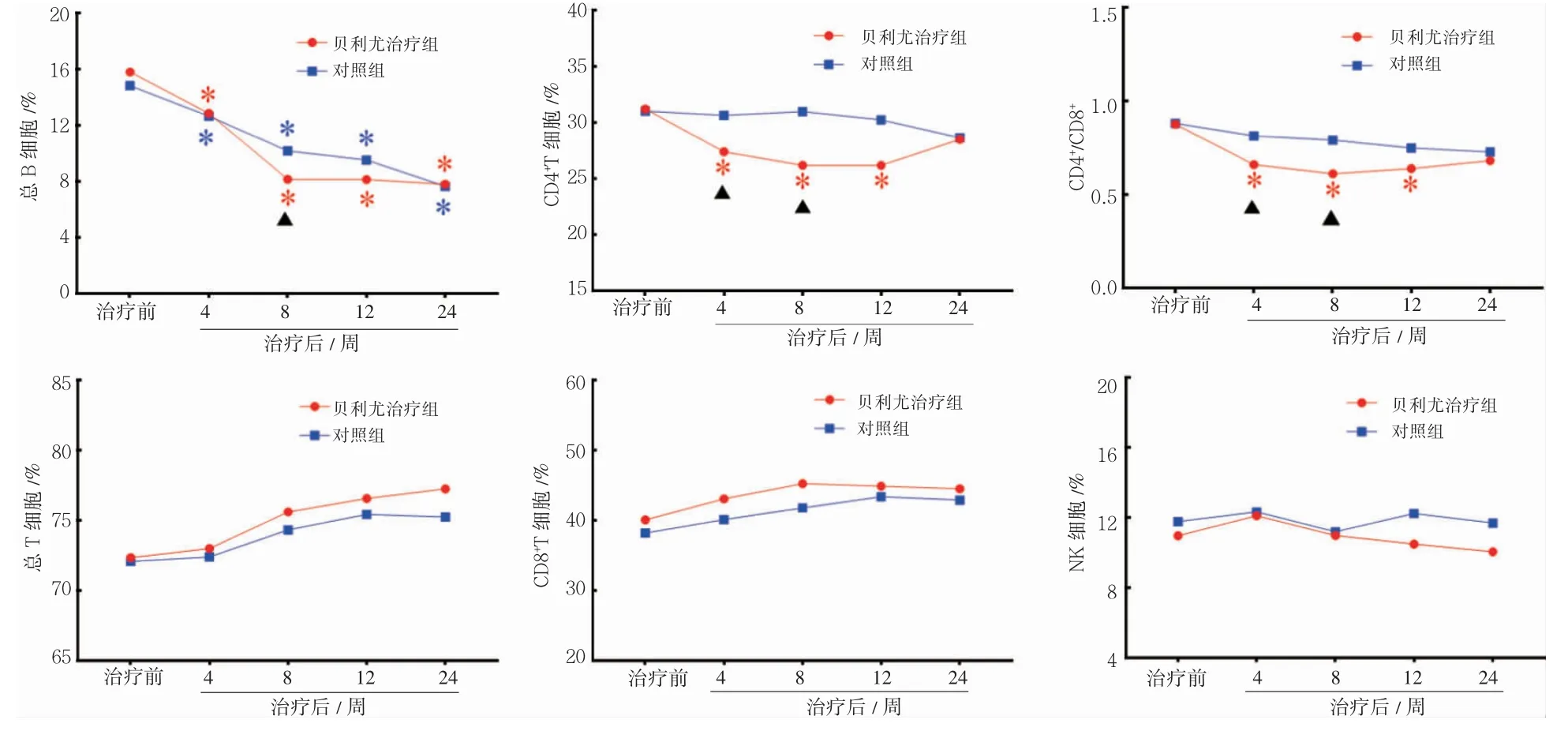
图3 两组治疗前后淋巴细胞亚群水平比较
2.4 两组患者治疗前后临床表现及器官受累改善情况
治疗前,两组患者器官受累差异无统计学意义(P 均>0.05)。治疗后24 周,贝利尤治疗组肾脏病变低于对照组(χ2=4.391,P=0.036),两组其余器官受累情况差异无统计学意义(P 均>0.05),见表3。
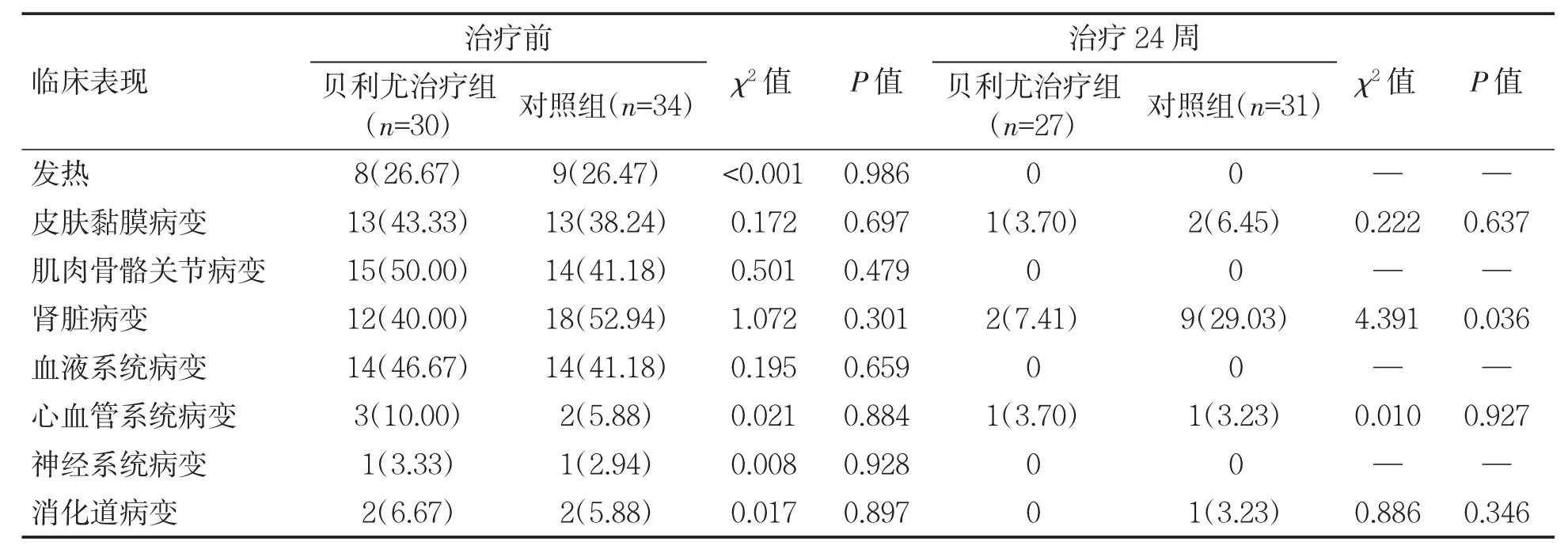
表3 两组患者治疗前后临床表现及器官受累改善情况[例(%)]
2.5 两组患者随访24 周临床缓解情况比较
治疗24 周后贝利尤治疗组11 例患者达到带药临床缓解,对照组4 例达到带药临床缓解,贝利尤治疗组的带药临床缓解率高于对照组(χ2=5.832,P=0.016),两组带药完全缓解差异无统计学意义(P>0.05),见表4。
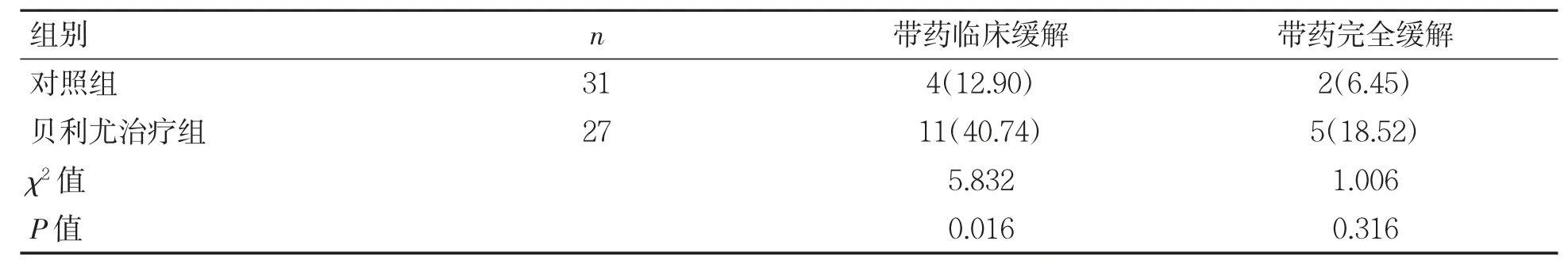
表4 两组患者随访24 周临床缓解情况比较[例(%)]
2.6 两组患者不良事件发生率比较
两组患者治疗后不良事件,均以感染多见,两组间不良事件发生率比较,差异无统计学意义(P>0.05),见表5。

表5 两组患者不良事件发生率比较[例(%)]
3 讨论
贝利尤单抗是一种重组人IgG-1λ 单克隆抗体[11],主要通过抑制BAFF,促进初始B 细胞凋亡,减少血清中自身抗体的产生,降低器官损害,且SLE作为标准治疗的补充,疗效和耐受性良好[12-14]。
多项研究[15-17]证实,贝利尤单抗在降低激素用量、SLEDAI 评分、PGA 评分、抗dsDNA 抗体滴度及升高补体等方面具有优势。本研究结果表明,两组患者治疗后血沉均降低,第12 周开始贝利尤治疗组低于对照组。两组C3、C4 在治疗后均有改善,贝利尤治疗组改善时间早于对照组。两组患者每日泼尼松剂量均减少,从第8 周开始贝利尤治疗组低于对照组,提示贝利尤单抗可更早协助糖皮质激素减量。两组治疗后SLEDAI 评分和PGA 评分均降低,自治疗后第8 周开始,贝利尤治疗组的SLEDAI 评分低于对照组,提示在缓解病情活动度方面,贝利尤治疗组带药临床缓解率高于对照组,提示联合贝利尤单抗治疗可更早、更快地改善实验室指标及病情活动指数,更早达到临床缓解。
另外,有研究[18-19]表明,经贝利尤治疗后,B细胞、IgG 有下降趋势,但随着治疗周期延长,其下降趋于稳定,而T 细胞可正常或轻微降低。也有研究[20]发现,使用贝利尤单抗治疗SLE 患者6个月后,患者CD4+T 细胞、CD8+T 细胞分别与治疗前水平比较,差异均无统计学意义。本研究结果表明,贝利尤治疗组总B 细胞和CD4+T 细胞在治疗后第4 周降低,而对照组仅总B 细胞自第8周开始降低,两组间比较贝利治疗组总B 细胞和CD4+T 细胞仅在治疗期间低于对照组,但随着治疗时间的延长,差异无统计学意义。两组治疗后IgG 均降低,总T 细胞、CD8+T 细胞和NK 细胞在治疗前后无明显变化,提示联合贝利尤单抗治疗能更早影响B 细胞及CD4+T 细胞,但随着治疗周期延长,机体的免疫功能逐步达到平衡状态,亦可能与原发病的病情控制后其激素剂量减少有关。此外,有研究显示,在活动性SLE 患者中,CD4+/CD8+水平明显降低,调节和纠正CD4+/CD8+比例是治疗SLE 的关键[21]。本研究中,贝利尤治疗组的CD4+/CD8+水平在治疗第4 周与第8 周呈下降趋势,从第12 周开始逐渐升高,但两组患者治疗24 周后的CD4+/CD8+差异未见统计学意义,考虑可能与单中心研究样本量少且随访周期短有关,后续需继续追踪贝利尤单抗在纠正CD4+/CD8+比例失衡方面的作用。
SLE 器官损害对疾病的预后至关重要。贝利尤单抗对不同器官功能缓解方面的研究报道不一:有学者认为贝利尤单抗治疗对改善SLE 患者黏膜以及肌肉骨骼受累的效果最好[22],对其他组织器官受累改善的研究证据有限[23];Tanaka 等[24]认为贝利尤单抗在改善皮肤黏膜、肌肉骨骼和血液系统方面与安慰剂组无明显差异;Furie 等[25]的研究表明接受贝利尤单抗治疗的患者,肾脏相关事件或死亡危险性低于接受安慰剂组。本研究随访24 周,贝利尤治疗组治疗后在肾脏缓解方面优于对照组,而其他器官损害如皮肤黏膜损害、骨骼肌肉损害、心脏损伤、神经系统损害和消化道损害方面两组无差异,对此,后续可扩大样本量并增加随访时间,以亚组分析其在不同器官方面的临床获益。
在安全性方面,贝利尤单抗安全性良好[26],其不良事件以感染为主[15,17,27]。本研究结果中,两组患者感染发生率较高,包括泌尿系感染、上呼吸道感染和带状疱疹,可能与药物治疗后对体液免疫的影响有关,提示在B 细胞减少的情况下,残留的B 细胞群保留了体液免疫所必需的B 细胞功能[28],细胞免疫和天然免疫功能可能未影响,从而保障机体抵御感染的能力,激素剂量减少亦可降低患者感染风险。其他不良事件包括药物肝、肾毒性和肌肉疼痛,但并未影响疾病的整体治疗。
综上所述,贝利尤单抗在治疗中重度SLE 中有着较好的疗效和安全性,可尽快降低疾病活动度并减少激素用量,尽早达到疾病缓解的目的,使中重度SLE 患者临床受益。
