透明质酸修饰纳米粒在超声-微泡介导下的体外靶向性与安全性评价
2023-10-17陶宏宇张芙蓉王晨雨
陶宏宇, 朱 珊, 孙 楠, 张芙蓉, 王晨雨, 王 文
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏医科大学总医院超声科,银川 750004)
RNA 干扰技术(RNA interference,RNAi)可通过双链RNA(double-stranded RNA,dsRNA)的定向干预来实现对靶点基因的沉默作用,目前被广泛应用于肿瘤及多种疾病的基础研究中[1-2]。由高分子材料合成制备的新型纳米粒作为一种非病毒核酸递送载体,可实现对dsRNA 的高效包载与体内稳定运输,相较传统的病毒载体有着较高的生物安全性及较低的制备成本,具有广阔的研究与应用前景[3-4]。本实验设计并制备了由透明质酸(hyaluronic acid,HA)修饰的新型纳米粒核酸递送载体(HDP@siRNA NPs),通过检测其体内外生物安全性以及在超声-微泡(ultrasoundmicrobubble,US-MB)干预所产生的一系列生物效应介导下的体外细胞转染靶向性,探索该纳米粒作为新型核酸递送载体的应用潜力。
1 材料与方法
1.1 主要试剂及仪器
聚乳酸-羟基乙酸共聚物(PLGA-COOH,济南岱罡生物工程有限公司),(2,3-二油酰基-丙基)-三甲基铵-氯盐(DOTAP,上海艾伟拓医药科技有限公司),HA(镇江东元生物科技有限公司),NC-siRNA、Cy3-siRNA(广州市锐博生物科技有限公司),聚乙烯醇(PVA,美国Sigma-Aldrich公司),磷酸盐缓冲液(PBS,美国HyClone 公司),焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理水(美国ThermoFisher 公司),GelRed 核酸染料(美国Thermo Fisher 公司),声诺维超声微泡(SonoVue,意大利Bracco 公司),超声纳米材料粉碎仪(上海ZOLLO 公司),Malvern 激光粒度仪(英国Malvern公司),透射电镜(TEM,日本奥林巴斯株式会社),NanoDrop 2000 分光光度计(美国Thermo Fisher公司),低强度聚焦超声仪(LIFU,重庆融海超声医学工程研究中心有限公司),多功能酶标仪(美国BioTek 仪器有限公司)等。
1.2 实验细胞与动物
4T1 肿瘤细胞购于中国科学院上海细胞库,SPF 级BALB/c 小鼠(雌性,4 周龄,体质量16~18 g,)购于宁夏医科大学实验动物中心。
1.3 HDP@siRNS NPs 的制备
采用超声乳化溶剂挥发联合两步静电吸附法制备HDP@siRNA NPs,具体制备流程如下:称取PLGA 10 mg、DOTAP 3.5 mg 溶于二氯甲烷作为油相。配制2% PVA 溶液10 mL 作为水相,将水相与油相充分混合,置于超声纳米材料粉碎仪探头下,冰浴条件震荡3 min(强度35%,占空比2 s∶3 s)。磁力搅拌过夜以挥发有机溶剂;经0.45 μm 微孔滤膜过滤,离心洗涤3 次(4 ℃,14 000 r·min-1,15 min),收集固体沉淀重悬于DEPC 水中,即得到PLGA-DOTAP NPs。逐滴滴入NC-siRNA 溶液,轻轻混匀,室温孵育1 h,至此得到DP@siRNA NPs(非靶向纳米粒),配制1%的HA 溶液100 μL 逐滴滴入,混匀后室温孵育2 h,再次经0.45 μm 微孔滤膜滤过,即制备得到HDP@siRNA NPs(靶向纳米粒)。制备载Cy3-siRNA 的荧光纳米粒时应严格避光,并在4 ℃避光条件下保存。
1.4 纳米粒的凝胶阻滞实验与包封率测定
按不同的氮/磷比值(N/P,代表DOTAP 与siRNA 的投入量配比)制备DP@siRNA NPs,加入GelRed 染色的琼脂糖凝胶中进行RNA 电泳,结束后进行荧光凝胶成像,未结合的siRNA 会在凝胶板正极显示出荧光条带,根据结果筛选出最合适的siRNA 投入量。
采用超滤离心法测定纳米粒中siRNA 的包封率。按最优投入量制备纳米粒,置于10 kd 超滤离心管中,离心取下层滤液,使用Nano-Drop 2000 分光光度计测定RNA 浓度,计算滤液中的siRNA 总量。siRNA 的包封率=[(siRNA 总投入量-下层滤液中siRNA 量)∕siRNA 总投入量]×100%。
1.5 纳米粒的外观形态与基本表征测定
将稀释好的HDP@siRNA NPs 样品置于透射电镜下,观察其外观形态;使用Malvern 激光粒度仪分别测定纳米粒的粒径及Zeta 电位,每个样本重复测定3 次,取平均值;将纳米粒于4 ℃、保存15 d,期间每隔3 d 分别取样测定粒径,以检测体外稳定性。
1.6 纳米粒中siRNA 的体外释放实验
将HDP@siRNA NPs 置于EP 管中,于37 ℃恒温摇床振荡(100 r·min-1)。分别于不同时间点(0、6、12、24、48、72、96、120、144、168 h)离心取上清液,测定RNA 浓度,根据结果绘制siRNA 的体外释放曲线,纳米粒中siRNA 的释放率=(上清液中siRNA 总量/siRNA 总投入量)×100%。
1.7 US-MB 介导下纳米粒体外转染细胞靶向性实验
分为以下几组进行体外靶向性实验:单独Cy3-siRNA 组、DP@Cy3-siRNA NPs 组、HDP@Cy3-siRNA NPs 组、HDP@Cy3-siRNA NPs+US-MB组。先将各组4T1 细胞按5×104个/孔接种于6 孔板中培养过夜,以100 nmol·L-1为转染终浓度加入Cy3-siRNA 或纳米粒,协同干预组还需加入浓度为15%的SonoVue 微泡,后用LIFU 进行超声辐照(探头置于6 孔板下,使用超声耦合剂隔离空气;脉冲模式辐照:2 W·cm-2,90 s,占空比50%),每组设置3 个复孔。之后各处理组细胞避光孵育24 h,用DAPI 染色细胞核,于荧光倒置显微镜下观察并拍照,使用Image J 软件分析各处理组荧光强度值。
1.8 纳米粒的体内外生物安全性实验
首先按共孵育纳米粒中siRNA 的不同浓度梯度(0、10、30、50、100、150 nmol·L-1)对4T1 细胞进行分组,另按不同的共孵育方式分为3 个处理亚组:DP@siRNA NPs 组,HDP@siRNA NPs 组,HDP@siRNA NPs+SonoVue 组,每组设置3 个实验复孔。将4T1 细胞按8×103个/孔接种于96 孔板中培养过夜,分别加入稀释好的纳米粒及SonoVue 微泡(微泡浓度15%),共孵育24 h 后加入CCK-8 试剂,使用酶标仪测定在450 nm 波长处每孔的吸光度值,细胞存活率=[(实验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)]×100%。
将健康的BALB/c 小鼠依据所给药物不同分为以下组:Control 组(注射生理盐水200 μL/只)、HDP@siRNA NPs 组及HDP@siRNA NPs+SonoVue组(纳米粒中siRNA 终浓度为100 nmol·L-1,注射量200 μL/只,SonoVue 微泡注射量100 μL/只),每组3 只小鼠。经小鼠眶后静脉丛注射纳米粒及SonoVue 微泡进行给药,以初次给药记为实验开始时间,至第28 天实验结束,实验期间每3 d 给药1 次,每7 d 测量1 次小鼠体在麻醉状态下对小鼠进行眼球摘除取血,经低温高速离心后提取各组样品血清,检测各组小鼠心脏的肌酸激酶(CK)、乳酸脱氢酶(LDH)、肝脏的丙氨酸转氨酶(ALT)、天冬氨酸氨基转移酶(AST)、肾脏的血清肌酐(CREA)、尿素氮(BUN)水平。小鼠处死后取出心、肝、脾、肺、肾各器官组织进行石蜡包埋,脱蜡至水,行苏木精-伊红(HE)分别染色细胞核与细胞质,在显微镜下观察各器官组织的病理变化。
1.9 统计学方法
采用SPSS 23.0 与GraphPad Prism 8.0 软件进行数据处理及统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用t 检验,多组间比较采用方差分析。P≤0.05 为差异有统计学意义。
2 结果
2.1 纳米粒的外观形态与基本表征
按照1.3 中的方法成功制备得到HDP@siRNA NPs,重悬于PBS 后呈淡白色半透明状,其在透射电镜下表现为形态均一的球形三层结构(图1)。由3 种纳米粒的基本表征测定结果可知,随着投入原材料种类的增加,纳米粒的粒径逐渐增大,Zeta 表面电位实现了由正转负的电位偏转过程(表1)。经4 ℃、15 d 保存后,三种纳米粒在不同时间点粒径变化差异无统计学意义(P>0.05)(图2)。

表1 三种纳米粒的基本表征结果
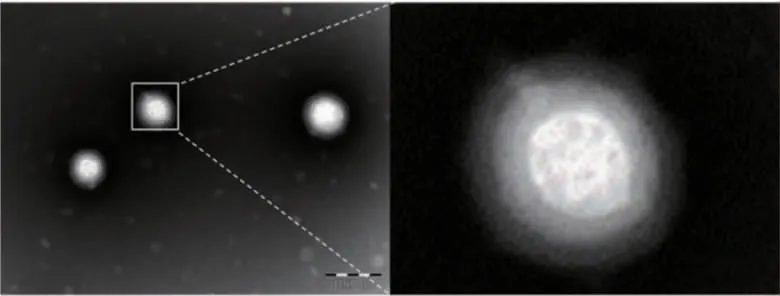
图1 HDP@siRNA NPs 的透射电镜下外观(标尺:100 nm)

图2 三种纳米粒不同时间点的粒径变化
2.2 纳米粒与siRNA 结合能力的评价
根据纳米粒凝胶阻滞实验结果可知,随着N/P 比值的增大,位于电泳正极的游离siRNA 荧光亮度逐渐减弱,表明其对siRNA 的结合能力逐渐增强,当N/P 比值为12∶1 时,正极荧光基本消失(图3)。以N/P 比值12∶1 为最佳原料配比,制备纳米粒,测得siRNA 包封率分别为DP@siRNA NPs:(80.21±1.89)%,HDP@siRNA NPs:(77.05 ±2.28)%,均维持在较高水平。

图3 纳米粒的凝胶阻滞实验结果
2.3 纳米粒中siRNA 的体外释放率
HDP@siRNA NPs 中siRNA 的释放量随时间的延长逐渐增多,前24 h 为突释期,释放量为总投入量的(25.93±1.49)%,之后释放速率减缓,至168 h 的总释放率可达到(72.71±3.06)%,整体呈现体外缓释效果(图4)。

图4 HDP@siRNA NPs 的体外释放曲线
2.4 US-MB 介导下纳米粒转染4T1 细胞靶向性评价
随着处理因素的增加,细胞质中荧光Cy3-siRNA 的聚集逐渐增多(图5)。使用Image J 软件分析各组Cy3红色荧光强度值,HDP@Cy3-siRNA NPs+US-MB 组的荧光强度值最高,为单独siRNA 转染组的3.98 倍(P<0.001)、非靶向NPs 组的1.71 倍(P<0.001)、靶向NPs 组的1.39 倍(P 均<0.001),见图6。

图5 不同处理组转染4T1 细胞后的荧光图像

图6 不同处理组转染4T1 细胞后的荧光强度比较
2.5 纳米粒的体内外生物安全性评价
随着纳米粒共孵育浓度的增加,不同处理组4T1 细胞存活率均有一定程度的下降。当浓度升至150 nmol·L-1时,DP@siRNA NPs 组的细胞存活率已低于50%,而HDP@siRNA NPs 组细胞存活率仍保持在80%以上(P<0.001),同时,SonoVue 微泡的加入并未对细胞存活率产生明显的影响(P>0.05),见图7。
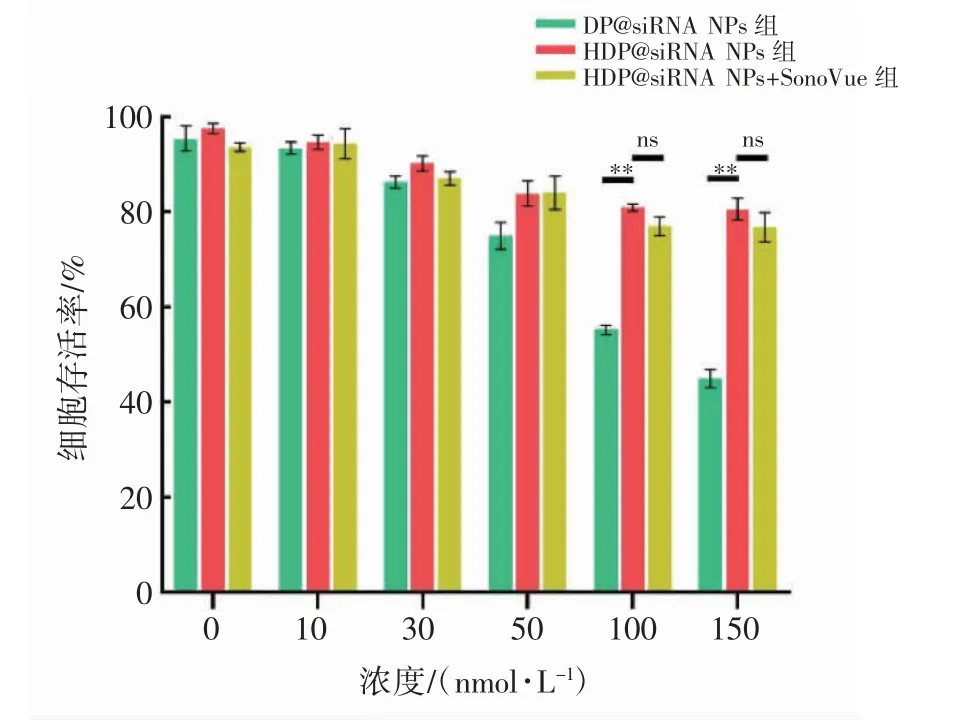
图7 CCK-8 法检测纳米粒对4T1 细胞存活率的影响
对健康小鼠定期注射纳米粒及SonoVue 微泡期间,在同一时间点,三组小鼠的体质量差异均无统计学意义(P 均>0.05),见图8;给药结束后的血清生化检测及主要器官病理HE 染色结果显示,三组小鼠心、肾、肝功能基本指标(CK、LDH、ALT、AST、CREA、BUN)水平差异均无统计学意义(P 均>0.05),见图9;主要器官(心、肝、脾、肺、肾)未见异常损害情况,见图10。

图8 三组小鼠不同时间点体质量的比较

图9 三组纳米粒处理小鼠血生化指标检测结果
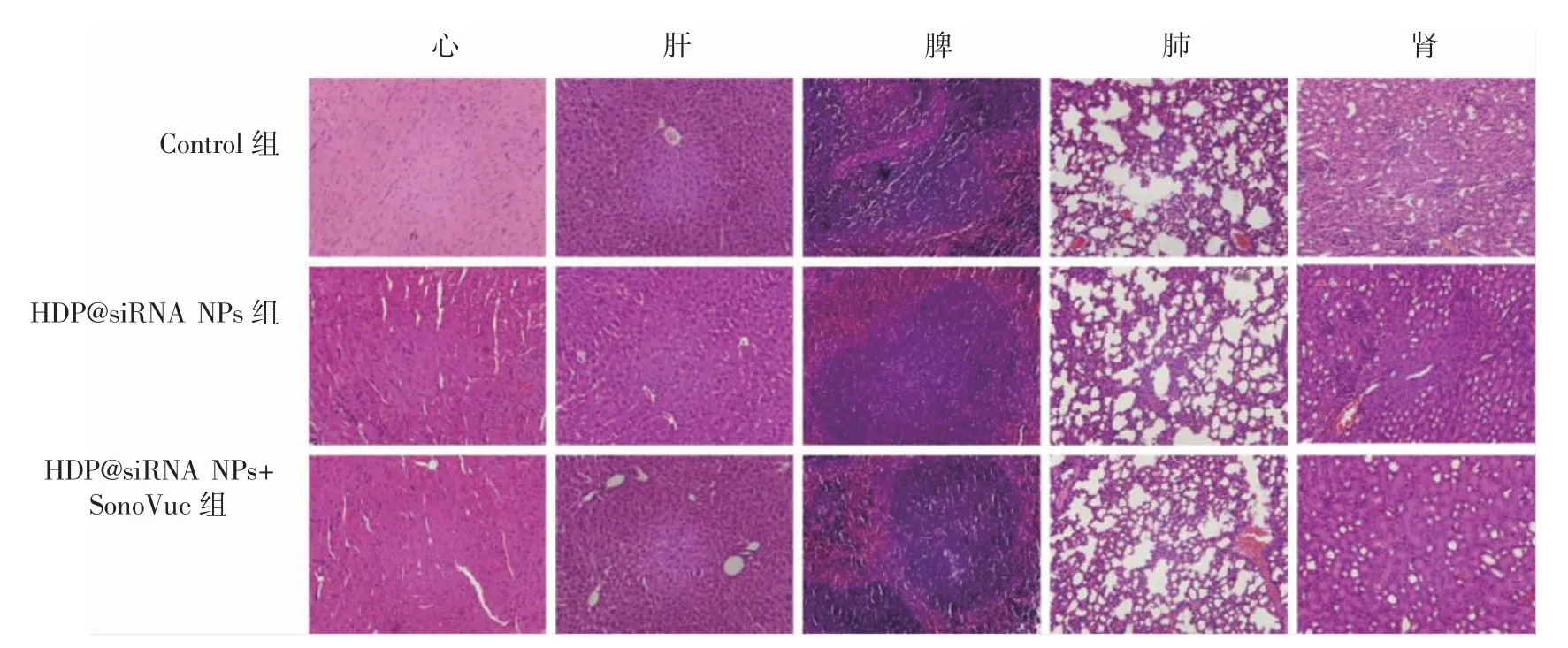
图10 三组小鼠主要器官病理检测结果(HE×200)
3 讨论
RNAi 作为一项分子生物学新兴技术,被广泛应用于众多疾病的基础科研中,所使用的dsRNA 可准确干预靶点基因的转录、翻译过程,从而实现特异性基因沉默的效果[5-6]。dsRNA 本身极易被存在于人体及体外环境中的核酸酶降解,因而需要借助核酸递送载体来实现高效转染及运输[7]。过去,以慢病毒为主的病毒核酸递送载体是进行dsRNA 递送的主要方式,但其本身生物安全性较低,同时还存在制备工艺复杂且成本高等问题[8]。随着高分子材料领域研究不断取得进展,由新型材料合成的非病毒核酸递送载体近年来受到研究者们的重视,其中包括纳米粒、脂质体、纳米胶束等[7,9]。通过对载体所用材料及制备工艺的优化,可使其本身具备较高的生物安全性与低免疫原性,并实现对核酸的高效包载、释放及体内稳定运输[10]。同时,通过对载体表面进行靶向因子的修饰,可使载体本身靶向细胞表面特异性受体,经由“受体-配体”介导的内吞作用增加细胞对药物的吸收,进而提升RNAi 干预效率[11-12]。
本研究中制备的纳米粒核酸递送载体HDP@siRNA NPs,以高分子材料PLGA 为内核,外围包裹了阳离子脂质DOTAP,其作为正电荷材料可通过静电吸附效应结合携带负电荷的siRNA 及HA。通过测定粒径以及Zeta 表面电位结果可知,在分别进行两步静电吸附的过程中,纳米粒的粒径逐渐增加,电位实现了由正转负的“电位偏转”,这也间接表明纳米粒各部分的连接成功。其中,HA 位于纳米粒结构的最外层,作为靶向因子修饰纳米粒载体,可使纳米粒具备靶向肿瘤细胞表面高表达的CD44 受体的能力[13]。由于HA 本身为人体内正常存在的自有物质,其作为外层材料可降低DOTAP 所带来的高细胞毒性作用[14-15]。由本实验结果可知,第二步静电吸附HA 的过程并未干扰第一步吸附的siRNA 的包封率,以最优工艺制备的HDP@siRNA NPs 有着较高的体内外生物安全性,同时加入SonoVue 微泡共孵育并未对其安全性产生影响。
在体外转染靶向性实验中,HDP@siRNA NPs组转染的细胞表现出比DP@siRNA NPs 组更好的荧光siRNA 聚集效果,同时在US-MB 介导下,转染效果得到了进一步提升。超声辐照爆破微泡造影剂产生的微射流及冲击力,通过在细胞表面形成“空化效应”及“声孔效应”,可提高细胞膜的通透性,并在膜表面短暂打开可逆或不可逆的“小孔”,进而有利于纳米粒药物进入胞内发挥作用[16-17]。在本次实验中,通过LIFU 对SonoVue 微泡造影剂进行爆破,所使用的LIFU 参数参考了先前的实验研究,并在此基础上减少了超声作用时间,以减少其对细胞的不必要伤害[18-19]。
综上所述,本研究成功设计并制备了携带siRNA 的HA 修饰纳米粒核酸递送载体,可实现对siRNA 的高效包载与体外缓释,该靶向纳米粒具有较好的体内外生物安全性,对肿瘤细胞的体外转染靶向性较高,在联合US-MB 介导时可使转染效率进一步提高。该研究依然存在着以下不足之处:1)本次纳米粒只对NC-siRNA(空白小干扰RNA)进行包载,后续实验中需包载针对特定基因的siRNA,进而探索该纳米粒对目的基因及蛋白的干预效果。2)本次生物安全性实验仅在体外实验中加入了非靶向纳米粒DP@siRNA NPs 干预组,在体内实验中并未设计,这同样需要在后续实验中进一步完善补充。总之,HDP@siRNA NPs作为一种自制的新型非病毒核酸递送载体,具有较高的应用价值与研究潜力,本研究为后续在细胞及动物模型上进行纳米粒干预治疗研究打下了较好的基础。
