邻苯二甲酸二(2-乙基己基)酯通过氧化损伤介导PI3K/Akt信号通路对大鼠的神经毒性作用
2023-10-17刘贺荣陈晓珍雷瑞琛李丽萍
王 鑫, 刘贺荣, 陈晓珍, 杨 怡, 雷瑞琛, 朱 粤, 李丽萍
(1.宁夏医科大学公共卫生学院,银川 750004; 2.宁夏环境因素与慢性病控制重点实验室,银川 750004;3.宁夏医科大学总医院病理科,银川 750004)
邻苯二甲酸二(2-乙基己基)酯[di(2-ethylhexyl)phthalate,DEHP]是一类典型的邻苯二甲酸酯类环境内分泌干扰物,作为增塑剂广泛应用于个人洗护用品、家居装饰、食品包装袋、儿童玩具中[1],因其以非共价键的形式与物品结合,所以很容易游离至物品表面,并进入到环境中[2],可通过消化道、呼吸道、皮肤等途径进入机体,危害人类健康[3]。流行病学研究[4-5]表明,暴露DEHP 与注意缺陷多动障碍患病率之间存在明显相关性;动物研究发现,暴露于750 mg·kg-1DEHP 的鹌鹑头部出现挛缩、站立不稳、眼球震颤、吞咽困难、羽毛生长不足、意识躁狂和反射亢进等异常改变[6],然而关于DEHP 的神经毒性作用机制尚不清楚。海马组织在记忆的形成、导航和认知方面起着极其重要的作用,能够对焦虑和认知等行为产生调控能力[7]。CA1、CA2 与CA3 这3 个部分构成了海马组织,CA2 区与CA1 区侧锥体神经元能够敏锐感知氧化应激,产生改变,特别是CA1 区海马神经元,对外界环境的损伤抵御能力最弱[8]。有研究[9]发现,0.1 mol·L-1和0.3 mol·L-1的DEHP 暴露能够抑制神经元的兴奋性和突触可塑性的关键原因是阻碍CA1 锥体细胞的钾通道,最终对大鼠的空间学习与记忆力产生危害。氧化应激可能会加速神经元的衰老,并引发多种神经性疾病中的细胞凋亡[10]。DEHP 能够使过氧化物酶体内的各种基因进行编码,使其基因进行选择性转录,从而进入氧化应激状态[11]。有研究[12]表明,氧化应激可影响磷脂酰肌醇-3-激酶/蛋白激酶B(phosphati dylinositol-3-kinase/protein kinase B,PI3K/Akt)信号通路,通过降低PI3K 磷酸化水平进而抑制其下游蛋白激酶B(protein kinase B,Akt)磷酸化。PI3K/Akt 信号通路存在于哺乳动物体内,它们受细胞外界信号的控制,对保护细胞的生命活动起着举足轻重的作用。Bcl-2作为PI3K/Akt 信号通路的关键效应因子,当PI3K/Akt 通路被激活后,细胞开始发生凋亡,表现为Bcl-2 生成量增加,Bax 表达被抑制[13]。Caspase-3 是凋亡发生的主要执行者,Cleaved Caspase-3 是细胞凋亡的生物标志物[14]。因此,本实验通过建立亚慢性动物模型,探讨DEHP 染毒对雄性大鼠神经行为的影响及DEHP 对神经毒性的可能机制,为进一步探索暴露DEHP 后神经毒性的机制研究提供基础。
1 材料与方法
1.1 主要试剂与仪器
DEHP(中国国药集团有限公司);GAPDH 抗体、AKT Rabbit Polyclonal Antibady(Proteintech公司,美国);p-Akt、PI3K、Phospho-PI3 Kinase p85(CST 公司,美国);山羊抗兔IgG(北京中杉金桥生物科技有限公司);聚偏氟乙烯膜(0.22 μm,PVDF 膜)(Millipore,美国);Amersham Hybond P0.45 PVDF blotting membrane(Cytiva,美国);乌拉坦(北京百灵威科技有限公司);超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)试剂盒均购自南京建成生物工程研究所;玉米油(山东三星科技有限公司);DEHP(中国国药集团有限公司);多功能酶标仪(美国BioTek 有限公司);旷场设备及数据采集装置(上海欣软信息科技有限公司)。
1.2 实验动物与分组
SPF 级SD 雄性大鼠40 只,3 周龄,体质量50~70 g,由宁夏医科大学实验动物中心提供,动物合格证号:SCXK(宁)2020-0001,实验动物福利伦理委员会审查编号:IACUC-NYLAC-2021-165。大鼠于室温22~25 ℃,湿度50%~70%,12 h 光照/12 h 黑夜条件下饲养,自由饮水和进食。实验动物随机划分为4 组,即溶剂对照组(玉米油)、187 mg·kg-1DEHP 组(1/160 LD50)、375 mg·kg-1DEHP 组(1/80 LD50)、750 mg·kg-1DEHP 组(1/40 LD50),每组10 只,经口灌胃染毒,每周染毒6 d,休息1 d,染毒8 周。动物行为学实验后,20%乌拉坦麻醉,心尖取血处死大鼠,采集生物标本待测。
1.3 观察指标
1.3.1 一般状况、体质量变化 染毒期间观察大鼠一般毒性作用表现,每周称量各组大鼠体质量。
1.3.2 脏器系数的测定 心尖取血处死大鼠后,迅速采集大鼠脑组织称重,并计算脑脏器系数。脏器系数(%)=脏器湿重(g)/体质量(g)×100%。
1.3.3 Morris 水迷宫(morris water maze,MWM)定位巡航实验 动物预先训练后开始正式实验,将小鼠面向池壁分别从4 个入水点放入水中,使用自动录像系统记录小鼠找到平台所需时间,即逃避潜伏期,若60 s 内未找到平台,将大鼠引向平台,记录其潜伏期为60 s,连续测试5 d。空间探索实验:定位航行结束次日撤除平台,在原平台象限的对侧象限记录大鼠入水6 s 的游泳轨迹,并记录60 s 内小鼠穿越原平台的次数。
1.3.4 旷场实验(open field test,OFT) 将旷场划分为中心区域与外周区域。使用成像系统记录大鼠的运动轨迹及运动时各区域的停留时间。实验开始时,实验人员用手握住鼠尾2/3 处,将大鼠朝向固定的方向,动作轻柔地放在中心点,大鼠自由探索5 min,期间记录大鼠总的运动路程、跨格子数、在中心区域的运动路程等。每次实验结束,使用75%的乙醇清理旷场。
1.3.5 氧化应激水平测定 将大鼠脑组织开颅后,取完整脑组织,沿矢状面一分为二,在一侧脑组织中取海马组织,使用网搓法,边搓边用PBS冲洗,收集细胞悬液,1 500 r·min-1离心10 min,去上清,加入荧光探针DCFH-DA(1∶1 000),检测海马组织悬液中的ROS 水平。采用专用试剂盒测定血清中SOD、GSH-Px 和MDA 的含量,严格按照产品使用说明书步骤进行操作并完成结果计算。
1.3.6 脑组织苏木精-伊红染色(HE)病理形态观察 取部分脑组织,用体积分数为10%的中性甲醛对其进行固定,随后使用体积分数为95%的乙醇进行脱水,用二甲苯进行透明,依次进行浸蜡、包埋和切片(脑切片4 μm),苏木素染色,使用光镜观察海马组织病理形态的改变。
1.3.7 脑组织海马透射电镜超微病理形态观察 海马固定后,梯度乙醇脱水,丙酮置换,浸透包埋、切片,最后染色与拍照。
1.3.8 RT-qPCR 法测定大鼠海马组织PI3K、Akt mRNA 水平 采用RT-qPCR 测定大鼠海马组织中PI3K、Akt、Bcl-2、Bax、Caspase-3 mRNA 水平。具体方法按照试剂盒说明进行。首先提取大鼠海马组织中总RNA,并将总RNA 逆转录为cDNA,其次使用RT-qPCR 仪进行PCR 扩增,反应条件:95 ℃、30 s,95 ℃、5 s,60 ℃、30 s,40 个循环,利用2-ΔΔCt法计算各组基因mRNA 水平。计算公式为:mRNA 水平=2-ΔΔCt×100%,ΔΔCt=实验组(Ct目的基因-Ct内参基因)-对照组(Ct目的基因-Ct内参基因)。根据美国国立生物技术信息中心(NCBI)提供的PI3K、Akt、Bcl-2、Bax、Caspase-3 mRNA 引物序列,引物设计、合成由生工生物工程(上海)股份有限公司完成,引物序列见表1。

表1 引物序列
1.3.9 Western blot 测定大鼠海马组织PI3K、Akt、Bcl-2、Bax、Caspase-3 蛋白表达 使用磷酸化蛋白提取试剂盒裂解海马组织,用BCA 蛋白检测试剂盒检测蛋白浓度,按比例加入5×loading buffer,上样体积15 μL/孔,蛋白上样量为60 μg/孔。电泳条件:浓缩胶80 V、20 min,分离胶120 V、60 min。转膜采用0.22 μm PVDF 膜湿转。5%脱脂牛奶室温封闭2 h,封闭完TBST 洗膜3 次,每次10 min,4 ℃孵育一抗过夜,孵育完TBST 洗膜3 次,每次5 min,室温孵育二抗(1∶5 000)1 h,TBST 洗膜3 次,每次6 min。ECL 化学发光液曝光拍照,利用Image J 软件进行蛋白条带灰度分析。
1.4 统计学方法
采用Excel 2019 进行数据录入,用SPSS 28.0统计学软件进行数据分析,GraphPad Prism 8 软件绘制柱状图。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD-t 检验。检验水准α=0.05。
2 结果
2.1 DEHP 染毒对大鼠体质量的影响
各组大鼠染毒期间未见明显毒性作用表现。与对照组比较,各DEHP 染毒组大鼠体质量差异均无统计学意义(P 均>0.05),见图1。

图1 DEHP 染毒对大鼠体质量的影响(±s,n=10)
2.2 DEHP 染毒对大鼠脑组织脏器系数的影响
与对照组比较,各DEHP 染毒组大鼠脑组织脏器系数差异均无统计学意义(P 均>0.05),见图2。
2.3 DEHP 染毒对大鼠神经行为的影响
2.3.1 水迷宫实验 在定位巡航实验中,大鼠巡航距离和首次穿越平台时间随训练时间增加而减少;同一时间点巡航距离与对照组比较,各DEHP 染毒组大鼠差异均无统计学意义(P 均>0.05);在空间探索实验中,与对照组相比,750 mg·kg-1DEHP 组大鼠在60 s 内穿越平台次数减少(P<0.05),见图3。
2.3.2 旷场实验 与对照组相比,总路程各DEHP染毒组差异均无统计学意义,375 mg·kg-1DEHP组、750 mg·kg-1DEHP 组中心路程和跨格子数均减少(P 均<0.05),见图4。

图4 DEHP 染毒对大鼠旷场试验的影响(±s,n=5)
2.4 DEHP 染毒对大鼠氧化应激的影响
2.4.1 DEHP 染毒对大鼠海马组织ROS 水平的影响 与对照组相比,750 mg·kg-1DEHP 组活ROS 相对含量升高(P<0.05),见图5。

图5 DEHP 染毒对大鼠ROS 表达相对含量的影响(±s,n=3)
2.4.2 DEHP 染毒对大鼠血清MDA、SOD、GSHPx 水平的影响 与对照组相比,750 mg·kg-1DEHP组中SOD 与GSH-Px 水平降低,MDA 水平升高(P 均<0.05),187 mg·kg-1DEHP 组与375 mg·kg-1DEHP 组SOD 水平降低(P 均<0.05),见图6。

图6 DEHP 染毒对大鼠SOD、MDA、GSH-Px 的影响(±s,n=6)
2.5 DEHP 染毒对大鼠海马组织病理形态的影响
实验结果发现,对照组海马CA1 区细胞排列有序,细胞核大而圆,清晰可见。DEHP 染毒组海马CA1 区细胞出现了不同程度的核固缩现象,见图7。

图7 DEHP 对大鼠脑海马组织病理形态的影响
2.6 DEHP 染毒对大鼠海马组织超微病理形态结构的影响
通过透射电镜可以观察到,对照组海马CA1区的神经细胞形态完整,细胞核大且饱满,核仁清晰,核内染色质分布均匀,细胞内细胞器如线粒体、粗面内质网能清晰观察到;187 mg·kg-1DEHP 组核膜皱缩,染色质沉积,内质网轻微扩张,线粒体嵴局部轻微溶解、消失形成空泡,高尔基体肿胀。375 mg·kg-1DEHP 组核膜模糊不清,线粒体数目增多,双层膜结构模糊不清,内质网扩张伴核糖体脱落,出现“脱颗粒”现象。750 mg·kg-1DEHP 组出现部分染色质凝集,核膜部分溶解,核仁不清,线粒体畸形,部分线粒体溶解透明成为空泡,见图8。

图8 DEHP 对大鼠海马组织超微结构的影响(×10 000)
2.7 DEHP 染毒对大鼠海马组织中PI3K/Akt 信号通路的影响
2.7.1 DEHP 染毒对大鼠海马PI3K、Akt、Bcl-2、Bax、Caspase-3 mRNA 表达的影响与对照组相比,375 mg·kg-1DEHP 组、750 mg·kg-1DEHP 组PI3K、Akt 与Bcl-2 mRNA 水平降低(P 均<0.05);375 mg·kg-1DEHP 组、750 mg·kg-1DEHP 组Bax、Cleaved Caspase-3 mRNA 水平升高(P 均<0.05),187 mg·kg-1DEHP 组Bax mRNA 水平升高(P<0.05);各DEHP 染毒组Bcl-2/Bax mRNA 水平均降低(P 均<0.05),见图9。
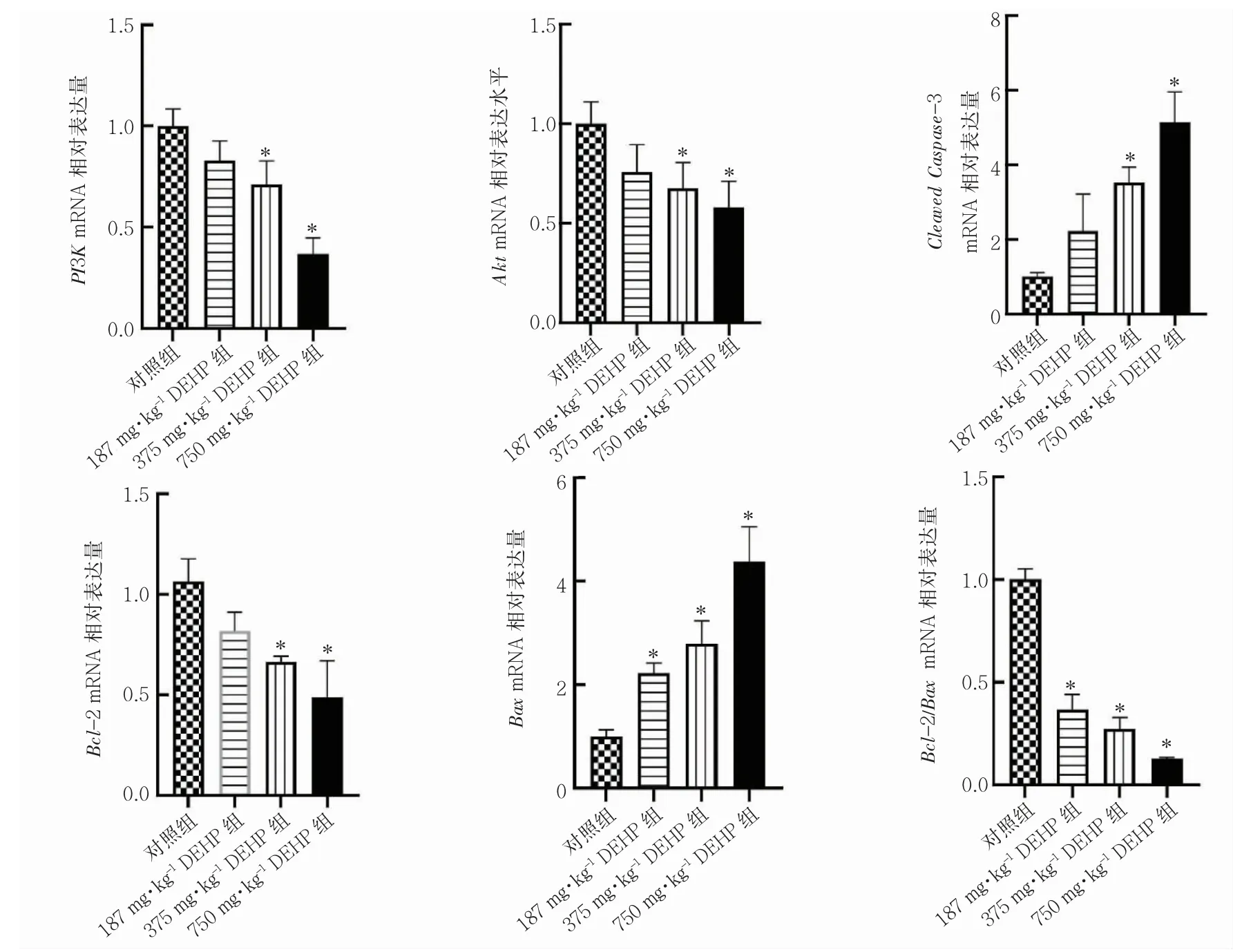
图9 DEHP 染毒对PI3K、Akt、Bcl-2、Bax、Cleaved Caspase-3 mRNA 水平的影响(±s,n=3)
2.7.2 DEHP 染毒对大鼠海马PI3K、Akt、Bcl-2、Bax、Cleaved Caspase-3 蛋白相对表达水平的影响与对照组相比,各DEHP 染毒组PI3K、p-PI3K、Bcl-2 蛋白及Bcl-2/Bax 比值均降低(P 均<0.05),375 mg·kg-1DEHP 组与750 mg·kg-1DEHP 组Akt 与p-Akt 蛋白相对表达水平、p-PI3K/PI3K蛋白相对表达水平降低(P 均<0.05);750 mg·kg-1DEHP 组p-Akt/Akt 蛋白相对表达水平降低(P<0.05);各DEHP 染毒组Cleaved Caspase-3 蛋白相对表达水平均升高(P 均<0.05),750 mg·kg-1DEHP组Bax 蛋白相对表达水平升高(P<0.05),见图10。

图10 Western blot 检测DEHP 染毒对PI3K/Akt 通路相关蛋白表达的影响(±s,n=3)
3 讨论
近年来,DEHP 的神经毒性作用日益受到众多学者的关注,但DEHP 暴露对神经毒性作用的具体机制尚不明确。本研究通过构建亚慢性动物模型,以雄性大鼠为研究对象,探讨DEHP 暴露对大鼠神经行为的影响及潜在机制,为DEHP 的神经毒性作用研究提供基础。
体质量作为一项综合指标能够衡量动物的健康和生长状况,在毒理学实验中,实验动物的一般毒性作用可以用体质量的变化来评价[15]。本研究中,未观察到DEHP 染毒对大鼠体质量产生影响。脏器系数可反映外源化学物毒性的综合情况,若器官发生水肿、充血等变化,则该比值可能会增高[16]。本次研究各DEHP 染毒组大鼠脑组织的脏器系数与对照组比较,差异均无统计学意义。Morris 水迷宫实验评价动物空间学习和记忆能力,主要参数为穿越平台次数、定位航行潜伏期和目标象限探索时间[14]。本研究结果显示,与对照组相比,大鼠巡航距离、首次穿越平台时间差异无统计学意义;空间探索实验中,与对照组相比,各DEHP 染毒雄性大鼠60 s 内穿越平台次数减少,375 mg·kg-1DEHP 组与750 mg·kg-1DEHP 组中大鼠水中运动路径不规则,缺乏目的性,表明DEHP 染毒后大鼠的空间学习与记忆功能可能受损,而DEHP 对学习记忆能力的影响可能与染毒剂量有关,这与其他研究者关于DEHP喂养大鼠致大鼠空间学习受损的结论一致[17]。旷场实验可以反映大鼠的探索行为,中间区域停留的时间与进入中间区域的次数是旷场实验的主要参数[18]。本研究结果显示,与对照组相比,375 mg·kg-1DEHP 组与750 mg·kg-1DEHP 组中心路程和跨格子数减少,表明DEHP 染毒对大鼠探索行为产生了影响。氧化应激表明机体氧化系统与抗氧化系统失衡[10]。机体内氧化还原系统无法维持平衡时,机体累积的ROS 引起脂质过氧化,若在脑组织中发生氧化应激可能会对学习记忆产生损伤[12]。SOD 和GSH-Px 是体内的主要抗氧化酶,它们可以通过清除ROS 来保护细胞免受氧化应激的伤害[16]。机体中多不饱和脂肪酸过氧化的最终产物MDA,其过量产生与ROS 的增加有关,该指标可以反映机体内脂质过氧化的程度[19]。本研究结果显示,与对照组相比,750 mg·kg-1DEHP 组活性氧相对含量升高,750 mg·kg-1DEHP组中SOD 与GSH-Px 水平降低,MDA 水平升高,187 mg·kg-1DEHP 组与375 mg·kg-1DEHP 组SOD 水平降低,表明DEHP 暴露可引起机体发生氧化应激,并且随着DEHP 染毒剂量的升高,氧化应激水平上升,氧化产物超过了机体的清除能力,进而产生氧化损伤。有研究[20]表明,小鼠暴露于DEHP 3 周后,小鼠体内中的ROS 水平和MDA含量会逐渐上升,SOD 活性会下降。
海马组织位于大脑皮质,作为大脑边缘系统的重要组成部分,是机体学习和记忆储存的部位之一,在记忆的形成、导航和认知方面起着极其重要的作用[7]。本研究结果显示,DEHP 染毒组海马CA1 区细胞出现了不同程度的核固缩现象。进一步通过透射电镜发现,DEHP 组可不同程度地引起大鼠海马组织神经元细胞核膜皱缩,染色质沉积,线粒体嵴局部轻微溶解、消失形成空旷,高尔基体肿胀,内质网扩张伴核糖体脱落,出现“脱颗粒”现象,部分线粒体溶解透明成为空泡,表明DEHP 暴露可引起成年雄鼠海马神经元的损伤,这与任文强[21]的研究结论一致。
PI3K/Akt 信号通路可缩短神经前体细胞的细胞间期,使该细胞迅速进入细胞分裂期,因而可使神经细胞的增殖和分化进程加快,进而促进神经细胞的增殖、分化,对神经的再生修复有着极大的促进作用[22]。氧化应激产生的分子通过阻断PI3K/Akt 介导的修复能力作用于PI3K/Akt 信号通路。Bcl-2/Bax/Caspase-3 是参与细胞凋亡的重要信号通路,当发生氧化应激时,Bcl-2 表达下降,Bax 表达增加,而最终能否进入凋亡要计算Bcl-2/Bax 比值。Bax 游离到线粒体外膜,促使细胞色素C 等移动到细胞质中。细胞色素C 激活下游分子Caspase-3 使DNA 修复酶发生断裂,最终使细胞发生凋亡[23]。
本次研究进一步检测PI3K、Akt、Bcl-2、Bax、Caspase-3 相关基因和蛋白水平变化,结果发现,与对照组相比,375 mg·kg-1DEHP 组与750 mg·kg-1DEHP 组PI3K、Akt 与Bcl-2 mRNA 表达水平降低;375 mg·kg-1DEHP 组与750 mg·kg-1DEHP 组Bax 与Caspase-3 mRNA 表达水平升高,187 mg·kg-1DEHP 组Bax mRNA 表达水平升高,各DEHP 染毒组Bcl-2/Bax 比值降低。蛋白表达水平结果显示,与对照组相比,各DEHP 染毒组PI3K 与p-PI3K 蛋白相对表达水平降低,Bcl-2 相对蛋白表达水平与Bcl-2/Bax 比值降低,375 mg·kg-1DEHP 组与750 mg·kg-1DEHP 组Akt 与p-Akt蛋白相对表达水平降低,各DEHP 染毒组Cleaved Caspase-3 蛋白相对表达水平升高,750 mg·kg-1DEHP 组Bax 蛋白相对表达水平升高,表明DEHP 暴露可抑制PI3K/Akt 磷酸化水平,进而作用于下游Bcl-2、Bax 与Caspase-3 蛋白,促进海马细胞凋亡的发生。Wu 等[24]研究发现,DEHP 处理NE-4C 细胞后Cleaved Caspase-3 和Bax 蛋白水平升高,Bcl-2 蛋白水平降低。
综上所述,暴露DEHP 后大鼠的空间记忆能力受损,其机制可能是通过诱导机体氧化应激水平升高,抑制了PI3K/Akt 磷酸化水平,上调了Bax与Cleaved Caspase-3 表达水平,进而抑制Bcl-2蛋白的表达,从而导致海马组织内细胞的凋亡。
