MEHP 对小鼠睾丸间质细胞DNA 甲基化水平和细胞周期进程的影响
2023-10-17翁晓梦宋贝贝黄金瑞德小明李丽萍张亚娟张鹏举
翁晓梦, 李 玲, 宋贝贝, 黄金瑞, 德小明, 李丽萍,张亚娟, 张鹏举
(1.宁夏医科大学公共卫生学院职业卫生与环境卫生学系,银川 750004; 2.宁夏环境因素与慢性病控制重点实验室,银川 750004)
邻苯二甲酸酯类(phthalic acid esters,PAEs),又称为塑化剂,因其能够软化塑料、增加弹性,被广泛应用于合成橡胶、黏合剂、涂料等生产用品。以邻苯二甲酸二(2-乙基己基)酯(DEHP)为代表的塑化剂类物质在聚合物分子中以范德华力结合,导致其在高温等条件下易解离逸散,并主要通过口腔、皮肤、呼吸道和静脉途径进入人体[1]。在多器官系统中,DEHP 的毒性是由邻苯二甲酸单(2-乙基己基)酯(MEHP)介导产生的[2]。邻苯二甲酸酯及其代谢物可在男性精液中检测到,其中DEHP 和邻苯二甲酸二丁酯(dibutyl phthalate,DBP)及其代谢产物MEHP、邻苯二甲酸单丁酯(MBP)是备孕男性精浆中主要的邻苯二甲酸酯类型,精液中邻苯二甲酸酯代谢物浓度对精液质量有不利影响[3]。目前,已有研究[4-5]从表观遗传学的角度来探讨PAEs 类物质的生殖毒性机制,在MEHP 致小鼠睾丸间质细胞(TM-3)雄性生殖损伤方面,对DNA 甲基化水平的研究还较少。本研究拟以TM-3 为受试细胞,检测MEHP 染毒对TM-3 细胞DNMT1、DNMT3B、转录因子FOXO1、细胞周期蛋白依赖性激酶2(CDK2)、细胞周期抑制因子P27 mRNA 表达改变的影响,探讨MEHP对TM-3 细胞DNA 甲基化水平和周期进程的影响,以期为进一步阐明DNA 甲基化水平在MEHP致TM-3 细胞雄性生殖损伤中的作用提供研究思路和方向。
1 材料与方法
1.1 细胞株来源、主要仪器和试剂
TM-3 细胞(美国ATCC 细胞研究中心)。HF90 CO2培养箱(上海力申科学仪器有限公司),I510全波长酶标仪(赛默飞世尔公司),BioRad 荧光实时定量PCR 仪[伯乐生命医学产品(上海)有限公司],柱形核酸纯化产品、PrimeScriptTMRT Master Mix 反转录试剂盒、TB GreenPremix Ex TaqTMⅡ实时荧光定量试剂盒[宝生物(大连)工程有限公司]、目的基因及内参基因引物[生工生物工程(上海)股份有限公司]、MEHP 标准品(纯度为97%,美国Sigma 公司),DMEM 培养基、胎牛血清(美国Gibco 公司),DNMT1 抗体(美国Cell Signaling Technology 公司),全蛋白提取试剂盒、BCA 蛋白定量检测试剂盒、细胞周期检测试剂盒(江苏凯基生物技术股份有限公司),DNMT3B、FOXO1、β-actin 抗体(美国Proteintech 公司),其他试剂均为国产分析纯。
MEHP 染毒液配制:用适量的无菌DMSO 标准品稀释质量为0.5 g 的MEHP 标准品,配制成浓度为1.80 mol·L-1的MEHP 染毒液,然后用无菌培养基稀释成浓度为1 600 μmo·lL-1的MEHP 母液备用,实验前按梯度稀释成200、400、800 μmol·L-1的染毒液。
1.2 TM-3 细胞培养
复苏TM-3 细胞,离心弃掉冻存液,加入新鲜配制的浓度为10%的完全培养基,培养48 h后换液;待细胞增殖至对数生长期,弃去旧培养基,加入3 mL PBS 清洗,清洗结束后加入1 mL胰酶消化30 s,然后加入4 mL 完全培养基终止消化,轻柔吹打细胞,制成单细胞混悬液,将细胞混悬液分为两份置于两个新培养瓶中,最后加入2 mL 完全培养液定容至4 mL,混匀,于37 ℃、5% CO2、100%相对湿度培养箱中培养。
1.3 染毒浓度选择
体外培养TM-3 细胞,根据课题组前期研究成果,按照0、200、400、800 μmol·L-1共4 个梯度进行分组。采用CCK-8 法检测细胞活力,取处于对数生长期的TM-3 细胞,胰酶消化后加入完全培养基配成细胞混悬液,然后吸取100 μL 加入96 孔板(约8 000 个/孔),置于37 ℃、5% CO2细胞培养箱中培养6~8 h。待细胞贴壁后弃去旧培养基并加入5-Aza-Cdr 溶液(0、10-4、10-3、10-2、10-1、10 μmol·L-1),再将96 孔板放置于37 ℃、5% CO2、100%湿度的细胞培养箱中染毒24 h。弃去染毒液并向各孔中加入10 μL 的CCK-8 检测液,于37 ℃培养箱继续孵育1~2 h,在酶标仪450 nm波长下检测各孔光密度(OD)值并计算细胞活力,细胞活力(%)=[(染毒组OD-空白组OD)/(对照组OD-空白组OD)]×100%。确定最终的染毒浓度后,设置对照组(0 μmol·L-1)、400 μmol·L-1MEHP 染毒组和MEHP(400 μmol·L-1)+5-Aza-Cdr(10-4μmol·L-1)干预组。
1.4 Western blot 检测相关蛋白表达水平
TM-3 细胞经过MEHP 染毒24 h 后,弃去培养基,先用冷PBS 洗涤3 次,用刮匙刮下贴壁细胞并转移到1.5 mL 离心管内,向每管加入150~300 μL 细胞裂解液,于涡旋振荡器振荡30 s,冰上放置4 min,重复5 次。离心机12 000×g、4 ℃离心5 min 后取上清为全蛋白提取物;用BCA 蛋白定量法检测蛋白浓度。加入适量的裂解缓冲液和5×上样缓冲液配制蛋白上样体系20 μL,100 ℃变性5~10 min 后分装蛋白。根据蛋白分子质量并利用SDS-PAGE 凝胶电泳技术跑胶,结束后转膜至孔径为0.45 μm 的PVDF 膜上。用5%脱脂奶粉封闭2 h 后,加入1∶1 000 稀释比例的一抗并于4 ℃冰箱孵育过夜。用PBST 洗膜3 次后,加入1∶2 000 稀释比例的二抗室温孵育1 h,用PBST 洗膜3 次后经化学发光法曝光观察目的蛋白条带。以β-actin 为内参蛋白。结果采用Image J软件定量分析条带灰度值。
1.5 RT-qPCR 检测细胞周期相关基因mRNA表达水平
用柱形核酸纯化试剂盒提取细胞总RNA,然后根据反转录试剂盒说明书进行cDNA 合成,以此为模板进行PCR 扩增(引物序列见表1),扩增条件:95 ℃、30 s,95 ℃、5 s,55 ℃、30 s,45 个循环。并以95 ℃、10 s,65 ℃、5 s,95 ℃、5 s,测定熔解曲线,以β-肌动蛋白(β-actin)为内参基因,目的基因的mRNA 相对表达量用2-ΔΔCt方法计算。

表1 CDK2、P27、β-actin 基因RT-qPCR 引物序列
1.6 流式细胞术检测细胞周期
TM-3 细胞处理后,收集细胞,制备单细胞悬液,离心后去除上清,加入500 μL 70%冷乙醇固定细胞,4 ℃保存过夜;第2 天用PBS 洗去固定液,再加入500 μL 工作液,室温避光30~60 min,上机检测。
1.7 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,每项实验均重复3 次以上。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t 检验,检验水准α=0.05。
2 结果
2.1 MEHP 毒性效应
2.1.1 相关蛋白表达水平 与0 μmol·L-1组(1.00±0.00)相比,400、800 μmol·L-1MEHP 染毒组DNMT1 蛋白表达水平[(0.63±0.06)、(0.47±0.04)]均降低(P 均<0.01),DNMT3B 蛋白表达水平[(1.50±0.13)、(1.62±0.10)]均升高(P 均<0.01),200、400、800 μmol·L-1MEHP 染毒组FOXO1 蛋白表达水平[(1.28±0.03)、(1.66±0.10)、(2.21±0.14)]均升高(P 均<0.01),见图1。
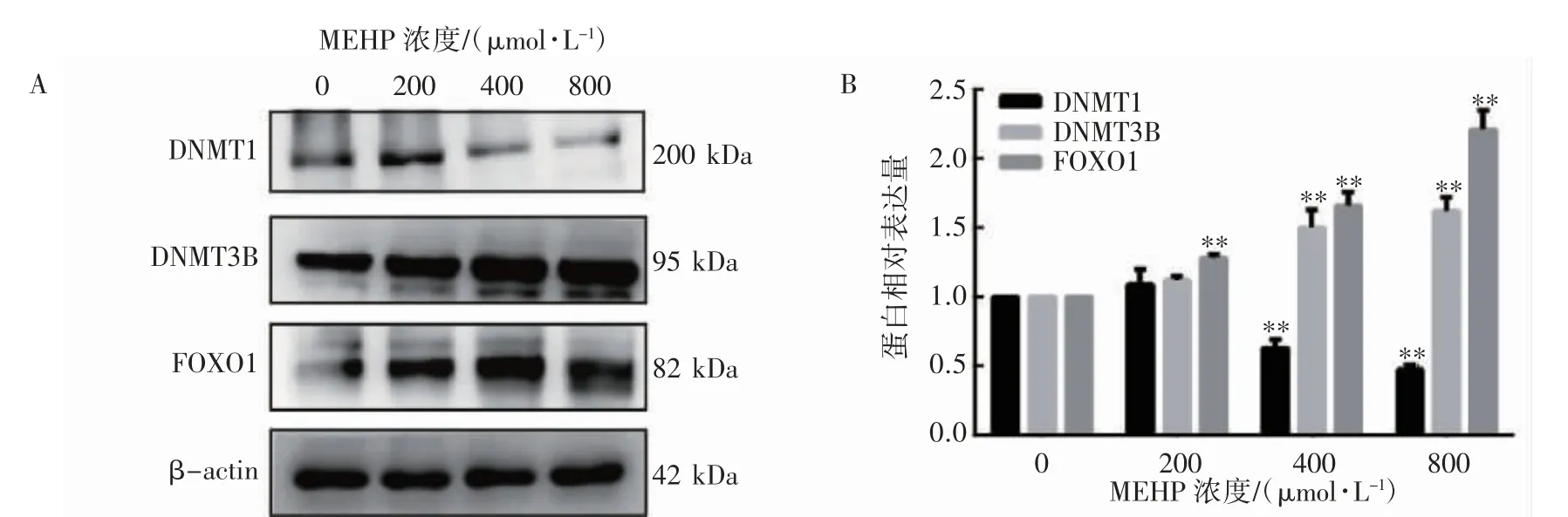
图1 不同浓度MEHP 对TM-3 细胞相关蛋白表达影响(24 h)
2.1.2 细胞周期各时相分布情况 与0 μmol·L-1组相比,400 μmol·L-1组细胞在G1 期分布比例增加,S 期分布比例降低,800 μmol·L-1组细胞在G1 期分布比例减少,S 期和G2 期分布比例增加,MEHP 染毒导致TM-3 细胞增殖受阻,见图2和表2。

图2 不同浓度MEHP 处理TM-3 细胞各周期时相分布情况(24 h)
表2 不同浓度MEHP 处理24 h 后TM-3 细胞各周期时相分布(n=3,±s)

表2 不同浓度MEHP 处理24 h 后TM-3 细胞各周期时相分布(n=3,±s)
与0 μmol·L-1 组比较**P<0.01。
MEHP 浓度/(μmol·L-1)G1 期S 期G2 期0 80.34±1.4017.24±1.402.42±0.01 20080.36±1.0317.93±0.901.72±0.13 40089.75±1.23**5.46±0.61**4.79±0.62 80054.00±1.66**32.89±1.81**13.10±3.47**F 值259.56157.5817.59 P 值<0.01<0.01<0.01
2.1.3 细胞周期相关基因表达水平 与0 μmol·L-1组(1.00±0.00)相比,200、400、800 μmol·L-1MEHP染毒组P27 mRNA 表达水平[(3.14±0.09)、(3.46±0.05)、(8.94±0.15)]升高,CDK2 mRNA 表达水平[(0.65±0.10)、(0.49±0.03)、(0.42±0.06)]降低(P均<0.01),见图3。
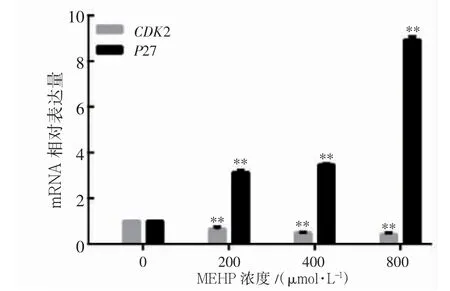
图3 不同浓度MEHP 对TM-3 细胞周期相关基因表达的影响(24 h)
2.2 5-Aza-Cdr 甲基化抑制剂干预效应
2.2.1 CCK-8 检测5-Aza-Cdr 对TM-3 细胞活性的影响 与0 μmol·L-1组相比,5-Aza-Cdr 染毒组细胞存活率呈下降趋势,其中10-4μmol·L-15-Aza-Cdr 染毒组的细胞存活率与对照组相比差异无统计学意义(P>0.05),故将10-4μmol·L-1确定为干预组染毒剂量,见表3。与对照组相比,400 μmol·L-1MEHP 染毒组和MEHP+5-Aza-Cdr干预组细胞存活率均下降(P 均<0.01),见表4。
表3 CCK-8 法检测不同浓度5-Aza-Cdr 染毒对TM-3 细胞存活率的影响(n=3,±s)
与0 μmol·L-1 组比较*P<0.05,**P<0.01。
浓度/(μmol·L-1)OD 值存活率/%0 1.35±0.03100.00±0.00 10-40.89±0.0299.38±6.95 10-30.91±0.02**102.69±2.87 10-20.80±0.01**85.26±2.63*10-10.78±0.05**82.90±4.85**100.69±0.06**68.22±6.24**F 值133.5525.63 P 值<0.01<0.01
表4 CCK-8 法检测5-Aza-Cdr 干预对TM-3 细胞存活率的影响(n=3,±s)

表4 CCK-8 法检测5-Aza-Cdr 干预对TM-3 细胞存活率的影响(n=3,±s)
与对照组比较**P<0.01。
组别OD 值存活率/%对照组0.78±0.01 100.00±0.00 400 μmol·L-1 MEHP 染毒组 0.42±0.00** 41.90±2.07**MEHP+5-Aza-Cdr 干预组0.40±0.01** 38.86±0.04**F 值1 066.941 919.94 P 值<0.01<0.01
2.2.2 抑制剂干预后相关蛋白表达水平 与400 μmol·L-1MEHP 染毒组[(0.79±0.06)、(1.27±0.01)、(1.25±0.05)]相比,MEHP+5-Aza-Cdr 干预组DNMT1 和DNMT3B 蛋白表达水平[(0.67±0.05)、(0.49±0.02)]降低,FOXO1 蛋白表达水平[(1.59±0.15)]升高(P 均<0.05),见图4。

图4 5-Aza-Cdr 干预24 h 后TM-3 细胞相关蛋白表达变化
2.2.3 抑制剂干预后细胞周期进程变化 与对照组相比,400 μmol·L-1MEHP 染毒组、MEHP+5-Aza-Cdr 干预组细胞分布均阻滞在G1 期;400 μmol·L-1MEHP 染毒组与MEHP+5-Aza-Cdr干预组相比,G1 期细胞分布差异无统计学意义(P>0.05),见图5、表5。

图5 5-Aza-Cdr 干预各组细胞周期时相分布图(24 h)

表5 5-Aza-Cdr 干预各组细胞周期时相分布情况(24 h)
2.2.4 5-Aza-Cdr 干预后周期相关基因表达水平 与400 μmol·L-1MEHP 染毒组[(0.62±0.06)]相比,MEHP+5-Aza-Cdr 干预组P27 mRNA 表达水平[(0.84±0.13)]升高(P<0.05),见图6。

图6 5-Aza-Cdr 干预细胞周期相关基因表达变化(24 h)
3 讨论
DNA 甲基化是指在DNA 甲基转移酶(DNMTs)的催化作用下,以S-腺苷甲硫氨酸(SAM)为甲基供体,形成5-甲基胞嘧啶(5-methylcytosine,5-mc)的化学修饰过程[6]。MEHP 是否通过诱导细胞DNA 甲基化水平的改变,促进转录因子FOXO1 表达水平升高,进一步抑制细胞周期相关基因的表达水平,导致细胞周期阻滞,影响TM-3 细胞的正常分裂和增殖,目前尚不清楚。
在不改变DNA 分子一级结构的情况下,DNA 甲基化通过化学修饰的方式来调节基因组的功能。已知哺乳动物体内共有5 种DNMTs 家族成员:DNMT1、DNMT2、DNMT3A、DNMT3B 和DNMT3L。其中DNMT1 是维持甲基化酶,DNMT3B是重新甲基化酶,两者共同调控基因组的甲基化水平。DNMT1、DNMT3B 除了能识别5-mc 的生物功能外,还参与了基因组中5-mc 的维持和产生机制[7]。本研究发现,MEHP 染毒能够诱导TM-3细胞DNMTs 表达的改变,导致异常的甲基化修饰。在MEHP 对人前列腺癌LNCaP 细胞的影响的研究[8]中发现,MEHP 可能会通过影响整体DNA甲基化水平而改变前列腺癌的进展情况;刘特等[9]用RT-qPCR 方法从体外分离的精子样本中检测到DNMT1、DNMT3B mRNA 的表达,推测在精子样本中可能存在基因甲基化修饰现象,这与本研究结果类似。
本研究还发现,与0 μmol·L-1组相比,400、800 μmol·L-1组DNMT1 蛋白表达水平降低,DNMT3B 蛋白表达水平升高,两种甲基化转移酶的表达水平并不一致。Li 等[10]研究发现,DBP 通过诱导PTEN/Akt 通路产生表观遗传学水平的改变,在其致小鼠精原细胞生殖损伤过程中发现,与对照组相比,DNMT1 蛋白的表达未发生明显改变,DNMT3B 蛋白表达水平下降;在对非甾体类雌激素——己烯雌酚致生殖损伤中DNA 甲基化作用的研究[11]表明,3 种DNMTs 蛋白和mRNA 表达水平并不相同;DNMTs 的异常表达说明MEHP可诱导TM-3 细胞发生异常的甲基化修饰现象,DNA 低甲基化会促进基因的高表达,DNA 高甲基化会抑制基因表达。
表观遗传学可以通过影响细胞周期关键性调控因素来调控细胞的周期进程,但有关DNA甲基化与许多细胞周期关键性调控因素之间的具体作用机制仍未被完全阐明[12]。DNMT1 作为唯一维持甲基化状态的关键酶,在G1/S 期主要通过DNA 复制位点来维护新合成链的DNA 甲基化状态,在G2、M 期则主要通过与染色质结合来维持已建立的甲基化模式[13]。DNMT1 在雄性配子形成过程中,DNA 甲基化模式起着重要作用,DNMT1 在粗线期精母细胞表达下调而在复制后细线期/偶线期精母细胞表达上调,说明DNMT1在雄性生殖细胞发育减数分裂期发挥着重要作用[14-15]。小鼠精原干细胞需要转录因子FOXO1维持和启动精子的发生[16]。马林等[17]的研究发现,FOXO 信号通路可能参与miR-203-3p 的调控,在双酚A 诱导TM-3 细胞生殖损伤过程中发挥作用。本研究发现,MEHP 能够诱导TM-3 细胞DNA 甲基化水平发生异常改变,影响转录因子FOXO1、G1/S 期负性调控因子P27 mRNA、正向调控因子CDK2 mRNA 的正常表达;加入甲基化抑制剂后,细胞总甲基化水平降低,促进了转录因子FOXO1 和P27 的表达,导致细胞未能进入DNA 合成期,影响细胞的正常分裂和增殖。张洪开等[18]研究表明,在对PI3K 和MAPK 信号通路的研究中发现,FOXO1 能促进A549 细胞周期阻滞、诱导细胞凋亡。Ward 等[19]研究发现,叉头转录因子FOXO 家族是PI3K/Akt 通路的下游靶点,参与细胞周期和细胞凋亡的调控;韩彦渊等[20]研究表明,高糖能够诱导β 细胞FOXO1 蛋白表达,促进细胞周期抑制因子P27 蛋白的表达,细胞G1/G0 期比率升高,导致细胞周期阻滞,增殖能力降低;这与本研究结果相互印证。针对DNA甲基化水平如何在FOXO1 调控细胞周期进程中发挥作用的问题,其具体的发生机制还需要进一步探究。
综上所述,MEHP 染毒能够诱导TM-3 细胞DNMTs 表达水平改变,引起DNA 甲基化异常修饰,影响转录调控因子的表达,进一步阻滞细胞周期相关基因的表达,影响细胞正常分裂与增殖。但在DNA 甲基化水平和细胞周期相关性探讨方面,未设置下调基因实验来反向验证甲基化水平和周期分布的关系。因此,在后续的实验中,会进一步完善相关设计,更深入地探讨DNA 甲基化在MEHP 诱导TM-3 细胞周期阻滞中的调控作用,为后续的靶向研究提供理论基础。
