加热预处理对罗非鱼肉冷冻干燥的影响
2023-10-17韦丽娜李来好郝淑贤杨贤庆赵永强岑剑伟
韦丽娜,李来好*,郝淑贤*,黄 卉,杨贤庆,相 欢,赵永强,岑剑伟,魏 涯
(1.中国水产科学研究院南海水产研究所,农业农村部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州 510300;2.广东海洋大学食品科技学院,广东 湛江 524088)
罗非鱼(Oreochromis mossambicus)是我国重要的淡水养殖品种,具有产量高、生长速度快的特点,因其肉质细嫩、骨刺少,深受消费者喜爱,成为我国重要的加工鱼种。罗非鱼虽富含蛋白质、多种不饱和脂肪酸及矿物质[1-2],但其水分含量高、易腐败,多以鲜食和冷冻加工为主。目前,适合常温贮藏、食用方便的水产加工产品多以罐头的形式体现,但其加工形式单一,干制可有效延长水产品的保存期限,实现常温贮藏的效果。
目前应用于水产品的干制方法很多,包括热风干燥、冷冻干燥、真空干燥等。不同的干燥方式对产品的干燥速率、品质和微观结构影响存在较大差异,热干燥方法具有干燥速率快,但对干制品收缩变形、营养成分、色泽、组织结构影响大[3]。非热干燥可有效保留产品固有色泽和热敏性成分,广泛受到人们的关注。真空冷冻干燥是利用真空条件使物料中的水分直接从固态升华为气态,其特点是能够赋予产品疏松多孔结构[4],形成良好的复水性[5-6];此外,低温、真空条件下可有效抑制微生物生长,降低水分活度、延长贮藏期,对蛋白质等热敏性成分保留效果好[7];但真空冷冻干燥存在的问题是时间长、成本高。虽然真空冷冻干燥产品复水性较其他热干燥方式好,但肉制品复水时间较长,干制品复水后硬度较大,食用口感不佳。如梁钻好等[8]研究不同干燥方式对鱿鱼干燥效果的影响,结果表明热风和热泵干燥分别需7、13 h,真空冷冻干燥耗时长达24 h,冷冻干燥的鱿鱼干表面肌纤维清晰明显,截面呈疏松多孔状。刘书成等[9]研究表明经真空冷冻干燥的干制罗非鱼片需复水60 min达到恒质量;吴满刚等[10]研究发现鸡肉丁经真空冷冻干燥复水后的硬度是未经干燥的10 倍。
为此,众多学者致力于通过预处理提高干燥速率和产品的复水性,但研究多集中在果蔬加工领域[11]。如王海鸥等[12]研究热烫、护色液、超声波预处理对苹果片冻干品质的影响,发现超声波和热烫预处理可缩短冻干时间,经热烫处理的苹果片细胞壁形态破坏明显,复水率最高,复水30 min硬度显著降低;姚娜娜等[13]发现热风干燥过程中前36 h时,经烫漂处理的大果沙棘除去的水分含量(18.03%)明显高于对照(去除掉8.73%的水分);王娟等[14]研究发现花椰菜经沸水烫漂和蒸汽烫漂处理后干燥时间较对照缩短18.18%,烫漂提高细胞膜的通透性从而提高干燥速率。Gamboa-Santos等[15]发现胡萝卜分别经热水烫漂1 min和蒸汽烫漂2 min处理后,VC保留率高,9 h完成干燥。关于加热预处理提升水产品干燥速率和复水性的研究报道较少,何学连[16]将白对虾烫漂1 min再真空干燥,明显缩短了干燥时间,复原率提高13.49%,且对虾的组织状态、色泽保持好。傅新鑫等[17]研究表明大菱鲆蒸制2 min时鱼块的亮度增加,剪切力变化不显著,蒸制时间延长至4~6 min,鱼肉硬度、剪切力和咀嚼性降低。本实验以罗非鱼肉为研究对象,分析加热预处理技术对鱼肉冷冻干燥速率和复水性能的影响,为开发适合复水即食的鱼肉加工产品提供技术支撑。
1 材料与方法
1.1 材料与试剂
新鲜罗非鱼(400~500 g/条),购买于广州当地超市。
蛋白定量测试盒、微量总巯基测试盒、羰基含量测定试剂盒 南京建成生物工程研究所;BeyoColorTM彩色预染蛋白、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液(5×)、考马斯亮蓝染色液 上海碧云天生物技术有限公司;NuPAGETMBis-Tris预制胶(12%)、NuPAGETMMOPS SDS电泳缓冲液(20×) 英潍捷基(上海)贸易有限公司;硫代巴比妥酸(thiobarbituric acid,TBA)、三氯乙酸(均为分析纯) 广州化学试剂厂。
1.2 仪器与设备
Alpha1-4冷冻干燥机 德国Christ 公司;电子天平上海精密科学仪器有限公司;TDZ5-WS低速离心机东莞布鲁斯仪器有限公司;T50型均质机 德国IKA公司;3K30型台式高速冷冻离心机 德国Sigma公司;CR-400型全自动色差计 日本柯尼卡美能达控股公司;CT3质构仪 美国Brookfield公司;Sunrise-basic酶标仪 瑞士TECAN公司;Mini Gel Tank电泳系统、飞纳台式场发射电子显微镜 美国赛默飞世尔科技有限公司;NMI20-040H-I核磁共振成像分析仪 上海纽迈电子科技有限公司。
1.3 方法
1.3.1 原料预处理
取罗非鱼背部肌肉,切成3 cm×3 cm×1 cm的小块,质量约为12.0 g。真空冷冻干燥:不同处理组样品放入-40 ℃冰箱预冻12 h,真空冷冻干燥冷阱温度为-40 ℃,真空度为20 Pa。其中对照组不做处理直接冻干;烫漂组鱼块经100 ℃沸水烫漂1 min后冻干;汽蒸组鱼块放入蒸屉沸水蒸煮2 min后冻干。
1.3.2 干燥曲线绘制
参考崔清亮等[18]的方法,略作修改。定期测定干燥过程罗非鱼块的质量,至含水率约5%时停止干燥,分别按式(1)、(2)计算含水率和样品干燥速率。
式中:ω表示含水率/%;mt、mt+4分别表示t、t+4时刻样品质量/g;Δt表示4 h;m0表示最终干燥后质量/g。
1.3.3 复水率测定
参考周明珠等[19]的方法,略做修改。将干制鱼块称质量后,分别在50、60、70、80、90 ℃水浴锅复水60 min,每10 min取出一次,用滤纸吸干鱼块表面水分,称量复水后的质量。观察在80 ℃水浴锅复水不同时间(10、20、30、40、50、60 min)的鱼块复水率。按式(3)计算复水率。
式中:m0、m1分别表示复水前、后鱼肉的质量/g。
1.3.4 干制罗非鱼肉品质分析
1.3.4.1 质构特性的测定
参考吴燕燕等[20]的方法,略做修改。利用质构仪测熟鱼块(100 ℃蒸5 min)及复水后鱼块(80 ℃水浴锅复水40 min)的硬度、弹性、咀嚼性和内聚性。将样品置于质构仪测定台上,测试模式为质地多面剖析(TPA)模式,采用P/44平底圆柱形探头,测试速率为1.0 mm/s,循环次数为2 次,触发点负载为5.0 g,下压距离10.0 mm。每组实验重复6 次,去除最大值和最小值后取平均值。
1.3.4.2 色泽的测定
参考吴强等[21]的方法,室温下采用全自动色差计测定罗非鱼肉L*、a*、b*值。
1.3.4.3 pH值测定
参考Fan Hongbing等[22]的方法,称取鱼肉2.0 g于离心管中,加入18 mL蒸馏水,均质,10 000 r/min离心10 min,过滤,pH计测定pH值。
1.3.4.4 TBA值测定
参考Faustman[23]和黄海源[24]等的方法,称取鱼肉1.0 g,分别加入4 mL蒸馏水和5 mL预冷的三氯乙酸溶液(20%,质量分数),均质,冰浴静置1 h,8 000 r/min、4 ℃离心10 min,过滤,上清液移至10 mL容量瓶,定容。取5 mL定容液加5 mL TBA溶液(0.02 mol/L),振荡,置于沸水中加热20 min,流水冷却至室温。空白样为蒸馏水。用紫外分光光度计在532 nm波长处测定吸光度。
1.3.5 肌原纤维蛋白分析
1.3.5.1 肌原纤维蛋白的提取和相关性质测定
参考杨肖杰等[25]的方法,利用Bradford法测定肌原纤维蛋白含量。
表面疏水性参考Chenh等[26]的方法,20 mmol/L pH 6.0的磷酸缓冲液将肌原纤维蛋白稀释至2 mg/mL,取1 mL稀释液加100 µL(1 mg/mL)溴酚蓝混合均匀,并做空白对照,涡旋振荡10 min,冷冻离心(3 000 r/min、15 min),上清液稀释50 倍,酶标仪测定595 nm波长处的光密度值(OD值),按式(5)计算肌原纤维蛋白的溴酚蓝结合量。
总巯基、羰基含量按照总巯基含量测定试剂盒、羰基含量测定试剂盒说明书进行测定。
1.3.5.2 蛋白质二级结构
参考刘芳芳等[27]的方法,稍作修改。将制备的肌原纤维蛋白溶液冷冻干燥,取少量蛋白冻干样品,与100~200 倍质量比的溴化钾充分混合研磨,压力器(1 400 Pa)加压制片2 min,用红外光谱仪进行全波段扫描(4 000~400 cm-1),分辨率为 4 cm-1,扫描次数为32 次,使用Peakfit软件拟合计算蛋白质的二级结构。
1.3.5.3 SDS-PAGE分析蛋白组成
将提取的肌原纤维蛋白以体积比3∶1与SDS-PAGE上样缓冲液(5×)混合,混合液沸水浴煮5 min,取10 μg混合体系进行上样分析,SDS-PAGE分离胶质量分数为12%,浓缩胶质量分数为5%,电泳电压120 V,电泳时间约1 h。
1.3.6 水分状态分布
参考卞瑞姣等[28]的方法,略作修改。将干制不同时间的鱼块切成2 cm×2 cm×1 cm,采用NMI20-040H-I核磁共振成像分析仪测定,共振频率20 MHz,磁体强度0.54 T,线圈直径为40 mm,磁体温度为32 ℃。T2测定参数:P1=10 μs、P2=20.48 μs、TW=3 000 ms、TE=0.2 ms、NECH=7 000、NS=32、SW=200 kHz,使用核磁共振分析测量软件及CPMG序列采集样品信号,采用SIRT1000000进行反演。
1.3.7 微观结构观察
鱼肉样品用体积分数2%戊二醛溶液于4 ℃固定24 h,用0.1 mol/L磷酸盐缓冲液冲洗10 min,30%、50%、70%、90%乙醇溶液梯度分别浸泡15 min,真空冷冻干燥72 h,喷金后于电子显微镜下观察拍照。
1.4 数据统计与分析
每组实验均取3 次平行进行测定,采用SPSS 19.0软件对实验数据进行处理和统计分析、差异显著性分析,利用Duncan’s 法进行组间多重比较,显著性水平为P<0.05,使用Origin 8.5软件作图。
2 结果与分析
2.1 热处理对罗非鱼肉冻干过程的影响
真空冷冻干燥过程有快速、恒速和降速阶段。由图1A可知,冻干过程中鱼块的含水率一直处于下降趋势,20 h后含水率变化趋于平缓,在整个干燥过程中热处理组样品的含水率明显低于对照组。由图1B可明显观察到鱼块含水率变化的3 个阶段,前10 h干燥速率快速增加,10~16 h逐渐趋于平缓,而后进入降速阶段,对照组进入降速阶段时间有所延长;且快速、恒速干燥阶段热处理组样品的干燥速率明显高于对照组,烫漂处理干燥速率最高。干燥前期鱼块的含水率高,自由水蒸发速度快,水分下降速率快;随着干制时间延长,罗非鱼干燥层厚度增加,冻干层厚度减少,水分子从食物内部迁移到表面的速率减缓,含水率的下降引起表面收缩,导致干燥速率下降;干制后期,在氢键作用下,结合水难以从细胞中释放出来,含水率下降缓慢。3 组样品均在10~12 h干燥速度达到较高的水平,烫漂和汽蒸组干燥速率最高分别为4.72%/h和4.41%/h,对照组最高为2.62%/h,烫漂组最先进入明显降速阶段(16 h),汽蒸和对照组分别为20 h和24 h。烫漂处理鱼肉干燥速率加快,可能是鱼肉直接与热源接触,表面肌肉组织细胞受到破坏程度高,细胞膜通透性增加,持水力下降,干制过程水分散失快,干燥效率提高,干燥时间缩短。由表1可知,热处理组干燥耗时27 h,对照组需要36 h,时间缩短9 h,能耗大大降低。

表1 热处理对罗非鱼肉冻干时间和最终含水率的影响Table 1 Effect of heat treatment on freeze-drying time and moisture content of tilapia meat
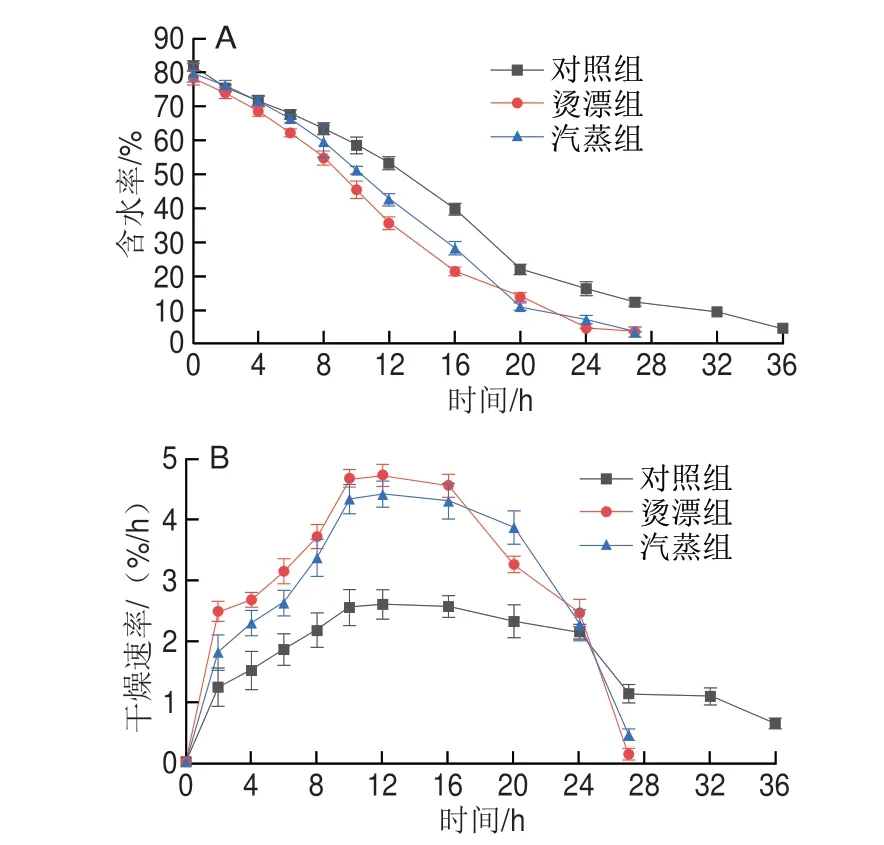
图1 热处理对冻干罗非鱼肉含水率(A)、干燥速率(B)的影响Fig.1 Effect of heat treatment on moisture content (A) and drying rate (B)of freeze-dried tilapia meat
2.2 热处理对冻干罗非鱼肉复水性的影响
复水率是评价干制品品质的一个重要指标,复水率越高干制品品质越好。由图2A可知,对照组随温度升高复水率增加,80 ℃时复水率最高,与对照组相比,热处理组样品的复水性具有明显优势,热处理样品50 ℃时即可拥有较高的复水性,50 ℃时复水率明显高于对照组80 ℃时复水率,80 ℃时烫漂组复水率最高。热处理改变了鱼肉的组织结构,使细胞间间隙增大,复水时利于水分进入,提高了复水能力。由图2B可知,在80 ℃条件下,随复水时间延长,3 组样品的复水率均呈上升趋势,但热处理组样品的复水效果显著优于对照组(P<0.05),热处理组10 min复水率在60%左右,40 min复水率达到最大值,烫漂组和汽蒸组最大复水率分别为69.22%和70.13%,二者差异不显著(P>0.05);烫漂组在30 min以内的复水效果略显优势。对照组60 min达到的复水率热处理组只需10 min即可达到。汽蒸组高复水率是因为短时热处理造成鱼肉凝胶结构固化,冷冻过程冰晶对肌纤维细胞结构造成破坏,干燥时水分快速升华形成疏松多孔结构,复水时水分进入细胞的阻力降低[29]。烫漂处理鱼肉表面直接与热源接触,表面蛋白质迅速变性,细胞收缩汁液流失增加,纤维束间空隙增大,冷冻时冰晶形成对肌纤维细胞的完整性破坏更严重,干制水分快速蒸发,有利于提升复水速率。
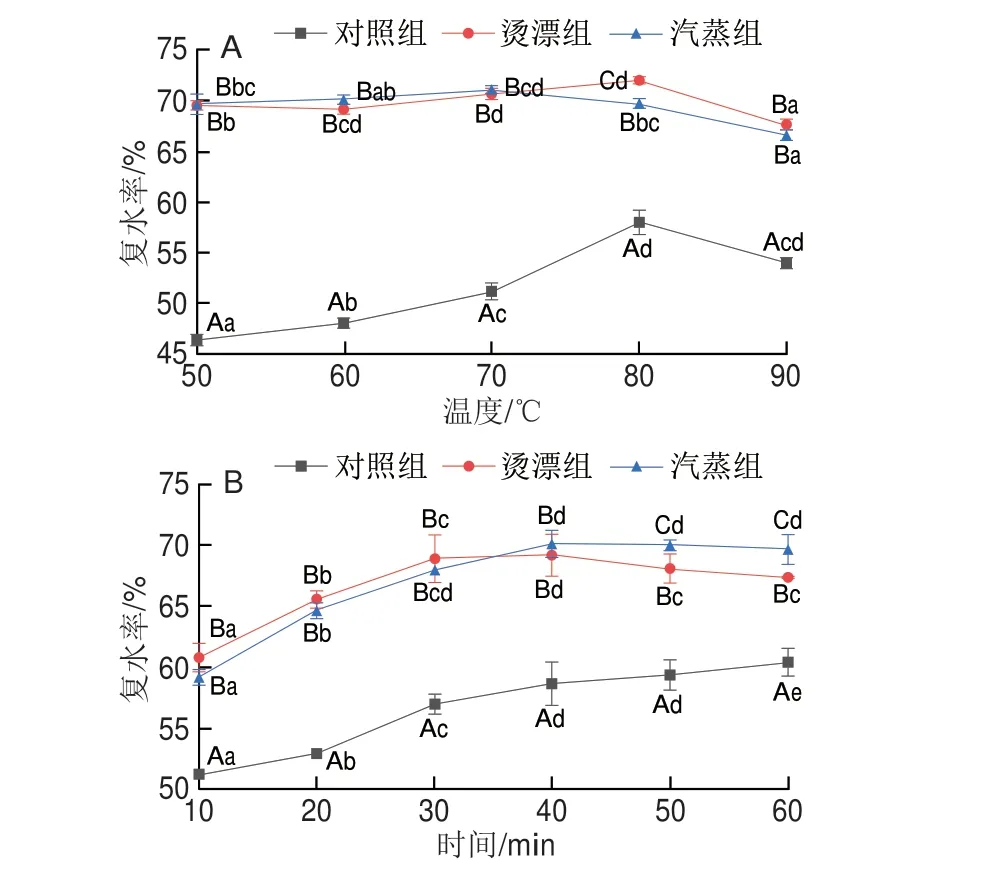
图2 热处理对冻干罗非鱼肉复水效果的影响Fig.2 Effect of heat treatment on rehydration of freeze-dried tilapia meat
2.3 热处理对冻干罗非鱼肉品质的影响
2.3.1 热处理对罗非鱼肉质构特性的影响
硬度、弹性、咀嚼性和内聚性评价产品品质的重要指标[30]。冻干产品多数是复热后再食用,因此, 本实验将经热处理冻干的鱼块进行复水,与熟制后的鱼块质构进行比较,分析预热处理对干制鱼块复水后食用口感的影响,结果如表2所示。

表2 热处理对冻干罗非鱼肉复水后质构特性的影响Table 2 Effect of heat treatment on texture of freeze-dried tilapia after rehydration
由表2可知,烫漂和汽蒸组各质构指标差异不显著(P>0.05),且在硬度、弹性及咀嚼性指标方面与熟制鱼块基本相当,说明热处理后进行冷冻干燥可有效保持干制鱼肉复水后的食用口感,虽然热处理组鱼肉内聚性略低于熟制鱼块,但不影响产品复水后的完整性。鱼肉直接冷冻干燥(对照)复水后的硬度、弹性和咀嚼性均显著热处理组及熟制鱼块,水分含量是直接影响上述指标的重要因素。对照组未经热处理,干燥过程肌肉失水,物料紧缩,导致物料结构紧密,复水时不易吸收水分,鱼肉内部无法完全复水,硬度高达(767.8±25.1)g,食用口感偏硬,丧失鱼肉的鲜嫩特点。内聚性指内部收缩力,鱼肉经干燥复水,肌肉纤维间的连接减弱,内聚性较熟制鱼块略有下降,但完整性尚在可接受范围。热处理导致鱼肉蛋白质结构的二级结构和三级结构的化学键受到破坏,组织脆弱化,细胞间的结合力降低[31];同时干燥过程物料收缩能力减弱,肌肉间隙变大,复水时水分易于进入细胞,使物料复水更完全,因此其质构特性与熟制鱼块接近。
2.3.2 热处理对冻干罗非鱼肉色泽的影响
色泽是肉类感官评价中重要指标之一,良好的色泽增加消费者的购买欲,对提高产品经济效益具有一定影响。由表3可知,对照组的L*值显著高于热处理组,鱼块颜色呈白色,视觉亮度高;热处理对a*、b*值的影响则与L*值相反。这一现象可能与肌肉中肌红蛋白或残存的少量血红蛋白的变化有关,美拉德反应和脂质氧化也是肉类色泽变化的重要因素;对照组未经热处理,真空冷冻干燥前后肌肉中肌红蛋白/血红蛋白结构变化不明显[32-33],但热处理后肌红蛋白/血红蛋白氧化变性[34],高铁肌红蛋白氧化导致a*值增加;加热预处理会加速脂质氧化,脂肪酸氧化产生的自由基对肌红蛋白的氧化起促进和加速的作用,肌红蛋白氧化后形成高铁肌红蛋白,造成肉制品褐变,b*值升高[35]。

表3 热处理对冻干罗非鱼肉色泽的影响Table 3 Effect of heat treatment on color parameters of freeze-dried tilapia meat
2.3.3 热处理对冻干罗非鱼肉pH值和TBA值的影响
pH值在一定程度上能反映水产品肌肉品质变化情况,通常作为评价水产品肌肉品质的重要指标之一[36]。热处理不但造成鱼肉汁液损失,影响蛋白质及脂质氧化水解,还可能影响鱼肉蛋白质组成从而影响鱼肉pH值。由图3A可知,与对照组相比,烫漂和汽蒸组pH值显著升高(P<0.05)。熊添等[37]研究发现鱼肉受热后水溶性蛋白和盐溶性蛋白含量有所下降,而碱溶性蛋白和碱不溶性蛋白含量则呈上升趋势;这是因为加热破坏稳定蛋白质结构的化学键(如氢键、疏水作用等),使肌肉蛋白质中酸性基团减少[38],pH值上升。
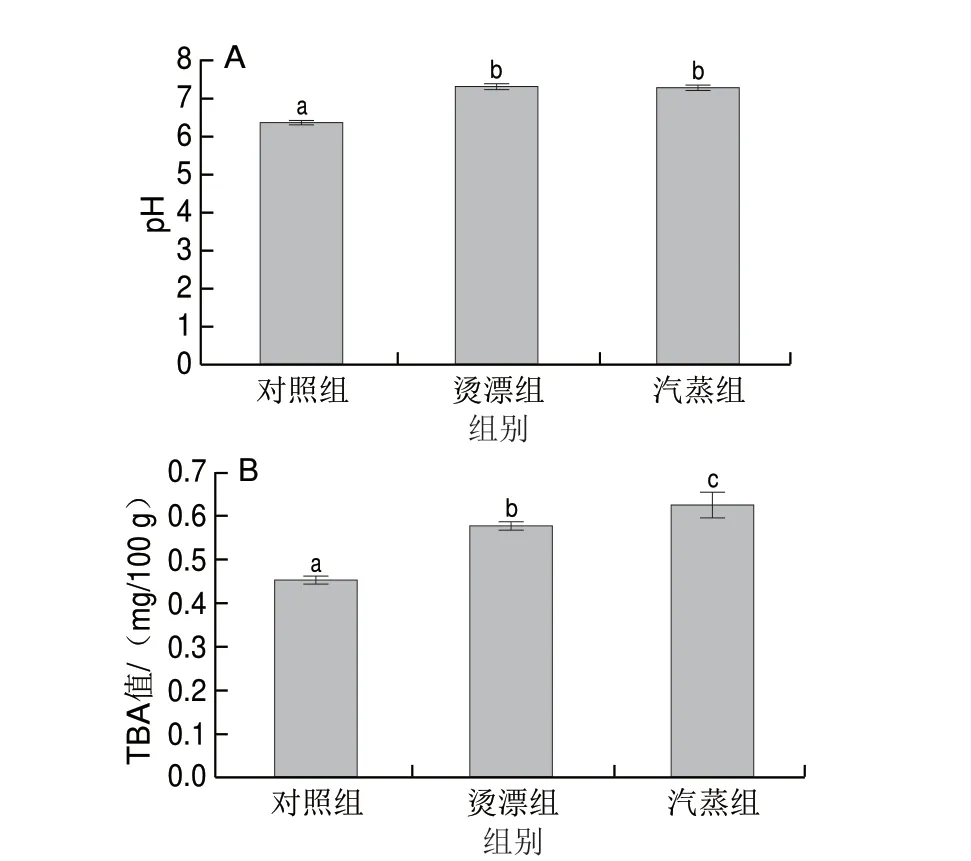
图3 热处理对冻干罗非鱼肉pH值(A)和TBA值(B)的影响Fig.3 Effect of heat treatment on the pH (A) and thiobarbituric acid value (B) of freeze-dried tilapia meat
脂肪在热和O2的条件下发生水解和氧化反应产生丙二醛,丙二醛可以与TBA生成稳定的复合物,因此TBA值与水产品脂肪氧化程度密切相关[39]。由图3B可知,对照组TBA值最低,热处理后TBA值显著增大(P<0.05)。烫漂、汽蒸加快罗非鱼肉的多不饱和脂肪酸氧化,导致TBA值增大;李锐等[40]研究也发现热处理导致罗非鱼片脂肪氧化值上升的现象。
2.4 热处理对冻干罗非鱼肉肌原纤维蛋白的影响
2.4.1 肌原纤维蛋白特性
肌原纤维蛋白含量约占鱼肉蛋白总含量的65%~75%,是鱼肉肌肉中最具代表性的蛋白质,肌原纤维蛋白结构及功能特性的改变会影响肉品的食用品质[41]。
由表4可知,罗非鱼肉经热处理及冻干后肌原纤维蛋白和总巯基含量均下降,表面疏水性和羰基含量则升高,说明热处理影响肌原纤维蛋白的变性程度。傅新鑫等[17]研究表明热处理过程蛋白质变性,鱼块肌肉组织发生变形,肌束膜受热破坏,导致肌原纤维蛋白流失;两种加热处理方式对肌原纤维蛋白变性程度影响差异可能与样品受热程度有关,烫漂处理热源温度高,因此羰基含量也高,说明鱼肉蛋白变性更为明显。蛋白发生热变性使内部的疏水性氨基酸残基暴露在蛋白质与水相接触面,导致蛋白质的表面疏水性增加[42],其表面疏水性反映蛋白表面负电荷的分布情况,热处理可影响负电荷的分布,但其改变程度并非与蛋白的变性程度呈正相关,Reed等[43]研究发现鲑鱼肌原纤维蛋白表面疏水性在一定温度范围内随温度升高而增加,达到一定温度保持相对稳定。热变性使蛋白质分子逐渐展开,内部巯基暴露氧化生成二硫键,造成总巯基含量下降,而蛋白肽链断裂造成羰基累积。胡逸茗[44]研究表明丁香鱼蒸煮干燥后肌原纤维蛋白空间结构发生改变,进而影响活性疏基含量等肌原纤维蛋白指标的变化。

表4 热处理对冻干罗非鱼肉肌原纤维蛋白特性的影响Table 4 Effect of heat treatment on myofibrillar protein characteristics of freeze-dried tilapia meat
2.4.2 肌原纤维蛋白二级结构
蛋白质的二级结构特性决定了功能特性。由图4 可知,热处理对蛋白质分子二级结构影响显著(P<0.05),与对照组相比,经过热处理的样品α-螺旋结构相对含量下降显著(P<0.05),β-折叠和无规卷曲结构的相对含量显著增多,其中烫漂组α-螺旋结构相对含量最低,与对照组比,烫漂组、汽蒸组肌原纤维蛋白α-螺旋相对含量分别下降9.97%、4.58%。热处理加剧分子间相互运动,蛋白分子发生碰撞,蛋白结构发生改变,使有序结构向不稳定的无序结构转变;这与张洪超等[45]发现乌贼肌原纤维蛋白中α-螺旋含量随着氧化程度增加而减少的结果相一致。热处理导致蛋白质变性,破坏羰基和氨基间的氢键,肌原纤维蛋白中有序的α-螺旋结构向β-折叠、β-转角和无规卷曲转变,蛋白的结构紧密程度和构象稳定性降低。
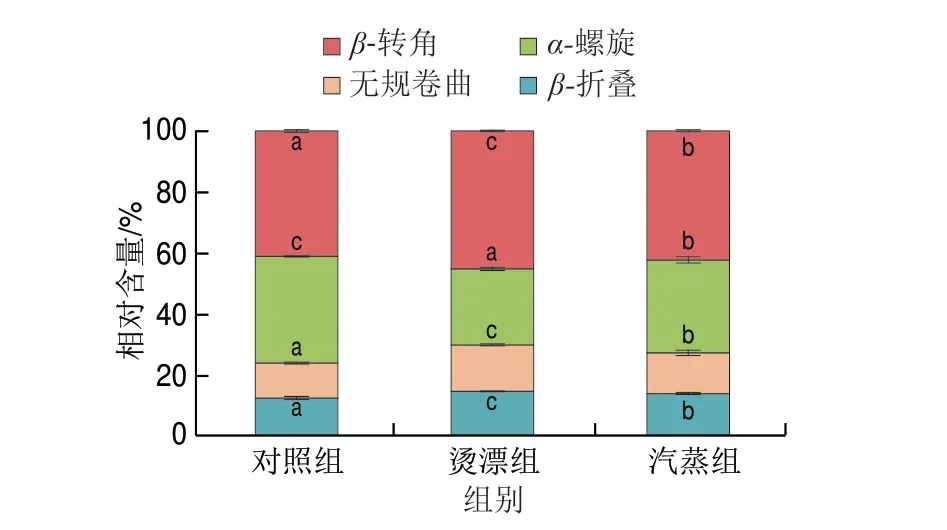
图4 热处理对冻干罗非鱼肉肌原纤维蛋白二级结构的影响Fig.4 Effect of heat treatment on secondary structure of myofibrillar protein in freeze-dried tilapia meat
2.4.3 SDS-PAGE结果
对照及热处理冻干鱼肉肌原纤维蛋白分子质量范围为16~270 kDa(图5),肌球蛋白重链、肌动蛋白、原肌球蛋白和肌球蛋白轻链条带相对清晰。与对照组相比,热处理鱼肉的肌球蛋白重链、肌动蛋白和原肌球蛋白条带变浅,16~37 kDa之间的肌球蛋白轻链和其他部分小分子蛋白条带基本消失,烫漂组鱼肉蛋白条带与对照组蛋白条带差异最明显。烫漂组鱼肉直接受热,变性程度更大,造成部分小分子蛋白分解,肌球蛋白热稳定性低[46],蛋白条带变化最明显,Lee等[47]研究发现牛肉肌原纤维蛋白在45 ℃以上时肌球蛋白变性;也有研究表明随加热温度的升高,肌球蛋白逐渐变性降解[48]。热处理对蛋白质二级结构产生影响,导致肌肉中的稳定有序结构发生不同程度的降解。
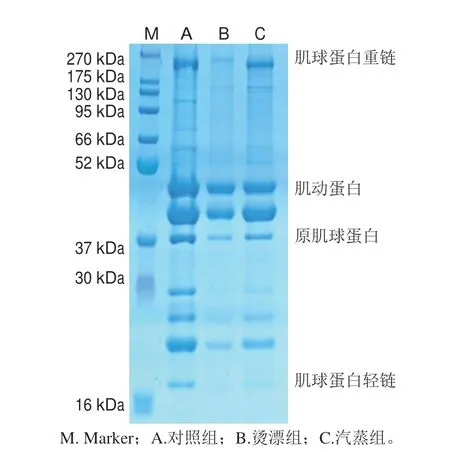
图5 热处理对冻干罗非鱼肉肌原纤维蛋白的 SDS-PAGE 图谱Fig.5 Effect of heat treatment on sodium dodecyl sulphatepolyacrylamide gel electrophoresis (SDS-PAGE) pattern of myofibrillar proteins in freeze-dried tilapia meat
2.5 热处理对罗非鱼冻干过程中水分状态分布的影响
LF-NMR是一种无损分析技术,LF-NMRT2弛豫时间可有效表征干燥过程中样品的水分分布和迁移行为[49],食品中的水分呈现3 种状态,T21(1~10 ms)表征为结合水,与肌肉蛋白质紧密结合不易流失;T22(10~100 ms)为弛豫峰的主峰,约占总信号强度的90%以上,该峰表征的是肌原纤维内截留的不易流动水,是肌肉中水分的主要存在形式;T23(100~1 000 ms)代表肌细胞间或肌原纤纤晶格间的自由水,最易流失。横向弛豫时间T2比纵向弛豫时间T1对不同状态水的区分更加敏感,因此通常选择T2弛豫时间作为评估样品水分含量、分布情况以及水与大分子之间相互作用的重要手段[50]。
由图6可知,罗非鱼肉经热处理后,T23峰面积明显升高,说明热处理使鱼肉的水分分布状态发生改变。3 组各峰面积变化趋势相似,随着干燥时间的延长,峰面积均呈下降趋势,冻干4~8 h期间峰面积下降最明显,此时物料处于快速干燥阶段,自由水流动性强,干燥过程中易于流失,这与干燥速率曲线结果相一致。热处理组峰面积下降幅度明显高于对照组,说明热处理使原料水分含量下降趋势明显加快。随干燥时间的延长,T22的信号峰向左偏移,其中对照组在12 h即观察到信号峰的偏移,而热处理组信号峰偏移时间要明显迟于对照组,说明热处理在一定程度上延缓了干燥期间水分向低自由度方向的迁移,从而加速干燥过程[51]。
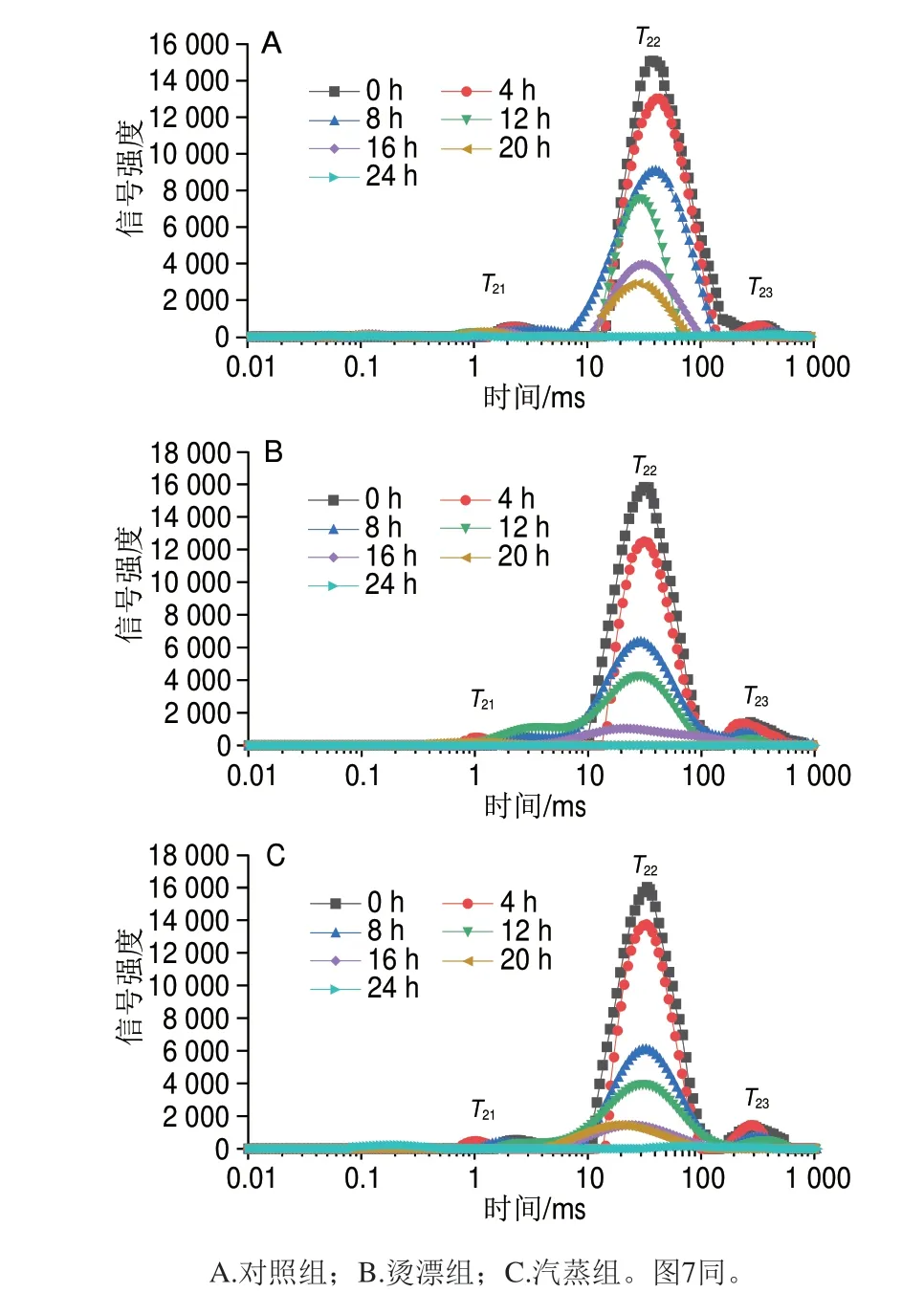
图6 罗非鱼肉冻干过程中横向弛豫时间T2波谱图Fig.6 Transverse relaxation time spectra of tilapia meat during freeze drying
2.6 热处理对冻干罗非鱼微观结构的影响
干制品的微观结构与复水能力密切相关。由图7可知,热处理组与对照组鱼块肌肉微观结构具有明显的差异。对照组鱼块肌肉组织排列规整、纤维束光滑,肌肉纤维结构保持比较完整;热处理组肌肉组织收缩、纤维束表面出现局部破损、粗糙程度大,纤维束间空隙明显增大。可能是因为热处理组蛋白质热变性,肌原纤维蛋白聚集和汁液流失造成肌肉收缩,细胞外空间显著增加[52]。其中汽蒸组鱼块的肌纤维孔隙最为明显。相比汽蒸处理,烫漂样品受热更直接,受热程度更高,肌肉蛋白变性快。冷冻过程水分形成冰晶对肌纤维细胞的完整性破坏更严重,干制水分快速蒸发,内部水分由内向外迅速扩散,形成疏松多孔的结构[53]。
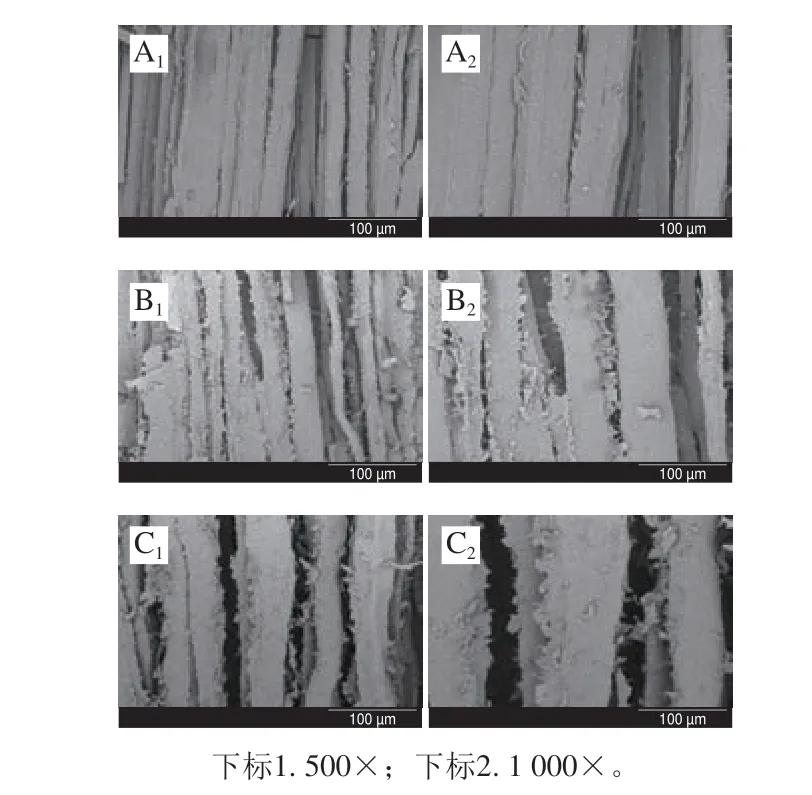
图7 热处理对冻干罗非鱼肉微观结构的影响Fig.7 Effect of heat treatment on the microstructure of freeze-dried tilapia meat
3 结 论
热处理有助于提升鱼肉的冻干速率,缩短干燥所需时间,增强干制鱼肉的复水性能和复水鱼肉可食性。热处理导致冻干鱼肉肌原纤维蛋白变性较为明显,表面疏水性和羰基含量均上升,肌球蛋白重链、肌动蛋白和原肌球蛋白条带变浅,16~37 kDa之间的肌球蛋白轻链和其他部分小分子蛋白条带基本消失。肌肉蛋白变性改变了鱼肉水分状态分布和肌肉组织结构的伸缩性能,致使表征自由水分布的T23峰面积升高,促进了真空冷冻干燥过程中的水分流失。
