金属抗菌肽SIF4对大肠杆菌呼吸代谢与能量代谢的抑制机理
2023-10-17李玉珍肖怀秋曾梦琪赵谋明
李玉珍,肖怀秋,,*,刘 淼,王 琳,曾梦琪,赵谋明
(1.湖南化工职业技术学院制药与生物工程学院,湖南 株洲 412000;2.华南理工大学食品科学与工程学院,广东 广州 510000)
肉制品和乳制品等食品因富含蛋白质、多糖和脂质等营养物质而易受到食源性致病菌与腐败菌的生物污染,特别是大肠杆菌,其引发的食源性疾病已成为当前食品公共卫生主要威胁之一,食源性大肠杆菌的生物防控是现代食品安全领域的研究热点[1-2]。糖酵解途径(Embden-Meyerhof pathway,EMP)和三羧酸循环(tricarboxylic acid cycle,TCA)是大多数生物共有的基本代谢途径,不仅是物质代谢中枢途径,也是能量代谢关键途径[3]。葡萄糖可经EMP和TCA氧化并产生大量能量,或经磷酸戊糖途径(hexose monophosphate pathway,HMP)降解生成6-磷酸葡萄糖并产生还原型辅酶(coenzyme,Co)I和CoII[4-5]。EMP、TCA和HMP是大肠杆菌最重要的3 条呼吸代谢产能途径,菌体呼吸代谢水平是菌体代谢活力的重要体现,呼吸代谢受到抑制可影响菌体能量与物质代谢生物进程[6-7]。戴锦铭[8]研究发现,山苍子精油可通过抑制TCA途径实现对大肠杆菌O157:H7的呼吸抑制。大肠杆菌能量代谢关键酶主要锚定在细胞质膜上或分布在细胞质中,细胞质膜参与呼吸氧化产能等关键代谢过程,是维持细胞生理机能的重要膜基质载体[9],离子跨膜转运也是细胞信号转导和物质转运的生化基础,胞内离子保持稳态对菌体能量与物质代谢极为重要[10],如细胞质膜离子通道Na+K+-ATP酶和Ca2+Mg2+-ATP酶对维持细胞质膜通透性、低钠高钾环境、细胞静息电位及信号转导有重要意义[11-12]。李婷等[13]研究了姜厚朴水提物对大肠杆菌细胞质膜离子通道ATP酶的影响,发现姜厚朴水提物作用4 h后Na+K+-ATP酶活性显著上升,可能与应激适应有关。胞内ATP含量变化能直接反映菌体存活状态[14]。戴锦铭[8]研究发现,山苍子精油可导致大肠杆菌O157:H7胞内ATP合成速度降低或水解程度增强。本课题组前期研究发现,金属抗菌肽SIF4为金属阳离子抗菌肽,具有较好的胃肠耐受性和热稳定性,对大肠杆菌具有较好抑菌活性,对大肠杆菌最小抑菌浓度(minimal inhibitory concentration,MIC)为0.4 mg/L[15],对EMP和TCA关键酶有不同程度的抑制作用,可造成细胞质膜氧化损伤和诱导氧化应激产生过量活性氧自由基,破坏细胞质膜结构与功能[16],但SIF4对大肠杆菌菌体呼吸代谢及能量代谢抑制机理尚未可知。鉴于EMP和TCA代谢的普遍性及其对大肠杆菌能量生成的重要性,本实验着重从EMP和TCA视角分析金属抗菌肽SIF4对大肠杆菌呼吸代谢和能量代谢的影响,以期为SIF4在食源性大肠杆菌的生物防控提供理论支持。
1 材料与方法
1.1 材料与试剂
金属抗菌肽SIF4由本课题组自制[15];大肠杆菌ATCC25922购自菌种保藏中心;刃天青 上海源叶生物科技有限公司;碘乙酸、丙二酸、磷酸钠、TritionX-100国药集团化学试剂有限公司;ATP含量测定试剂盒 南京建成生物工程研究所;Na+K+-ATP酶和Ca2+Mg2+-ATP酶试剂盒 北京索莱宝科技有限公司;溶菌酶 南宁东恒华道生物科技有限责任公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UV-2600紫外-可见分光光度计 日本岛津公司;多功能酶标仪 瑞士Tecan公司;超声细胞破碎仪 宁波新芝生物有限公司;高速冷冻离心机 湘仪实验室仪器开发有限公司;便携式微量溶氧仪 北京恒奥德仪器仪表有限公司。
1.3 方法
1.3.1 菌体新陈代谢活力分析
参考Magnani等[17]方法并修改。将活化菌种接种至牛肉膏蛋白胨液体培养基中,37 ℃、120 r/min培养12 h,8 000 r/min离心10 min,无菌磷酸盐缓冲液(phosphate buffered saline,PBS)(0.03 mol/L、pH 7.2,下同)洗涤并重悬。取4 份菌悬液,分别加入SIF4使其终质量浓度为1/2 MIC、MIC和2 MIC(MIC为0.4 mg/L,通过前期研究[15]确定),以不添加SIF4组为阴性对照。将刃天青溶液加入各菌悬液中(终质量分数为10%),37 ℃避光振荡培养2 h,使其充分扩散至胞内。取等量样品离心(10 000 r/min、4 min)后取上清液,用多功能酶标仪测定荧光强度,激发和发射波长分别设置为560 nm和590 nm。通过测定对照孔与刃天青无菌去离子水溶液荧光强度进行背景修正。
1.3.2 菌体呼吸代谢途径分析
当抗菌肽与典型呼吸抑制剂所抑制的主要呼吸代谢途径差异越大时,由于增效作用,叠加率会越高,反之亦然[18],因此,当金属抗菌肽SIF4与典型抑制剂作用于不同代谢途径时,存在协同增效作用,叠加率会增大,而若金属抗菌肽SIF4与典型抑制剂作用于同一呼吸代谢途径时,无协同增效作用,叠加率较小,可通过叠加率判断SIF4作用的呼吸代谢途径。测定对照组初始呼吸速率(R0)和SIF4+碘乙酸、SIF4+丙二酸和SIF4+磷酸钠等组别呼吸速率(R1),计算呼吸抑制率(inhibition rate,IR)以评价对菌体的呼吸抑制率,计算各组别呼吸叠加率(superposing rate,SR)以判定菌体的呼吸代谢抑制途径[8]。
1.3.2.1 初始呼吸速率测定
在离心管中加入3.6 mL无菌PBS、0.4 mL 1%葡萄糖溶液和1 mL大肠杆菌菌液(106CFU/mL),充分搅拌5 min;将离心管用封口膜包裹形成封闭系统并静置1 min以制备初始反应体系,体系稳定后利用便携式微量溶氧仪测定菌悬液溶氧量/(μmol O2/g),计算呼吸速率R0/(μmol O2/(g·min))。
1.3.2.2 呼吸抑制率测定
在离心管中分别加入3.6 mL PBS、0.4 mL 1%葡萄糖溶液和1 mL大肠杆菌菌液,再分别加入3 种典型呼吸抑制剂(碘乙酸、丙二酸、磷酸钠,终质量浓度为500 mg/L)、SIF4(终质量浓度分别为1/2 MIC、MIC和2 MIC),搅拌5 min后,将离心管用封口膜包裹形成一个封闭系统并静置1 min,待体系稳定后利用便携式微量溶氧仪测定菌悬液溶氧量/(μmol O2/g),计算呼吸速率R1/(μmol O2/(g·min)),并按式(1)计算IR[8]。
1.3.2.3 呼吸叠加率测定
在离心管中分别加入3.6 mL PBS溶液、0.4 mL 1%葡萄糖溶液、1 mL大肠杆菌菌液和SIF4(终质量浓度分别为1/2 MIC、MIC和2 MIC),充分搅拌5 min后将离心管用封口膜包裹形成一个封闭系统并静置1 min,待体系稳定后利用便携式微量溶氧仪测定菌悬液溶氧量/(μmol O2/g),计算呼吸速率R1。随后分别加入碘乙酸、丙二酸、磷酸钠(终质量浓度为500 mg/L),在密闭系统中利用便携式微量溶氧仪测定菌悬液溶氧量/(μmol O2/g),计算呼吸速率R2,并按式(2)计算SR[8]。
式 中:R1为S I F4处 理 后 菌 体 呼 吸 速率/(μmol O2/(g·min));R2为添加典型抑制剂后菌体呼吸速率/(μmol O2/(g·min))。
1.3.3 细胞质膜离子通道ATP酶活力的测定
参考李婷等[13]的方法并修改。将对数生长期菌体以2%接种量接种至含SIF4(终质量浓度分别为0 MIC、1/2 MIC、MIC和2 MIC)的牛肉膏蛋白胨液体培养基中,以TritionX-100处理组(终质量浓度为100 mg/L,下同)为阳性对照,37 ℃、120 r/min培养12 h,每4 h取10 mL培养液,于4 000 r/min离心10 min,收集菌体沉淀,PBS洗涤3 次并重悬,超声细胞破碎仪破碎(超声功率200 W,超声3 s,间隔10 s,重复30 次,下同),8 000 r/min,4 ℃离心10 min,取上清液置冰浴中待测。按试剂盒说明测定Na+K+-ATP和Ca2+Mg2+-ATP酶活力。
1.3.4 胞内ATP生物合成分析
参考毛雪芳[19]的方法并修改。按2%接种量接种对数生长期菌体到牛肉膏蛋白胨液体培养中,37 ℃、120 r/min培养12 h,4 ℃、6 000 r/min离心10 min,收集菌体沉淀,用无菌PBS洗涤3 次,加入牛肉膏蛋白胨液体培养基重悬至OD600nm=2.0。取4 份菌悬液并加入SIF4使其终质量浓度分别为0 MIC、1/2 MIC、MIC和2 MIC,37 ℃、120 r/min培养12 h,每4 h取样1 mL,以0 MIC组为阴性对照,以TritionX-100组为阳性对照。取1 mL细胞培养液用福林-酚法测定菌体蛋白质量浓度。取1 mL SIF4处理菌悬液,添加500 μL溶菌酶(10 mg/mL)和500 μL TE缓冲液混匀,37 ℃保温20 min。加入3 mL无菌PBS稀释后进行冰浴间隔超声破碎,4 ℃、4 000 r/min离心10 min,收集上清液,用试剂盒测定胞内ATP含量。
1.4 数据处理与分析
结果以平均值±标准差(n=3)表示,采用SPSS 25.0软件中单因素方差检验进行组内或组间均数差异多重比较(以P<0.05表示差异显著),方差齐性时采用最小显著性差异法,非齐性时使用塔姆黑尼T2法。
2 结果与分析
2.1 对菌体新陈代谢活力的影响
刃天青为氧化还原指示剂,可被胞内氧化还原酶不可逆还原为试卤灵,使其从初始的深蓝色弱荧光转变为粉红色强荧光并弥散至培养基,其不可逆还原程度与细胞新陈代谢活力呈正相关[20]。SIF4对大肠杆菌细胞代谢活力影响如图1所示。
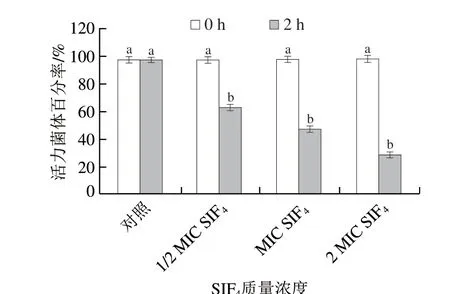
图1 SIF4对大肠杆菌新陈代谢活力的影响Fig.1 Effect of SIF4 on cell metabolic activity
从图1可看出,对照组(0 MIC组)菌体新陈代谢活力维持在正常水平,并未出现明显波动,表明菌体能量代谢生产与释放正常,细胞新陈代谢活力正常(>97%);经1/2 MIC、MIC和2 MIC的SIF4处理后,菌体新陈代谢活力显著下降(P<0.05),具有新陈代谢活力细菌占比分别下降至(63.09±2.02)%、(47.45±2.11)%和(28.80±2.03)%,相比对照组,菌体新陈代谢活力分别下降了35.17%、51.23%和70.41%,表明SIF4对大肠杆菌菌体新陈代谢有一定抑制作用。前期研究表明,SIF4可能以“毯式”模型破坏大肠杆菌菌体细胞质膜结构,增强细胞质膜通透性,并引起细胞膜去极化[15],同时,SIF4还可导致细胞质膜氧化损伤并诱导氧化应激产生过量自由基,从而破坏细胞质膜结构与功能[16]。大肠杆菌新陈代谢过程中,为其传递能量的电子传递链主要位于细胞质膜内表面,当菌体细胞质膜受到SIF4刺激与破坏之后,可能丧失为新陈代谢传递能量的功能[17],因此,菌体代谢活力显著降低。
2.2 对菌体呼吸代谢途径抑制的影响
EMP是大肠杆菌最重要的能量与物质代谢途径,在有氧条件下,EMP生成的NADH+H+经由电子呼吸链以氧作为氢受体,最终生成H2O和NAD+,无氧条件下,可将代谢中间产物(如丙酮酸)还原并生成NAD+;EMP代谢产生的乙酰辅酶A经TCA可彻底氧化为CO2和H2O,并释放大量能量;6-磷酸葡萄糖可作为HMP代谢起始物,为生物合成提供不同含碳数的碳骨架和还原力,HMP与EMP共同构成细胞糖分解代谢与有关合成代谢的调控网络。碘乙酸、丙二酸和磷酸钠分别是EMP、TCA和HMP途径的典型标准抑制剂,可抑制相应代谢途径从而降低呼吸代谢速率[21]。磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GPD)为巯基酶,是EMP生成ATP的关键酶,活性中心—SH可被碘乙酸不可逆抑制;琥珀酸脱氢酶(succinate dehydrogenase,SDH)是TCA途径中的重要酶,能催化琥珀酸脱氢生成延胡索酸,并将2H转移生成FADH2,丙二酸为琥珀酸结构类似物,是SDH竞争性抑制剂,为TCA典型抑制剂;6-磷酸葡糖脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)是HMP途径关键酶,为四亚基寡聚酶,完全受NADPH/NADP+的相对比例控制,胞内NADPH浓度高,HMP就会受到抑制,反之则被激活,磷酸钠为HMP途径典型抑制剂[22]。SIF4与标准呼吸代谢典型抑制剂对大肠杆菌菌体呼吸抑制效果如表1所示。
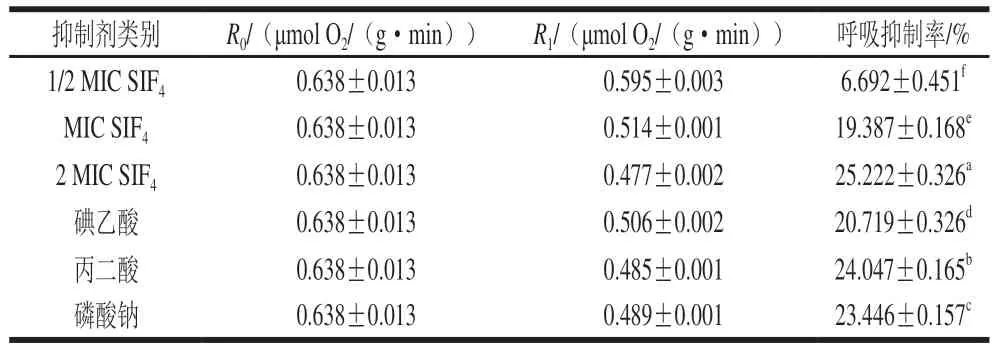
表1 SIF4及典型抑制剂对大肠杆菌呼吸抑制率的影响Table 1 Inhibitory effects of SIF4 and typical inhibitors on the respiration of Escherichia coli
由 表1 可 看 出,1/2 M I C、M I C 和2 M I C 组SIF4菌体呼吸抑制率分别为(6.692±0.451)%、(19.387±0.168)%和(25.222±0.326)%,呼吸抑制率与处理剂量呈正相关关系,且组间差异显著(P<0.05)。碘乙酸、丙二酸和磷酸钠组菌体呼吸抑制率分别为(20.719±0.326)%、(24.047±0.165)%和(23.446±0.157)%,组间有显著性差异(P<0.05)。如上文所述,当SIF4与典型呼吸抑制剂抑制的主要呼吸代谢途径相差越大时,由于增效作用,叠加率会越高,反之亦然[18],因此,若SIF4与典型抑制剂无协同增效作用,则叠加率较小,可由此判定SIF4的呼吸代谢抑制机理。SIF4与典型抑制剂复配对呼吸叠加率的影响如表2所示。

表2 SIF4及典型抑制剂对大肠杆菌呼吸叠加率的影响Table 2 Synergistic inhibitory effect of SIF4 combined with typical inhibitors on the respiration of Escherichia coli
由表2可看出,碘乙酸、丙二酸和磷酸钠与SIF4复配的呼吸叠加率分别为(1 9.9 8 2±0.1 3 3)%、(27.207±0.178)%和(33.304±0.566)%,碘乙酸和SIF4复配的呼吸叠加率最低,表明SIF4很可能通过抑制EMP影响菌体能量与物质代谢。前期研究发现,SIF4主要通过抑制大肠杆菌EMP的已糖激酶活性来表现高抗菌活性[16],本研究结果与前期研究所发现糖代谢抑制机理基本一致。
2.3 对菌体细胞质膜离子通道ATP酶的影响
Na+K+-ATP酶和Ca2+Mg2+-ATP酶是极其重要的细胞质膜离子通道ATP酶,对维持细胞质膜通透性、结构完整性、低钠高钾胞内环境、静息电位以及信号传导有重要意义[23-24],Na+K+-ATP酶和Ca2+Mg2+-ATP酶的活性受膜流动性影响并受ATP水平调控[25]。
SIF4对细胞质膜离子通道Na+K+-ATP酶活性的影响如图2所示,经SIF4处理后,菌体细胞质膜离子通道Na+K+-ATP酶活力与对照组相比均显著降低(P<0.05),1/2 MIC组、MIC和2 MIC组处理8 h时Na+K+-ATP酶活力比处理4 h时均有所上升,分别从(30.47±0.92)、(23.69±0.86)、(21.67±0.95)U/mg上升至(31.80±0.91)、(26.03±0.72)、(23.99±0.44)U/mg,特别是MIC组和2 MIC组,组内差异均显著(P<0.05);8 h后Na+K+-ATP酶活力均显著下降,可能是由于SIF4处理前期菌体为应激适应阶段,通过增加细胞质膜离子通道ATP酶活力来增强菌体呼吸代谢和抵御外界不利环境[16];金属抗菌肽SIF4为金属阳离子抗菌肽,带正电荷,可与革兰氏阴性菌细胞膜上脂多糖(lipopolysaccharide,LPS)通过静电吸附作用结合于细胞膜脂质膜中,从而牵引整个抗菌肽分子进入质膜,扰乱质膜上蛋白质与脂质的有序排列,通过“位移”而聚合形成跨膜通道,从而破坏细胞膜结构完整性并导致胞内容物外溢,进而起到抑菌作用[16],推断细胞质膜是SIF4重要的抑菌效应靶点。TritonX-100组随处理时间延长,细胞质膜离子通道Na+K+-ATP酶活力显著下降,处理12 h时,Na+K+-ATP酶活力由初始的(39.03±1.00)U/mg显著降低至(2.41±0.67)U/mg(P<0.05),降幅为93.83%,主要是由于TritonX-100为具有亲水和疏水基团的非离子型去垢剂,可将膜蛋白从细胞质膜解离,破坏细胞质膜结构并增强膜通透性[26]。细胞质膜受损会影响能量代谢和膜内外质子浓度差[17],并影响Na+K+-ATP酶活性,使基于细胞膜的转运代谢无法完成并诱导细胞提前程序性凋亡[15]。
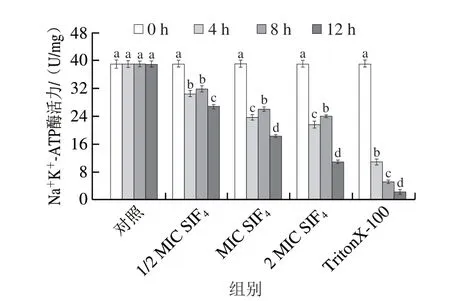
图2 SIF4对大肠杆菌Na+K+-ATP酶活力的影响Fig.2 Effect of SIF4 on Na+K+-ATPase activity in Escherichia coli
SIF4对细胞质膜离子通道Ca2+Mg2+-ATP酶活力影响如图3所示,对照组Ca2+Mg2+-ATP酶活力稳定,无明显波动(P>0.05)。SIF4处理8 h后,与处理4 h相比,1/2 MIC和MIC组Ca2+Mg2+-ATP酶活力略有上升,2 MIC组则呈下降趋势。SIF4处理12 h时,1/2 MIC、MIC和2 MIC组Ca2+Mg2+-ATP酶活力由初始的(27.55±0.88)U/mg分别降至(20.27±0.58)、(14.30±0.74)U/mg和(7.65±0.53)U/mg(P<0.05),降幅分别为26.42%、48.09%和72.23%,可能是由于SIF4破坏了细胞质膜结构,改变了细胞质膜通透性,使胞内Ca2+、Mg2+、Na+、K+等离子泄露,破坏了膜内外离子电动势,从而使细胞质膜离子通道Ca2+Mg2+-ATP酶活力显著下降[15-16];此外,1/2 MIC和MIC组出现短暂Ca2+Mg2+-ATP酶活力升高现象,随后Ca2+Mg2+-ATP酶活力显著降低,可能与菌体应激适应有关[27]。有研究表明,胞内Ca2+过量可损害能量系统结构和功能,诱导产生过量自由基并导致组织与细胞损伤[28],因此,Ca2+Mg2+-ATP酶活性与细胞质膜结构完整及细胞质膜氧化损伤有一定关系[16]。本研究还发现,TritonX-100组Ca2+Mg2+-ATP酶活力组内差异显著(P<0.05),这与其具有很强的细胞质膜结构破坏作用和影响细胞质膜通透性能力有关[26]。

图3 SIF4对大肠杆菌Ca2+Mg2+-ATP酶活力的影响Fig.3 Effect of SIF4 on Ca2+Mg2+-ATPase activity in Escherichia coli
2.4 对菌体胞内ATP生物合成的影响
当细胞质膜受损或细胞凋亡时,胞内ATP含量迅速下降,ATP含量变化能直接反映菌体存活状态[14]。由图4可看出,初始阶段组间胞内ATP含量无显著差异(P>0.05)。处理4 h时,实验组与对照组均存在显著差异(P<0.05),但1/2 MIC与MIC组、MIC与2 MIC组组间无显著性差异(P>0.05),而1/2 MIC与2 MIC组存在显著性差异(P<0.05),可能与1/2 MIC组处理剂量较低和处理时间过短有关;处理8 h和12 h时,组间均存在显著差异(P<0.05)。本研究还发现,对照组培养0~12 h时,胞内ATP酶含量由初始(46.13±0.70)×10-6μmol/g上升至(67.82±0.70)×10-6μmol/g,增幅为47.02%,可能与菌体代谢旺盛,需要大量ATP为菌体物质代谢提供能量来源和碳骨架等中间体,以及菌体处于对数生长期等因素有关[29-30]。TritonX-100组胞内ATP酶含量呈明显降低的趋势,从初始的(46.13±0.70)×10-6μmol/g下降至处理12 h时的(6.09±0.72)×10-6μmol/g,降幅达到86.80%,这与TritonX-100有较强的细胞质膜裂解能力有关[26];SIF4处理后,除呼吸代谢受到抑制外,胞内ATP含量也呈下降趋势,特别是2 MIC组对胞内ATP合成抑制最为明显,胞内ATP含量减少可能与ATP合成速率降低或胞内ATP水解加速有关,或与细胞质膜高度受损导致细胞质膜锚定的能量代谢酶功能受损、细胞质膜渗透性增加以及生物氧化与电子传递链不可逆受损[16]等有关,本研究结果与Santos[31]和Chingaté[32]等报道结果相似。
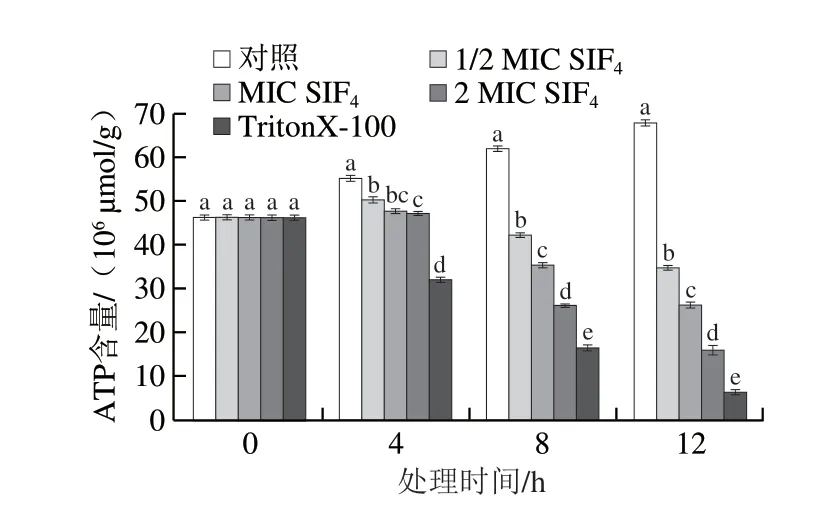
图4 SIF4对大肠杆菌胞内ATP含量的影响Fig.4 Effect of SIF4 on intracellular ATP concentration of Escherichia coli
3 结 论
本实验研究了SIF4对菌体新陈代谢活力、呼吸代谢途径、细胞质膜离子通道ATP酶及胞内ATP生物合成的影响。结果表明,金属抗菌肽SIF4处理可显著降低菌体新陈代谢活力(P<0.05),经2 MIC SIF4处理后,新陈代谢活力降低了70.41%;SIF4对菌体有较好的呼吸抑制作用,MIC和2 MIC组呼吸抑制率分别高达(19.39±0.17)%和(25.22±0.32)%;呼吸叠加率分析结果表明,SIF4可能通过抑制EMP影响菌体呼吸代谢;此外,SIF4处理后,大肠杆菌细胞质膜离子通道Na+K+-ATP酶和Ca2+Mg2+-ATP酶活力显著降低(P<0.05),推断细胞质膜是SIF4重要的抑菌效应靶点;处理8 h和12 h时,实验组组间胞内ATP含量均存在显著差异(P<0.05),胞内ATP含量降幅最明显,特别是2 MIC组,可能与细胞质膜受损、ATP合成减少或消耗增加、细胞质膜通透性增加等因素有关。
