向日葵列当毛蕊花糖苷的提取工艺优化及其抗氧化活性
2022-08-09孔德兴徐永清韩瑛琪贺付蒙冯艳忠李凤兰
孔德兴,徐永清,杨 燕,韩瑛琪,贺付蒙,王 雪,冯艳忠,刘 娣,李凤兰
(1东北农业大学 生命科学学院,黑龙江 哈尔滨 150030;2黑龙江省农业科学院,黑龙江 哈尔滨 150025)
向日葵列当(Orobanchecumana)为列当科列当属植物,别名毒根草、兔子拐棍[1],属于寄生性双子叶一年生草本植物,全球范围内均有分布,是危害最严重的寄生性杂草之一。向日葵列当寄生于向日葵,给农业生产带来了巨大的经济损失,一直以来都被当作杂草防治防控。但向日葵列当与草苁蓉(Boschniakiarossica)、肉苁蓉(Cistanchedeserticola)等名贵中草药在化学成分、药理作用上有很多相似之处,同时又具有资源丰富、成本低等优点,因此,向日葵列当可以作为药用资源植物进行开发利用。
列当科植物中主要含有苯乙醇苷类化合物、环烯醚萜类化合物、木脂素及其苷类等多种化学成分,具有较高的药用价值[2-3]。赵梦霞[4]对向日葵列当的化学成分、抗氧化活性和抗菌活性进行了系统研究,证实向日葵列当中的正丁醇段具有很好的抗氧化活性,乙酸乙酯段和正丁醇段均有较好的抗菌活性。毛蕊花糖苷(acteoside)又名类叶升麻苷,为典型的苯乙醇苷类化合物,广泛存在于植物界[5]。曲正义等[6-7]从向日葵列当中分离提取出6种单体化合物,筛选出抗氧化活性较强的苯乙醇苷类化合物,利用RP-HPLC测定发现向日葵列当中黄药苷(crenatoside)和毛蕊花糖苷的总含量达到药材质量的1%左右。孔征等[8]通过Box-Behnken响应面法优化管花肉苁蓉中毛蕊花糖苷的提取工艺,提高了毛蕊花糖苷的提取效率。现代药理学研究表明,毛蕊花糖苷具有抗氧化、抗炎杀菌、保护神经、抗肿瘤、增强学习记忆、抗病原微生物和保护皮肤等多种功能[9-14]。
向日葵列当的细胞壁坚硬,是提取其有效药用成分的主要障碍,采取破壁法提取其有效成分是解决该障碍的有效策略之一。且中药材细胞破壁后具有良好的吸收性、溶解性和化学活性等,解决了使用复杂、耗时等问题,甚至个别中药的药效可提高4~5倍[15]。利用灵芝和酿酒酵母发酵物对油菜花粉壁进行破壁的研究表明,发酵物中含有木质素酶、纤维素酶、蛋白酶和果胶酶等,灵芝和酿酒酵母发酵物对油菜花粉的破壁率可高达85.08%和 88.30%[16]。尚德静等[17]利用食用菌生长过程中分泌产生的纤维素酶、果胶酶、蛋白酶对植物细胞壁进行生化处理,最终提高了植物细胞壁破壁率,使植物内营养物质能更好释放。
对植物细胞进行破壁处理主要是降解细胞壁组分中的纤维素和木质素。本研究对木质素降解菌和纤维素降解菌进行混合培养,建立混合菌系并用于向日葵列当的发酵破壁,采用单因素试验和响应面优化试验探索复合菌剂的最佳破壁酵解条件,同时通过测定对OH·自由基、DPPH自由基和超氧阴离子的清除活性,评价向日葵列当毛蕊花糖苷的体外抗氧化活性,以期获得一种高效提取向日葵列当药用成分的方法体系,为提高该植物的应用价值和资源合理应用奠定基础。
1 材料与方法
1.1 供试植物和菌种
向日葵列当全草于2019年采自新疆阿勒泰向日葵种植地。产纤维素酶菌株有真菌雷斯青霉(Penicilliumraistricki)(S1)、产红青霉(Penicil-liumrubens)(S2)和霉菌(Fungalsp.)(S3),产木质素酶菌株有白腐菌(Phanerochaetcchrysosporium)(S4)和黄孢原毛平革菌(Phanerochaetechrysosporium)(S5),以上菌株均由东北农业大学植物资源与分子生物学实验室提供。
1.2 复合菌拮抗试验
将3株产纤维素酶和2株产木质素酶的菌株分别组合接种到同一个PDA培养基平板中,观察各培养基中的菌株生长状况,并观察各菌株之间是否能生长在一起,以及是否有明显的分界线。能够生长在一起、无明显分界线的菌株不具有拮抗性,可以复配进行后续试验;不能生长在一起、有明显分界线的菌株具有拮抗性,不进行复配,应单独研究处理。
1.3 向日葵列当药用成分分析
1.3.1 向日葵列当浸提膏的制备 向日葵列当自然风干后,粉碎过孔径450 μm(40目)筛,室温保存备用。取50 g向日葵列当粉末用10倍体积的90%(体积分数)乙醇振荡浸提3次(20 ℃、140 r/min),振荡提取时间分别为72,48和24 h。合并3次浸提液后用旋转蒸发器减压浓缩至15 mL,移装至广口瓶中,置4 ℃冰箱内保存、备用[18]。
1.3.2 GC-MS分析 通过气相色谱-质谱联用仪(GC-MS)对提取得到的向日葵列当浸膏进行组分分析鉴定。参考文献[19]的方法设置参数:HP-INNOWAX毛细管柱(60 m×0.25 mm×0.25 μm)。升温程序:起始温度70 ℃,保持3 min;以5 ℃/min的升温速率升至150 ℃,保持3 min;再以0.5 ℃/min的升温速率升至154 ℃,保持2 min;最后以25 ℃/min的升温速率升至240 ℃,保持4 min。GC-MS条件:电离能70 eV,接口温度250 ℃,离子源温度230 ℃,扫描范围(m/z)45~550。
1.4 向日葵列当发酵用复合菌剂的筛选
分别用S4-S5、S4-S5-S2、S4-S5-S1和S4-S5-S1-S2组合成不同的复合菌剂对向日葵列当进行酵解,以未用任何菌酵解作为对照(CK),比较酵解液中毛蕊花糖苷含量,筛选适宜的发酵用复合菌剂。
1.5 毛蕊花糖苷酵解提取的单因素试验
预设酵解温度40 ℃、pH值6、酵解时间2 d为单因素试验中的常规值,以不同酵解温度(10,20,30,40和50 ℃)、pH值(5,6,7,8和9)和酵解时间(1,2,3,4和5 d) 3个单因素变量替换试验中的相应常规值,测定向日葵列当毛蕊花糖苷的含量,研究3个因素对毛蕊花糖苷提取效果的影响。
1.6 毛蕊花糖苷提取工艺的响应面优化
以单因素试验结果为基础,利用Design-Expert V8.0.6软件进行响应面设计,选取酵解温度(A)、酵解pH值(B)、酵解时间(C)为考察因素,以向日葵列当毛蕊花糖苷含量(Y)为考察指标,根据Box-Behnken中心组合原理设定3因素3水平响应面试验(表1)。

表1 向日葵列当毛蕊花糖苷提取工艺的Box-Behnken 试验设计因素与水平
1.7 酵解液中毛蕊花糖苷的HPLC检测
各组发酵试验结束后,将发酵液超声(功率80 W)提取30 min后蒸干,用乙醇提取制成乙醇提取液,过孔径0.22 μm有机溶剂滤膜,在高效液相色谱仪器上进样[20]。色谱柱为Agilent ZORBAX SB-C18(4.6 mm×250 mm×5 μm),流动相为乙腈/0.1%(体积分数)HAc水溶液,梯度洗脱(0~20 min,10%~20%乙腈;20~25 min,20%~30%乙腈),检测波长334 nm,柱温为室温(30 ℃),进样量100 μL。
1.8 毛蕊花糖苷体外抗氧化活性的测定
采用梯度稀释法将毛蕊花糖苷配制成0.4,0.2,0.1,0.05,0.025,0.012 5 mg/mL的溶液,以相同质量浓度的VC溶液作为阳性对照,研究毛蕊花糖苷的体外抗氧化活性。
1.8.1 对OH·自由基的清除能力 将2 mL毛蕊花糖苷溶液加入到试管中,再加入2 mL FeSO4(2 mmol/L)和2 mL水杨酸(2 mmol/L),充分混匀后加入2 mL H2O2(2 mmol/L),在37 ℃水浴锅中充分反应30 min,冷却至常温,在510 nm波长处测定吸光度值。用蒸馏水代替H2O2溶液作为样品背景,用蒸馏水代替毛蕊花糖苷溶液作为空白对照,计算OH·自由基清除率(D1)。
D1=[1-(As-As0)/A0]×100%。
式中:A0为空白对照的吸光度值,As为毛蕊花糖苷的吸光度值,As0为样品背景的吸光度值。
1.8.2 对DPPH自由基的清除能力 将2 mL毛蕊花糖苷溶液加入到试管中,再加入无水乙醇配制的2 mL DPPH(0.017 8 mmol/L)溶液,充分混匀后在室温下避光反应10 min,在517 nm波长处测定其吸光度值。用无水乙醇代替DPPH溶液作为样品背景,用无水乙醇代替毛蕊花糖苷溶液作为空白对照,计算DPPH自由基清除率(D2)。
D2=[1-(A-As)/A0]×100%。
式中:A为毛蕊花糖苷的吸光度值,As为样品背景的吸光度值,A0为空白对照的吸光度值。
1.8.3 对超氧阴离子的清除能力 在试管中分别加入4.5 mL Tris-HCl(50 mmol/L)缓冲液和1 mL 毛蕊花糖苷溶液,在37 ℃水浴锅中恒温反应25 min后加入0.5 mL邻苯三酚(3 mmol/L),迅速振荡摇匀,加入到比色皿中,在325 nm波长处每隔30 s测定吸光度值。用蒸馏水代替毛蕊花糖苷溶液作为空白对照,计算超氧阴离子自由基清除率(D3)。
D3=(ΔA0-ΔAs)/ΔA0×100%。
式中:ΔAs为毛蕊花糖苷的吸光度值,ΔA0为空白对照的吸光度值。
1.9 数据统计分析
所有试验数据均采用3次生物学重复或3次技术重复的平均值,用Microsoft Excel分析试验数据并绘图。采用SPSS 17.0软件进行统计分析,采用独立样本进行GraphPad Prism 5差异显著性分析。
2 结果与分析
2.1 酵解向日葵列当的复合菌之间的拮抗作用
酵解向日葵列当的复合菌间的拮抗结果见图1。

A.S3和S4菌株复配正面;B.S3和S4菌株复配背面;C.S3和S5菌株复配正面;D.S3和S5菌株复配背面;E.S4和S5菌株复配正面;F.S4和S1菌株复配正面;G.S5和S1菌株复配正面;H.S4和S2菌株复配正面;I.S5和S2菌株复配正面
如图1所示,在5种菌株之间,霉菌(S3)与白腐菌(S4)、黄孢原毛平革菌(S5)(图1-A-D)复配均产生抑菌圈,相互拮抗,不适合进行混合复配;其余菌种复配均无分界线产生,菌丝混合生长在一起,无拮抗现象,具有良好的兼容性。因此,真菌雷斯青霉(S1)、产红青霉(S2)、白腐菌(S4)和黄孢原毛平革菌(S5)菌株可以建立复合菌系,可用于研究单独菌株和混合菌株的降解效果。
2.2 向日葵列当中的药用成分
经GC-MS全组分分析,从向日葵列当浓缩浸膏中共检测出207种化学物质,其中相对含量较高的40种组分见表2。

表2 向日葵列当中相对含量居前40的组分信息
表2列出的40种组分中酸类化合物有9种,酯类化合物有9种,多醇类化合物有2种,醛类化合物有2种,烷烃类化合物有3种,烯烃和炔烃类化合物有2种,芳香烃类化合物有6种,苯乙醇苷类化合物有1种,萜类化合物有1种,其他化合物有5种。除此之外检测到具有药效成分的5-羟甲基糠醛(5-Hydroxymethylfurfural)、亚麻酸(Linoleic acid ethyl ester)、别香橙烯(Alloaromadendrene)、2-吡啶(2-Fluoropyridine)、3-正十七醇(3-Heptanecanol)、邻苯二甲酸二壬酯(Dinonyl-phthalate)、原儿茶醛(Protocatechual-dehyde)和(Z)-8,11,12,Trihydroxy-9-ocatdecenoic acid等组分。通过化学文摘社CAS(Chemical Abstracts Service)登录号查询化学名称并结合峰图出峰时间(图2)发现,还检测到重要药效成分苯乙醇苷类物质毛蕊花糖苷。《中国药典》2015年版规定名贵中药材肉苁蓉中主要药效成分毛蕊花糖苷的总量不得少于0.3%,而向日葵列当中其含量高达2.470%。

图2 向日葵列当全组分(A)和毛蕊花糖苷(B)的GC-MS分析
2.3 向日葵列当发酵用复合菌剂的筛选
由图3可以看出,经复合菌S4-S5、S4-S5-S2、S4-S5-S1、S4-S5-S1-S2发酵后,毛蕊花糖苷含量分别为441,643,1 074和1 191 μg/mL,以S4-S5-S1、S4-S5-S1-S2复合菌剂破壁发酵向日葵列当的效果为佳。与CK相比,S4-S5-S1、S4-S5-S1-S2复合菌剂分别可将毛蕊花糖苷含量提升约2.44倍和2.70倍。组合菌剂S4-S5-S1-S2的效果与组合S4-S5-S1无显著差异(P>0.05),但组合S4-S5-S1以3种菌复合而成,成本和培养技术要求较低,因此该组合是向日葵列当破壁发酵的最优选择。
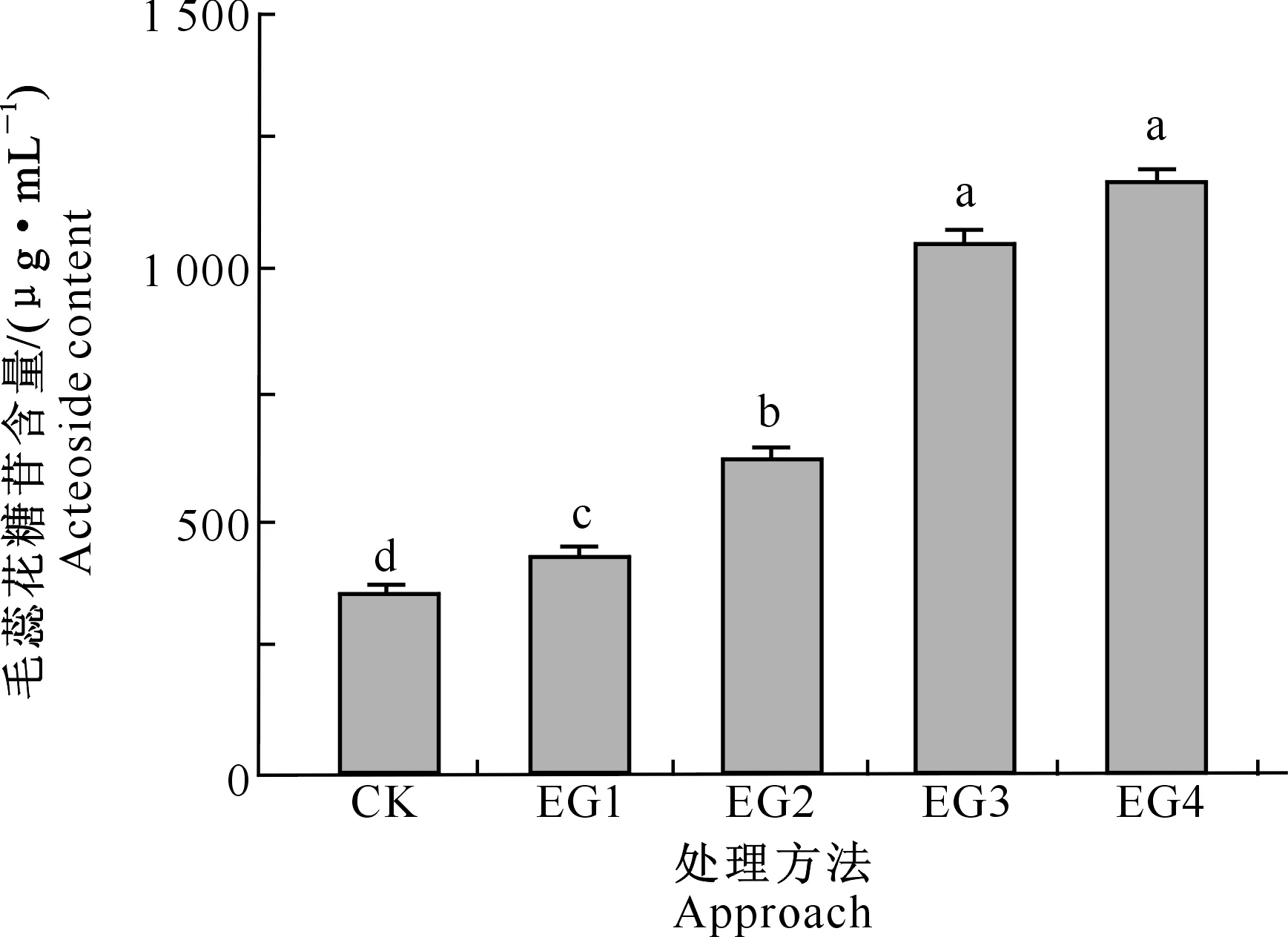
CK.未用菌处理;EG1.复合菌S4-S5;EG2.复合菌S4-S5-S2;EG3.复合菌S4-S5-S1;EG4.复合菌S4-S5-S1-S2。
2.4 向日葵列当毛蕊花糖苷提取的单因素试验结果
2.4.1 酵解温度 如图4-A所示,随着发酵温度的不断升高,向日葵列当毛蕊花糖苷提取量呈先上升后逐渐下降的趋势,在30 ℃左右时达最高,说明酵解温度过高或过低都会降低提取效率。综合比较确定向日葵列当破壁发酵的响应面试验温度宜为20~40 ℃。
2.4.2 酵解pH值 由图4-B可知,向日葵列当中毛蕊花糖苷提取量随着pH上升而升高, pH为7时达到最高,之后逐渐下降。这是因为在最适pH范围内酶活性最大,酸性过大或碱性过大的环境都会降低酶活性。故酵解pH值应在6~8。
2.4.3 酵解时间 由图4-C可以看出,随着酵解时间的延长,向日葵列当中毛蕊花糖苷提取量逐渐升高,酵解3 d左右达最大值,之后逐渐降低。故确定以酵解2~4 d进行响应面优化分析。
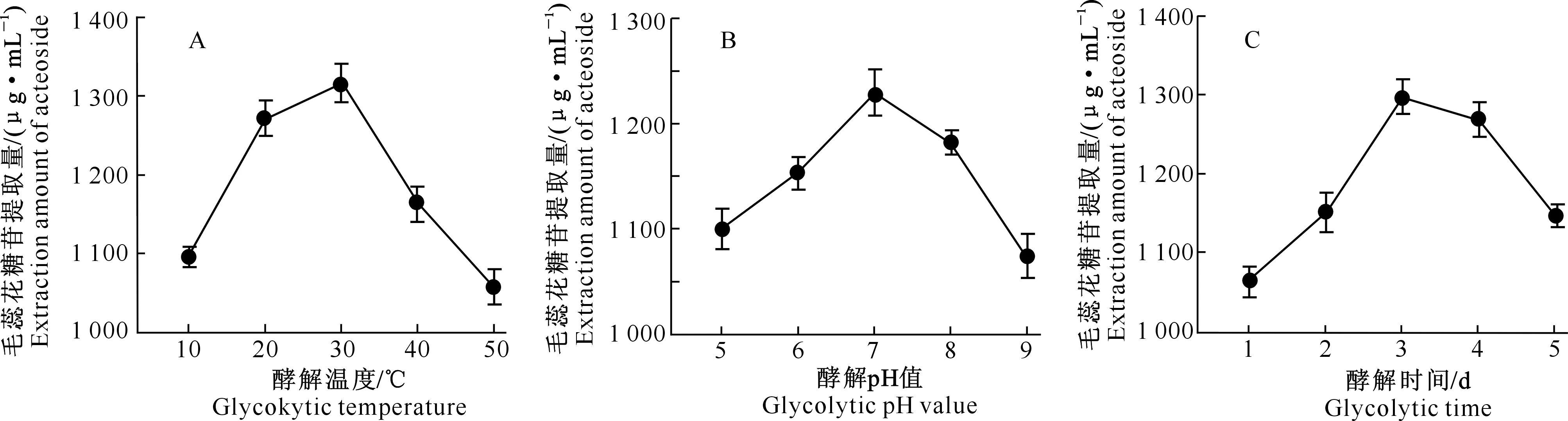
图4 向日葵列当毛蕊花糖苷含量的单因素试验结果
2.5 向日葵列当毛蕊花糖苷提取工艺的响应面优化
2.5.1 响应面试验结果与回归方程的建立 在单因素试验基础上,利用Design-Expert V8.0.6软件,以毛蕊花糖苷提取量为响应值(Y),以酵解温度(A)、酵解pH值(B)和酵解时间(C)为自变量,进行3因素3水平酵解条件响应面优化,结果见表3。对试验结果进行多元回归拟合分析,得到毛蕊花糖苷提取量对3因素的二次多项回归方程为:Y=1 343.6-53.87A+5B+38.38C+1.75AB-25.5AC+10.25BC-96.1A2-21.855B2-48.1C2。对回归模型进行方差分析,结果见表4。由表4可见,该响应面模型具有显著性,回归极显著(P<0.000 1),方程相关系数R2为0.976 7,校正决定系数Radj=0.949 6,说明该模型与实际结果拟合良好,试验方法可靠;失拟项不显著(P=0.122 7),进一步说明该方程与实际结果拟合较好,可用于向日葵列当毛蕊花糖苷提取的分析与计算;变异系数(1.35%)低,证明该模型可靠性高。从各项 的F值可以看出,影响向日葵列当毛蕊花糖苷提取量的因素依次为:A>C>B,即酵解温度>酵解时间>酵解pH值。

表3 向日葵列当毛蕊花糖苷提取工艺的响应面优化结果
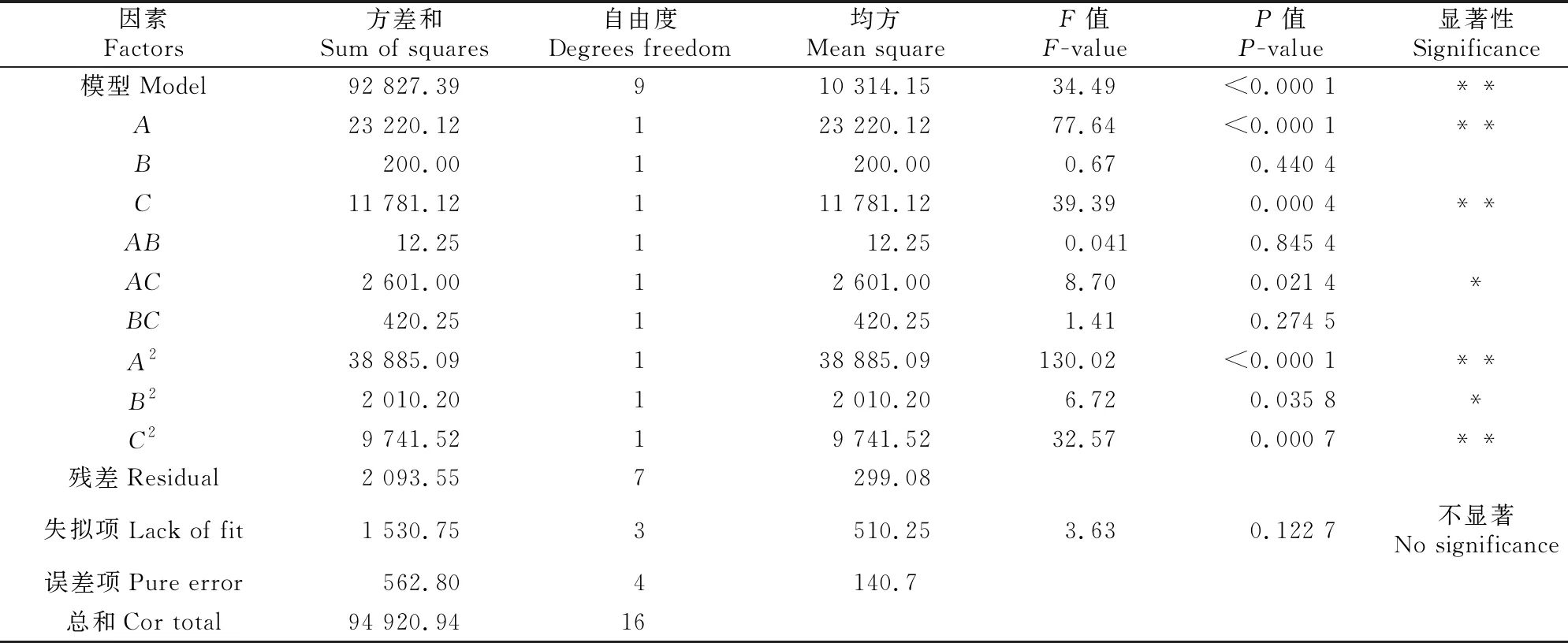
表4 向日葵列当毛蕊花糖苷提取回归模型的方差分析
2.5.2 酵解温度与酵解时间的交互作用 酵解温度与酵解时间的交互作用对向日葵列当毛蕊花糖苷提取量的影响结果如图5所示,其等高线图为椭圆形,说明这两个因素交互作用对结果的影响显著;同时,从响应面图可以看出,毛蕊花糖苷提取量随酵解温度上升的幅度比酵解时间稍大,说明酵解温度对毛蕊花糖苷提取量的影响更强。毛蕊花糖苷提取量最大值出现在酵解温度25~35 ℃、培养时间2.5~3.5 d时。

图5 酵解温度与酵解时间对向日葵列当毛蕊花糖苷提取影响的曲面图和等高线图
2.5.3 酵解温度与酵解pH值的交互作用 酵解温度与酵解pH值的交互作用对向日葵列当毛蕊花糖苷提取量的影响结果如图6所示,其等高线图为椭圆形,说明这两个因素交互作用对结果的影响显著;同时,从响应面图可以看出,毛蕊花糖苷提取量随酵解温度上升的幅度比酵解pH大,说明酵解温度对毛蕊花糖苷提取量的影响更强。毛蕊花糖苷提取量最大值出现在酵解温度25~35 ℃、酵解pH值6.5~7.5时。
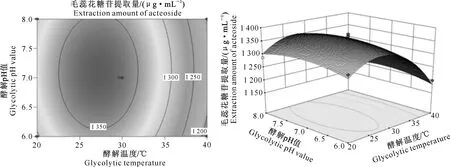
图6 酵解温度与酵解pH值对向日葵列当毛蕊花糖苷提取影响的曲面图和等高线图
2.5.4 酵解时间与酵解pH值的交互作用 酵解时间与酵解pH的交互作用对向日葵毛蕊花糖苷提取量的影响结果如图7所示,其等高线图为椭圆形,说明这两个因素交互作用对结果的影响显著;同时,从响应面图可以看出,毛蕊花糖苷提取量随酵解时间上升的幅度比酵解pH值稍大,说明酵解时间对向日葵列当毛蕊花糖苷提取量的影响更强。毛蕊花糖苷提取量最大值出现在酵解pH值为6.5~7.5、酵解时间在2.5~3.5 d时。

图7 酵解时间与酵解pH值对向日葵列当毛蕊花糖苷提取影响的曲面图和等高线图
2.5.5 优化工艺验证 由Design-Expert.V8.06 软件求解回归方程,得出毛蕊花糖苷提取量最大时的条件为:酵解温度26.53 ℃,酵解pH值7.22,酵解时间3.52 d,此为复合菌剂对向日葵列当毛蕊花糖苷的最佳提取条件。在此条件下,向日葵列当毛蕊花糖苷提取量预测值为1 383 μg/mL。综合试验操作的可行性,调整提取条件为:酵解温度 27 ℃,酵解pH值7,酵解时间3.5 d,进行3次重复试验,向日葵列当毛蕊花糖苷提取量为 1 396 μg/mL,与预测值相差不大,说明此酵解工艺可以有效提高向日葵列当中毛蕊花糖苷的提取量。
2.6 向日葵列当毛蕊花糖苷的抗氧化活性
如图8所示,向日葵列当毛蕊花糖苷对OH·自由基、DPPH自由基和超氧阴离子的清除能力随其质量浓度的升高而不断提高,但其均始终显著低于同质量浓度的Vc溶液(P<0.05)。此结果表明,毛蕊花糖苷有明显的抗氧化活性且呈剂量依赖性。
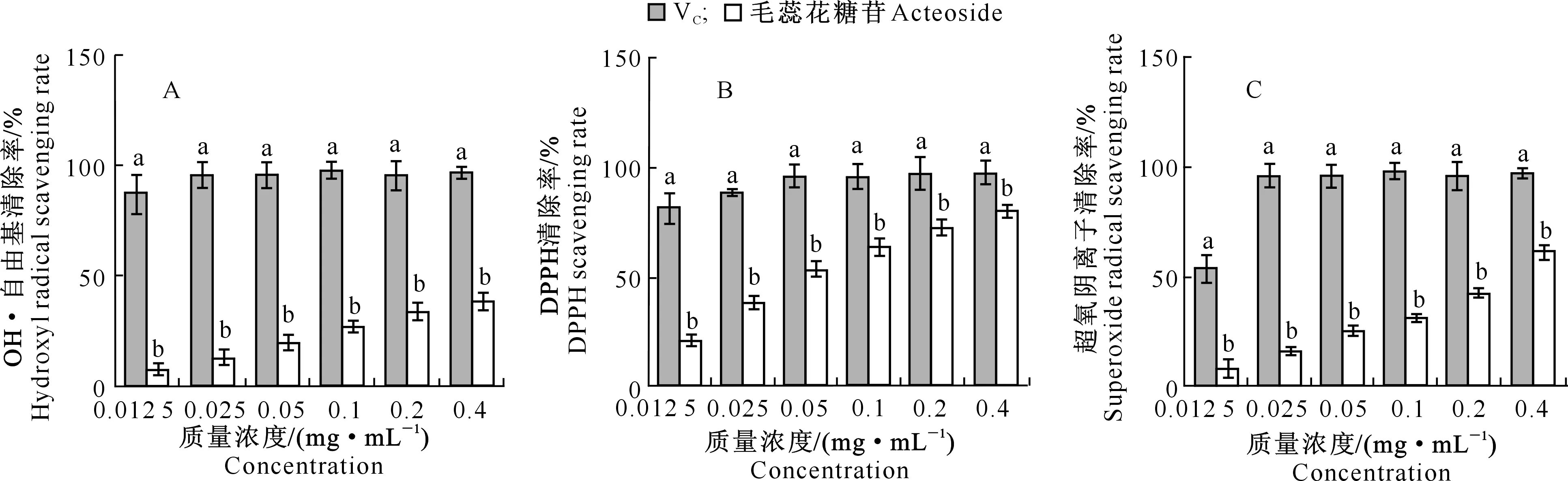
图8 向日葵列当毛蕊花糖苷的抗氧化活性
3 讨 论
田间杂草是农业生产中管理成本升高、产量和经济效益受抑的主要因素之一,然而某些杂草因具有一定的药用属性可以作为中药资源进行开发利用。对农田杂草型药用植物的药效物质基础、炮制方法等开展研究,对于杂草的综合治理和资源有效利用具有重要意义。
近年来,人们对肉苁蓉过度采挖的现象频发,加之土地沙漠化情况愈发严重,肉苁蓉几近灭绝,被列为国家二级保护植物。而向日葵列当中的苯乙醇苷类、环烯醚萜类、多糖类等物质与肉苁蓉的成分十分接近,其中苯乙醇苷类化合物具有抗菌、抗炎、增强记忆、保肝、强心等多种药理作用[21],且苯乙醇苷类化合物具安全性、低毒性等特点,在开发新药上有重大意义,因此向日葵列当具有较好的开发利用价值。本研究通过GC-MS技术,从向日葵列当浸提膏中检测到苯乙醇苷类典型化合物毛蕊花糖苷,其含量高达2.470%,进一步证明了将其开发为中药资源的潜力。
为了高效利用向日葵列当,使其细胞中的药用成分充分释放,首先要将其坚硬的细胞壁破除。向日葵列当细胞壁主要由木质素、纤维素等成分构成,通过微生物发酵进行破壁处理被认为是简便有效的方法之一。毕京芳等[22]发现,在中药药渣中接入一定的微生物菌剂后,可以加快启动木质素与纤维素的降解,其降解率分别比对照组提高了40.43%和26.14%。杨杭等[23]从中药材中分离得到2株高效破壁菌株LSX-9和LSZ-1,破壁试验结果表明,它们不仅能缩短多糖和三萜的释放时间,还能提高提取率。本试验利用产木质素酶菌株和产纤维素酶菌株对向日葵列当进行酵解,发现不同组合的复合菌株对向日葵列当的酵解作用有所差异。其中S4-S5-S1-S2和S4-S5-S1组合的复合菌系对向日葵列当的破壁能力均较强,因后者是3种菌组成,因此更为适用。本研究结果表明,向日葵列当毛蕊花糖苷提取量的影响因素主次顺序是酵解温度>酵解时间>酵解pH值;酵解破壁的最佳条件为:酵解温度27 ℃,酵解时间3.5 d,酵解pH值7,在此条件下向日葵列当毛蕊花糖苷提取量为1 396 μg/mL,与理论值相差不大。
陈琳琳等[24]发现,西南猫尾木颗粒保健茶抗氧化能力可能与毛蕊花糖苷有关。本研究结果表明,向日葵列当毛蕊花糖苷对OH·、DPPH自由基和超氧阴离子的清除能力不同,且抗氧化活性均比同质量浓度的Vc弱,但在一定剂量范围内表现出良好的抗氧化性能,说明向日葵列当毛蕊花糖苷具有抑制自由基生成的作用,可以作为自由基清除型抗氧化剂应用。
