氟离子植入猪骨源羟基磷灰石对MC3T3-E1细胞黏附、增殖与成骨分化的影响
2023-10-14李梁陈桂珍
李梁 陈桂珍
【摘 要】目的 檢测氟离子植入猪骨来源羟基磷灰石(PHA)对小鼠前成骨细胞(MC3T3-E1)黏附、增殖及成骨分化的影响。方法 取猪骨松质用高温烧结的方法制备PHA,使用氟化钠浸泡结合二次高温烧结进行氟离子植入,制备获得氟化猪骨源羟基磷灰石(FPHA)骨块,进行研磨获得颗粒材料后制备压片,采用PHA颗粒制备的压片为对照组,采用FPHA颗粒制备的压片为实验组。在压片材料表面接种小鼠MC3T3-E1前成骨细胞株,通过扫描电镜SEM观察不同时间细胞黏附形态,CCK-8法检测细胞增殖情况,RT-PCR法检测细胞成骨相关基因碱性磷酸酶ALP、骨钙素BGLAP、骨桥蛋白OPN mRNA的表达情况。结果 扫描电镜SEM观察可见,PHA与FPHA组细胞黏附生长良好;两组细胞接种1、7d后OD值比较,差异无统计学意义(P>0.05);FPHA组接种3、5 d后OD值高于PHA组,差异有统计学意义(P<0.05);RT-PCR结果显示,FPHA组细胞接种3、7 d后ALP、BGLAP mRNA表达水平均高于PHA组,且两组细胞接种7 d后材料表面细胞ALP与BGLAP mRNA表达水平均高于细胞接种3 d后,差异有统计学意义(P<0.05)。结论 PHA与FPHA材料均具有良好的细胞相容性,氟离子植入猪骨羟基磷灰石可促进小鼠前成骨细胞早期增殖与成骨分化。
【关键词】氟离子;羟基磷灰石;成骨细胞;黏附;增殖;成骨分化
中图分类号:R783.1 文献标识码:A 文章编号:1004-4949(2023)16-0001-04
Effects of Fluoride Incorporation into Porcine Hydroxyapatite on Adhesion, Proliferation and Osteogenic Differentiation of MC3T3-E1 Cells
LI Liang, CHEN Gui-zhen
(Department of Stomatology, the First Affiliated Hospital of Guangdong Pharmacological University, Guangzhou 510080, Guangdong, China)
【Abstract】Objective To evaluate the effects of fluorine incorporation into porcine hydroxyapatite (PHA) on attachment, proliferation and osteogenic differentiation of rat pre-osteoblast cell line MC3T3-E1. Methods PHA was fabricated from porcine bone by thermal treatment. Fluorine incorporation was carried out by sodium fluoride immersion and a second stage thermal treatment. The fluorinated porcine hydroxyapatite (FPHA) bone blocks were prepared, grinded to obtain particle materials, and then prepared into tablets. The tablets prepared by PHA particles were used as the control group, and the tablets prepared by FPHA particles were used as the experimental group. Mouse MC3T3-E1 pre-osteoblast cell line was inoculated on the surface of the tableting material. The cell adhesion morphology at different times was observed by scanning electron microscopy (SEM). The cell proliferation was detected by CCK-8 method. The expression of osteogenic related genes alkaline phosphatase ALP, osteocalcin BGLAP and osteopontin OPN mRNA was detected by RT-PCR. Results SEM observation showed that the cells in the PHA and FPHA groups adhered and grew well. There was no significant difference in OD value between the two groups on 1st and 7th days after cell inoculation (P>0.05). The OD value of FPHA group was higher than that of PHA group on 3rd and 5th days after cell inoculation, and the difference was statistically significant (P<0.05). The results of RT-PCR showed that the expression levels of ALP and BGLAP mRNA in FPHA group were higher than those in PHA group on 3rd and 7th days after cell inoculation, and the expression levels of ALP and BGLAP on the surface of the two groups on 7th day after cell inoculation were higher than those on 3rd day after cell inoculation, the differences were statistically significant (P<0.05). Conclusion PHA and FPHA materials have good cell compatibility. Fluorine incorporation into porcine hydroxyapatite can promote the early proliferation and osteogenic differentiation of mouse preosteoblasts.
【Key words】Fluorine; Hydroxyapatite; Osteoblast; Adhesion; Proliferation; Osteogenic differentiation
动物骨来源羟基磷灰石(hydroxyapatite,HA)是口腔临床应用最广泛的骨组织替代材料之一,主要由天然骨经物理化学手段去除有机物后制备获得,具有良好的生物相容性和骨传导性,在体内可被缓慢降解并引导成骨[1,2]。但由于其缺乏骨诱导性,研究人员试图对其改性以更好地满足骨缺损修复的临床需求。离子掺杂(植入)可改变磷灰石材料的理化与生物学性能,是目前磷灰石材料改性研究的热点。氟元素是骨形成及骨基质矿化的必需元素,可通过不同的机制影响骨代谢,包括通过降解释放到体液中参与骨改建,在植骨材料表面与植骨受区直接刺激成骨或破骨细胞活性,直接刺激成骨细胞合成相关蛋白等[3]。同时,氟也可促进磷灰石晶体的形成和生长,并对骨组织的矿化起促进作用[4]。因此,氟离子植入可能是提高磷灰石材料成骨效能的有效方案。然而,目前仍缺乏比较成骨细胞对FPHA和HA材料反应的相关研究。本实验在前期已制备完成猪骨源羟基磷灰石PHA与氟离子植入猪骨源羟基磷灰石FPHA的基础上,通过观察PHA与FPHA两种材料对小鼠前骨细胞MC3T3-E1早期黏附、增殖及成骨分化的影响,评估FPHA新材料的体外生物学性能,旨在加强对不同生物材料的骨传导机制的理解,并为开发用于医学植入的更好骨传导生物材料提供理论基础。
1 材料与方法
1.1 PHA及FPHA压片的制备
1.1.1 PHA与FPHA骨颗粒的制备 取成猪股骨头松质骨,高压锅内煮30 min后取出,去尽软组织晾干,以30%双氧水浸泡24 h,双蒸水冲洗;再以100%酒精浸泡24 h,取出干燥,将骨块研磨并收集直径约0.25~1 mm的骨颗粒,以程序控温马弗炉(西格玛公司,SGM6812BK,洛阳)烧结至800 ℃(升温速率10 ℃/min,在空气中维持加热2 h),自然冷却至常温后取出。将PHA颗粒浸泡于0.25 mol/L氟化钠溶液24 h后,二次高温烧结至700 ℃(升温速率10 ℃/min,在空气中维持加热3 h),冷却后以去离子水清洗浸泡3次,24 h/次,然后置于80 ℃干燥箱整夜干燥,制备获得FPHA颗粒[5,6]。
1.1.2 PHA与FPHA压片制备 秤取200 mg骨粉,利用旋转式压片机制备为直径8 mm、厚2 mm圆形片状。放入48孔板中后进行纸塑包装,以25 KGy剂量进行钴60γ射线灭菌备用。其中,采用PHA颗粒制备的压片为对照组(PHA组),采用FPHA颗粒制备的压片为实验组(FPHA组)。
1.2 MC3T3-E1细胞培养与接种 MC3T3-E1细胞培养小鼠前骨细胞株MC3T3-E1(中国科学院上海细胞库)培养于含10%胎牛血清(Gibco,美国)及1%青链霉素(Sigma,美国)的α-MEM低糖培養基(Hyclone,美国)中,在37 ℃、5%CO2、95%湿度细胞培养箱中常规培养,3 d后换液,细胞铺板80%左右传代,将第3~5代细胞应用于细胞黏附、增殖与成骨分化检测。观察MC3T3-E1细胞在PHA组与FPHA组压片表面黏附形态、MC3T3-E1细胞在PHA与FPHA组压片表面增殖情况、MC3T3-E1细胞在PHA与FPHA组压片成骨相关基因表达。
1.3 MC3T3-E1细胞在PHA与FPHA压片表面黏附形态观察 取悬浮于50 μl培养基中约5×104个细胞接种于各压片表面,细胞培养箱中静置30 min,待细胞贴壁后每孔加入250 μl培养基,置于细胞培养箱中常规培养。分别于接种后4 h与24 h后弃培养基,2.5%电镜专用戊二醛固定2 h,PBS漂洗3次后,酒精梯度脱水(30%、50%、70%、90%、100%),15 min/次,丙酮置换酒精30 min,醋酸异戊酯置换丙酮30 min,CO2临界点干燥,喷金镀膜后通过扫描电镜(FEI,Quanta 200,荷兰)观察MC3T3-E1细胞在PHA与FPHA压片表面的黏附形态。
1.4 CCK-8评估MC3T3-E1细胞在PHA与FPHA压片表面增殖情况 将PHA及FPHA压片放入48孔板中,表面加入500 μl培养基预浸泡24 h后吸出,取悬浮于50 μl培养基中约2×104个细胞接种于各压片表面,细胞培养箱中静置30 min,待细胞贴壁后每孔加入250 μl培养基,置于细胞培养箱中常规培养。细胞接种1、3、5、7 d后吸尽原培养基,每孔加入300 μl新鲜培养基与30 μl CCK8试剂(DOJINDO,同仁化学研究所,日本),避光孵育60 min后每孔取100 μl加入96孔板。使用酶联免疫检测仪在450 nm波长下测定各孔光密度值(OD值),OD值即代表增殖的相对细胞数量。
1.5 RT-PCR检测MC3T3-E1细胞在PHA与FPHA压片成骨相关基因表达 将MC3T3-E1细胞分别接种在PHA与FPHA压片3、7 d,RT-PCR检测细胞成骨分化相关基因ALP、BGLAP、OPN的表达水平:为了提取足够数量的总RNA,每组中5个压片为1个样本,通过Trizol(Invitrogen,美国)进行总RNA的提取;逆转录试剂盒(TaKaRa BIOINC,日本)进行逆转录获取cDNA。通过ABI 750(ABI,美国)荧光定量PCR仪检测ALP、BGLAP、OPN基因表达水平,内参为GAPDH。
1.6 统计学方法 采用SPSS 16.0统计学软件处理本研究数据,进行两组独立样本资料t检验,检验水准α=0.05;P<0.05表示差异有统计学意义。
2 结果
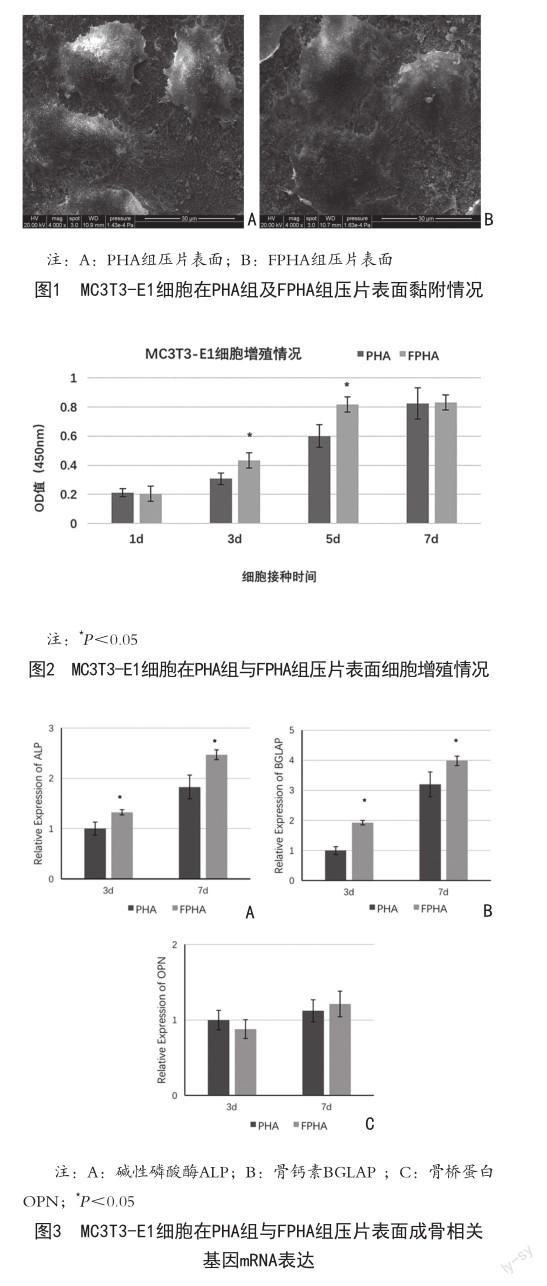
2.1 两组MC3T3-E1细胞黏附形态 PHA组与FPHA组细胞正常黏附生长,24 h细胞充分延展,呈多边形,伸出大量伪足与材料紧密粘附,并可见细胞间相互连接,见图1。
2.2 两组MC3T3-E1细胞增殖情况 两组细胞接种1 d后OD值比较,差异无统计学意义(P>0.05);FPHA组接种3、5 d后OD值优于PHA组,差异有统计学意义(P<0.05);两组细胞接种7 d后OD值比较,差异无统计学意义(P>0.05),见图2。
2.3 两组MC3T3-E1细胞成骨相关基因表达 FPHA组细胞接种3、7 d后ALP、BGLAP mRNA表达水平均高于PHA组,差异有统计学意义(P<0.05);两组细胞接种7 d后材料表面细胞ALP与BGLAP mRNA表达水平均高于细胞接种3 d后,差异有统计学意义(P<0.05);两组细胞接种3、7 d后OPN mRNA表达水平比较,差异无统计学意义(P>0.05),见图3。

3 讨论
从来源上看,HA可分为化学合成羟基磷灰石与生物骨来源羟基磷灰石(BHA)两类,后者是指由动物骨组织经物理和(或)化学手段去除有机物后制备获得[3]。牛骨来源的羟基磷灰石已在局部颌骨缺损修复中广为应用,如口腔种植修复治疗中的上颌窦提升、拔牙位点保存、种植位点增加骨量等。在用于制备BHA的生物供体当中,猪骨与人骨的成分相似度高,有其他动物骨无法相比的天然多孔结构,本研究制备猪骨来源PHA、FPHA并研究其生物学性能,探索一种新的骨替代材料。
细胞黏附是生物材料与生物体相互作用的第一阶段,对随后的迁移、增殖、分化非常关键,更快的黏附可通过竞争机制减少细菌感染的机会,材料的理化性影响细胞的早期黏附,包括材料亲水性、表面粗糙度、孔隙率等。粗糙的表面具有更高的表面能,较表面能低的表面更有利于细胞的黏附和延展[5],本实验中制备的PHA、FPHA组压片在扫描电镜下显示出多孔隙的粗糙表面,MC3T3-E1细胞在接种至材料表面2 h后呈现良好的黏附状态,提示两种材料均有良好的细胞相容性。在细胞增殖实验中,两组细胞接种1 d后OD值比较,差异无统计学意义(P>0.05),根据MC3T3-E1细胞的细胞学特征,在接种24 h内为黏附及紧密结合过程,其后进入早期增殖,细胞倍增周期为2~3 d,且实验操作中两种材料接种细胞数量相当,黏附时间一致,本研究认为此阶段两种材料对细胞增殖的影响尚不明显;FPHA组接种3、5 d后OD值优于PHA组,差异有统计学意义(P<0.05),表明FPHA组细胞增殖较PHA组快,分析其原因为FPHA组释放氟离子促进了细胞增殖。两组细胞接种7 d后OD值比较,差异无统计学意义(P>0.05),考虑是由于压片容纳细胞数量有限,细胞融合达到80%以上后出现细胞增殖抑制。回顾有关氟离子研究的相关文献,大多数学者认为低浓度的氟离子对成骨有促进作用,高浓度的氟抑制成骨[6]。本实验在制备条件中氟浓度为0.25 mol/L,制得材料在细胞黏附实验中被证明有良好的细胞相容性,在细胞增殖实验中此氟浓度可促进细胞增殖。细胞成骨分化相关基因检测中,FPHA组细胞接种3、7 d后ALP、BGLAP mRNA表达水平均高于PHA组,差异有统计学意义(P<0.05)。碱性磷酸酶是一组膜结合蛋白,在碱性环境中可以水解为一系列单磷酸酯,具有转磷酸基的作用。与成骨分化相关的ALP是一种细胞外酶,通过水解有机磷酸酯为细胞外基质矿化过程中磷灰石的沉积提供足够的磷酸根,因此在体外钙化过程中起着决定性的作用,ALP是细胞成骨分化的重要早期标志。骨钙素是一种由成骨细胞产生的非胶原蛋白激素[7],因此常被用作骨形成过程的标志物。在许多研究中,BGLAP被用作判断给定药物促进骨形成能力的生物标志物[8]。本研究实验结果提示氟植入材料能促进表面细胞的早期成骨分化。
综上所述,PHA与FPHA均具有良好的细胞相容性,MC3T3-E1能在两种材料表面黏附生长。氟离子植入猪骨羟基磷灰石可促进MC3T3-E1细胞的增殖与早期成骨分化。
参考文献
[1] Szcze? A,Ho?ysz L,Chibowski E.Synthesis of hydroxyapatite for biomedical applications[J].Adv Colloid Interface Sci,2017,249:321-330.
[2] Shang S,Zhao Q,Zhang D,et al.Molecular dynamics simulation of the adsorption behavior of two different drugs on hydroxyapatite and Zn-doped hydroxyapatite[J].Mater Sci Eng C Mater Biol Appl,2019,105:110017.
[3] Wang JF, Zhou HZ, Tang GH, et al. Reducing the inhibitive effect of fluorine and heavy metals on nitrate reduction by hydroxyapatite substrate in constructed wetlands[J].J Hazard Mater,2023,446:130692.
[4] Zhang J,Shishatskaya EI,Volova TG,et al.Polyhydroxyalkanoates (PHA) for therapeutic applications[J].Mater Sci Eng C Mater Biol Appl,2018,86:144-150.
[5] Li T,Hao L,Li J,et al.Insight into vitronectin structural evolution on material surface chemistries: The mediation for cell adhesion[J].Bioact Mater,2020,5(4):1044-1052.
[6] Lin Z,Cao Y,Zou J,et al.Improved osteogenesis and angiogenesis of a novel copper ions doped calcium phosphate cement[J].Mater Sci Eng C Mater Biol Appl,2020,114:111032.
[7] Sun D,Xu W,Liang C,et al.Smart Surface-Enhanced Resonance Raman Scattering Nanoprobe for Monitoring Cellular Alkaline Phosphatase Activity during Osteogenic Differentiation[J].ACS Sens,2020,5(6):1758-1767.
[8] Lin X,Hunziker EB,Liu T,et al.Enhanced biocompatibility and improved osteogenesis of coralline hydroxyapatite modified by bone morphogenetic protein 2 incorporated into a biomimetic coating[J].Mater Sci Eng C Mater Biol Appl,2019,96:329-336.
編辑 胡锦英
