利用药物重定位策略挖掘胃癌治疗药物
2023-10-14荀德旭冯舒琪侯思宇卢雨青陈佳佳
齐 鑫,荀德旭,冯舒琪,高 娜,侯思宇,卢雨青,黄 兰,陈佳佳
(苏州科技大学化学与生命科学学院 江苏 苏州 215011)
胃癌是起源于胃黏膜上皮细胞的恶性肿瘤,流行病学调查显示,在全球范围内其发病率位列第5,死亡率位列第4,对患者的身体健康和生命安全带来严重的威胁[1]。胃癌患者常出现胃灼热、反酸和其他常见慢性肠胃道疾病相似症状,在早期难以察觉。尽管近年来胃癌的研究和治疗手段取得了重要的进展,但是胃癌的致病机制尚未十分明确,晚期患者的5 年总体生存率低,对胃癌患者进行有效的治疗仍面临着严峻的挑战[2]。因此,研发新的药物有助于优化胃癌的治疗方案。
近年来,随着高通量测序技术的快速发展以及生物数据和医学数据的飞跃式增长,药物重定位已逐渐成为一种发现现有药物新适应症的高效策略,可以加快新药研发的进程。其中基于计算的药物重定位方法通过系统识别潜在的药物-靶点和药物-疾病之间的相互作用,可大大降低传统药物研发的成本、周期和风险[3]。关联图谱(connectivity map,CMap)数据库存储了不同浓度和时间点对癌症细胞系进行小分子药物处理后获得的基因表达谱数据,为探索由小分子化合物引发的基因表达变化特征,揭示小分子化合物、基因以及疾病状态之间的联系提供了重要的研究平台[4]。目前,基于CMap 的计算药物重定位方法已被生物学家及医药工作者广泛应用于癌症治疗药物的筛选和研发。
本研究利用基于CMap 的药物重定位策略筛选治疗胃癌的小分子化合物并预测其靶点。首先,利用GEO 数据库中胃癌肿瘤组织和正常对照组织的基因表达谱数据,确定与胃癌发生密切相关的差异表达基因,并基于CMap 数据库筛选治疗胃癌的候选药物。然后,利用蛋白质-蛋白质相互作用网络(protein-protein interaction network, PPIN)鉴定关键的枢纽基因,并利用分子对接预测候选药物与枢纽基因的结合能力来预测药物的靶点;进一步,利用生物信息学方法对潜在靶点的表达模式、诊断和预后性能进行分析。
1 材料与方法
1.1 数据集的获取
在NCBI 的GEO 数据库中,下载与胃癌相关的3 组基因表达谱数据集GSE54129、GSE65801和GSE26899。其中,GSE54129 数据集的平台为GPL570,包含111 例胃癌组织样本和21 例正常对照组织样本;GSE65801 数据集的平台为GPL14550,包含32 例胃癌组织样本和32 例配对的正常对照组织样本;GSE26899 数据集的平台为GPL6947,包含96 例胃癌组织样本和12 例正常对照组织样本。
1.2 差异表达基因的鉴定
使用“Limma”R 包鉴定在胃癌组织和正常对照组织样本之间显著差异表达的基因[5],鉴定标准为|log2(fold change)|≥1 且校正后的P<0.05。进一步,通过对差异表达基因(differentially expressed genes, DEGs)绘制韦恩图,筛选在上述3 个数据集中均上调表达或下调表达的基因。
1.3 GO 功能富集分析和KEGG 通路富集分析
利 用“clusterProfiler”R 包[6],对 在3 个 数 据集中重叠的差异表达基因分别进行基因本体论(gene ontology, GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)通路富集分析,探究差异表达基因显著富集的条目(校正后的P值小于0.05)。
1.4 利用CMap 数据库预测治疗胃癌的候选小分子药物
将在GSE54129、GSE65801 和GSE26899 这3个数据集中均显著上调的基因和均显著下调基因上传到CMap 数据库中的“Query”模块进行分析[7]。结果文件中,连通度分数(connectivity score)表示胃癌相关基因的表达特征与CMap 中收录的小分子化合物之间的相关性。连通度分数越接近-100,表示药物的治疗潜力越大。本研究选择连通度分数小于-80 作为筛选治疗胃癌候选小分子化合物的阈值。
1.5 蛋白质相互作用分析
利用STRING 数据库对3 个数据集中重叠差异表达基因之间的相互作用关系进行分析,置信分数(confidence score)代表蛋白质相互作用的强弱[8]。本研究以置信分数大于0.400 为阈值筛选可靠的蛋白质相互作用关系,并构建PPIN。进一步,使用Cytoscape 软件(3.6.1 版本)[9]进行PPIN 的可视化和拓扑性质分析,鉴定连接度(degree)值排名前10%的结点为网络中的枢纽结点。
1.6 候选药物分子和潜在靶点的分子对接
为了探究候选药物的作用靶点,利用AutoDock 软件(4.2.6 版本)[10]对PPIN 中枢纽基因编码的蛋白质与候选药物进行分子对接。具体地,在PDB 数据库(https://www.rcsb.org/)[11]中分别检索和下载PPIN 中枢纽基因编码蛋白质的三维结构文件,同时在PubChem 数据库[12]中搜索和下载候选药物的三维结构文件。进一步,在对蛋白质和药物配体结构进行预处理之后,利用AutoDock 软件对候选药物和蛋白质进行分子对接,每一个蛋白质与相应药物要进行50 次对接,选出结合能最低的对接结果。当结合能小于-5.0 kcal/mol 时,表明配体和受体具有较好的结合活性。使用Pymol 软件对亲和力最佳的对接结果进行可视化和分析[13]。
1.7 生存分析
为了探究潜在药物靶点的预后价值,对其与胃癌患者生存时间的相关性进行分析。具体地,使用在线工具Kaplan-Meier plotter[14],分析靶点基因高表达组和低表达组之间生存时间(包括总体生存期和无进展生存期)是否存在显著的差异。统计学上,使用对数秩检验(P<0.05)来评估两组间生存时间差异的显著性。
2 结果与分析
2.1 鉴定与胃癌发生密切相关的差异表达基因
使用“Limma”R 软件包分别对3 个数据集GSE54129、GSE26899 和GSE65801 中肿瘤组织和正常对照组织样本间差异表达的基因进行鉴定。结果显示,以|log2(fold change)|≥1 和校正后的P<0.05 为筛选标准,在GSE54129、GSE26899 和GSE65801数据集中分别鉴定了2 533、521 和2 403 个差异表达基因(图1a~图1c)。值得注意的是,76 个上调基因和127 个下调基因在3 个数据集中均显著差异表达(图1d~图1e),表明这些基因在胃癌致病过程中可能发挥着重要的作用。
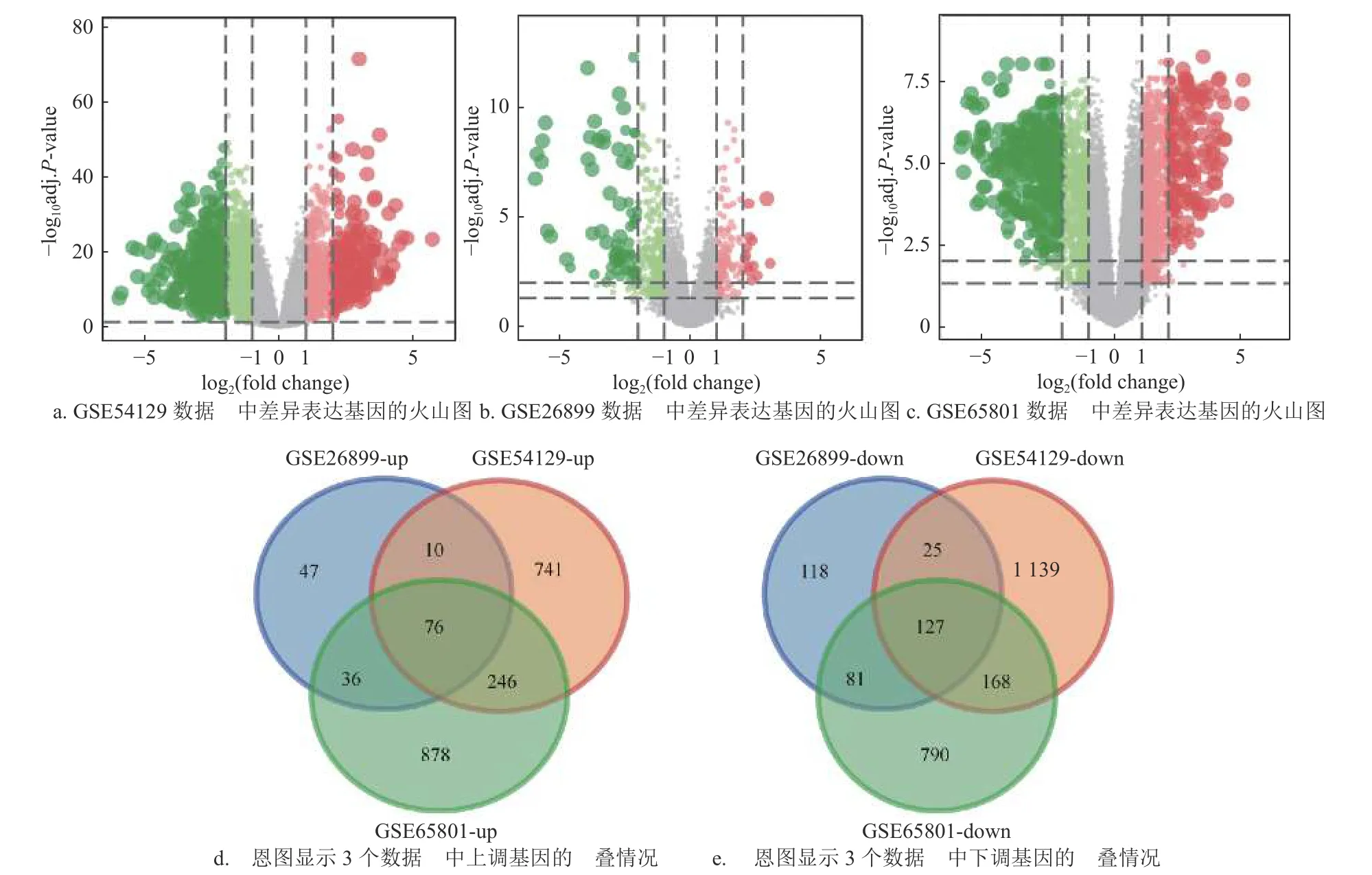
图1 差异表达基因的鉴定
2.2 差异表达基因的功能注释
为了进一步研究上述3 个胃癌数据集中重叠差异表达基因的功能,使用“clusterProfiler”R 包分别进行了GO 功能富集分析和KEGG 代谢通路富集分析。如图2a 所示,重叠的差异表达基因在细胞外基质组织(extracellular matrix organization)、组织稳态(tissue homeostasis)和激素代谢过程(hormone metabolic process)等生物过程条目显著富集,在含胶原蛋白的胞外基质(collagen-containing extracellular matrix)和内质网腔(endoplasmic reticulum lumen)等细胞组分条目显著富集,在细胞外基质结构成分(extracellular matrix structural constituent)、氧化还原酶活性(oxidoreductase activity)等分子功能条目显著富集。KEGG 结果也显示重叠的差异表达基因在蛋白质的消化吸收(Protein digestion and absorption)、药物代谢-细胞色素P450 通路(Drug metabolismcytochrome P450)和细胞外基质-受体相互作用(ECM-receptor interaction)等与胃癌的发生和发展密切相关的代谢通路显著富集,如图2b 所示。

图2 差异表达基因的GO 功能富集分析和KEGG 代谢通路富集分析
2.3 候选小分子药物的筛选
为了探索治疗胃癌的候选小分子药物,本研究采用CMap 在线分析工具对胃癌相关基因表达特征与小分子药物之间的联系进行了分析。具体地,通过将重叠的76 个上调基因和127 个下调基因上传到CMap 数据库,以连接分数<-80 分为标准,鉴定了10 种治疗胃癌的候选药物,如表1 所示。
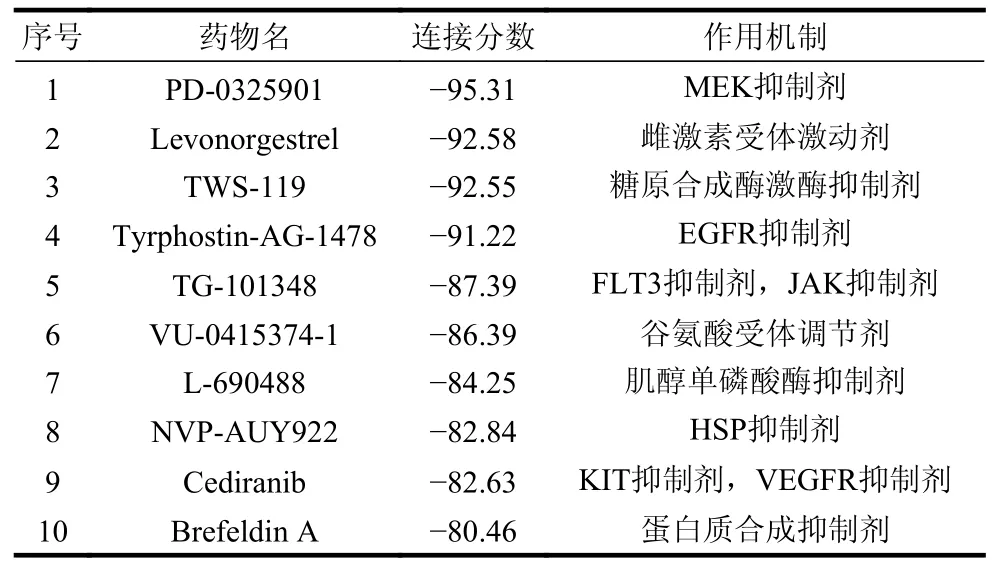
表1 利用CMap 数据库鉴定的治疗胃癌的候选小分子化合物
其中,PD-0325901、菲达替尼(fedratinib,TG-101348)、NVP-AUY922、西地尼布和布雷非德菌素A(brefeldin A)为已报道的具有胃癌治疗价值的小分子药物,表明本实验的结果具有可靠性。另外,左炔诺孕酮、TWS-119、Tyrphostin-AG-1478、VU-0415374-1 和L-690488 为本研究新发现的治疗胃癌的候选小分子化合物。
2.4 PPIN 的构建与枢纽基因的鉴定
蛋白质间的相互作用是细胞内蛋白质执行生命功能的重要方式,在包括癌症发生发展等多种生命活动中发挥着至关重要的作用。本研究利用STRING 数据库,对在上述3 个数据集中鉴定的203 个差异表达基因进行相互作用分析,构建了由152 个节点和480 条边组成的PPIN,如图3a 所示。鉴于PPIN 中枢纽基因具有成为药物靶点的潜力,利用Cytoscape 软件对构建的PPI 网络进行可视化和拓扑性质分析,以度(degree)值排名前10%为筛选标准,鉴定了16 个枢纽基因,如图3b所示。其中,TIMP1 为基质金属蛋白酶组织抑制剂(tissue inhibitor of matrix metalloproteinase, TIMP)家族重要的成员之一,在抑制基质金属蛋白酶和细胞信号通路(如细胞死亡、增殖和血管生成)等方面具有重要作用[15];PDGFRB 是血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR),在抑制血管生成和肿瘤细胞增殖过程中起关键作用[16]。而且,TIMP1 和PDGFR 均可作为胃癌预后生物标志物[16-17],提示枢纽基因在胃癌发病过程中可能发挥着关键作用。
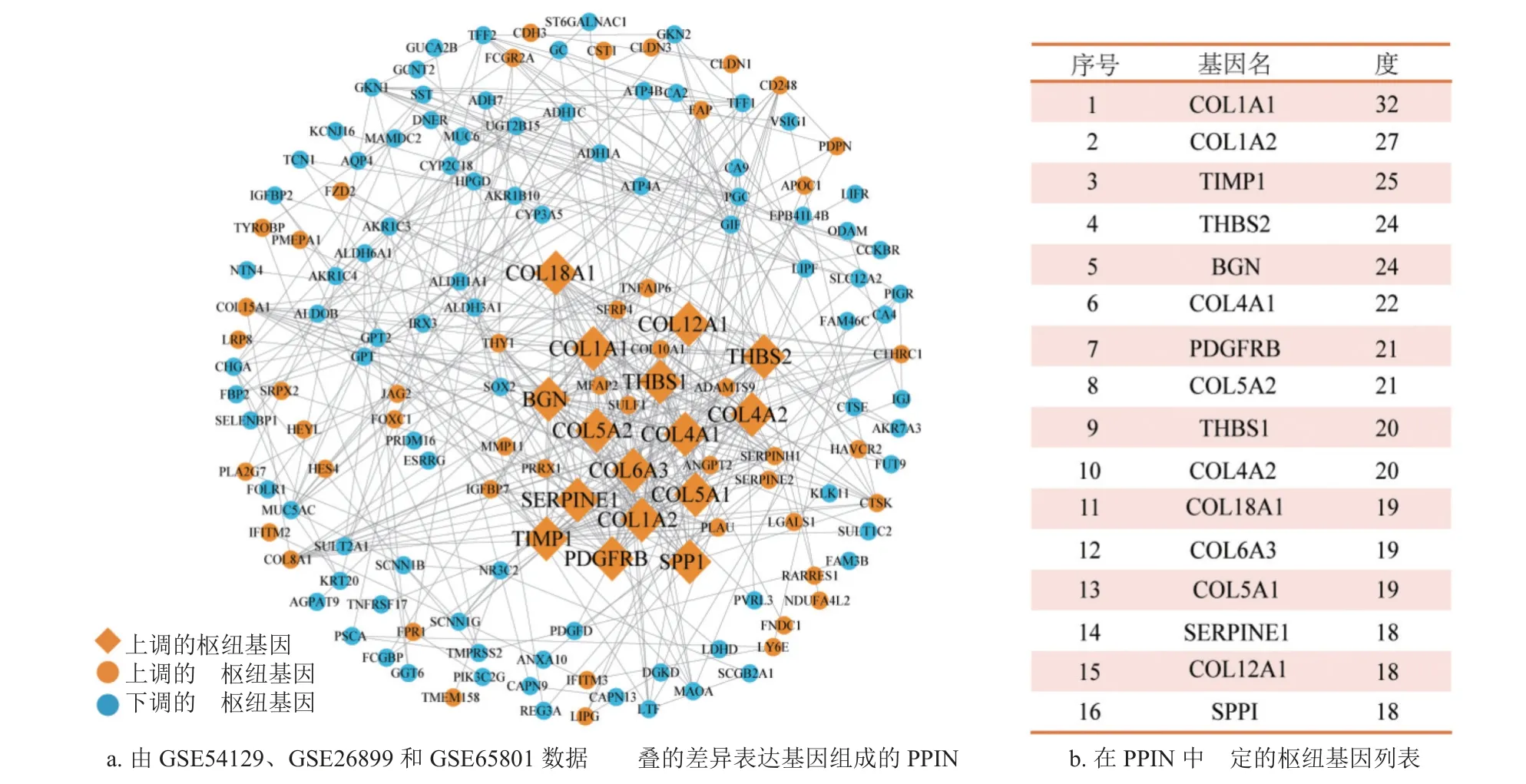
图3 差异表达基因的PPIN 分析
2.5 胃癌候选小分子药物潜在靶点的预测
为了预测胃癌候选小分子药物的靶点,本研究利用Autodock 软件对PPIN 中枢纽基因编码蛋白质与基于CMap 数据库鉴定的候选药物进行了分子对接分析。结果显示,左炔诺孕酮和西地尼布可分别与TIMP1 和PDGFRB 结合。具体地,西地尼布可与PDGFRB 蛋白的口袋结合,结合位点分别为第63 位和第112 位谷氨酸(GLU),结合能为-6.28 kcal/mol,如图4a 所示,这与文献[18]报道的西地尼布能够结合PDGFR 家族成员相符合;左炔诺孕酮与TIMP1 第100 位的丝氨酸(SER)、第102 位的缬氨酸(VAL)、第112 位的谷氨酰胺(GLN)和第162 位的精氨酸(ARG)作用,结合能为-9.24 kcal/mol,如图4b 所示。因此,本研究新鉴定的胃癌候选药物左炔诺孕酮可能通过结合TIMP1 的口袋,达到治疗胃癌的效果。

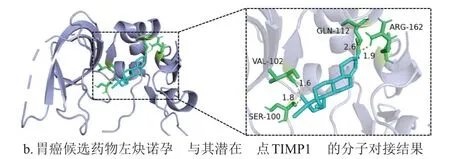
图4 鉴定的胃癌候选药物与其潜在靶点的分子对接
2.6 胃癌候选药物潜在靶点的功能研究
首先,为了验证候选药物潜在靶点基因在肿瘤组织和正常对照组织中的表达模式,通过箱线图展示了TIMP1 和PDGFRB 在GSE54129、GSE26899和GSE65801 这3 个数据集中的表达模式,并利用GEPIA2 在线分析工具[19]对药物潜在靶点TIMP1和PDGFRB 在TCGA 数据库中的表达水平进行了分析。如图5a~5b 所示,靶点基因TIMP1 和PDGFRB 在胃癌肿瘤组织中的表达水平均显著上调(P<0.05)。然后,通过ROC 曲线分析评估TIMP1 和PDGFRB 来区分胃癌患者和正常对照的敏感性和特异性,AUC 值越高则代表区分能力越强。如图5c 所示,在GSE54129、GSE26899 和GSE65801 数据集中,TIMP1 的AUC 值在0.960~0.994 之间,基因PDGFRB 的AUC 值在0.786~0.974 之间,表明TIMP1 和PDGFRB 对胃癌具有较好的诊断效果。进一步,利用Kaplan-Meier Plotter 工具进行生存分析来研究TIMP1 和PDGFRB分别与胃癌患者总体生存时间的相关性。结果显示,与TIMP1 低表达组相比,TIMP1 高表达组患者的总体生存率显著降低(P<0.05);类似地,PDGFRB 高表达组患者的总体生存率也显著低于PDGFRB 低表达组患者的总体生存率(P<0.05),如图5d 所示,表明靶点基因TIMP1 和PDGFRB 的表达水平与胃癌患者的预后生存时间密切相关。
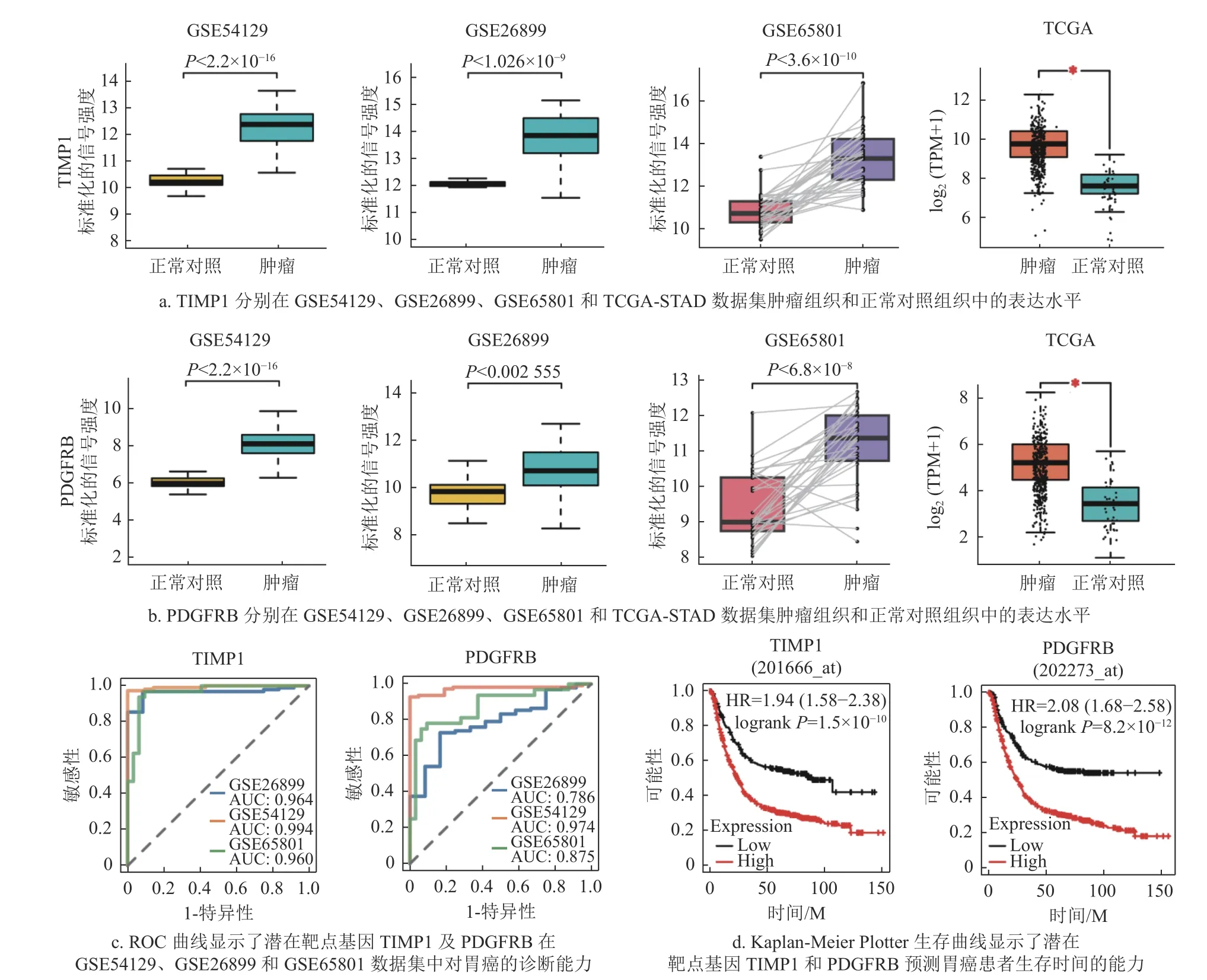
图5 潜在靶点基因的表达模式和功能分析
3 结 束 语
胃癌是世界范围内最常见的癌症类型之一,大多数患者到医院检查就诊时已发展到中晚期,手术治疗效果不佳,现有药物的治疗效果有限,因此,迫切需要研发具有更好疗效的靶向药物,提高胃癌的临床治疗效果。
本研究基于胃癌的基因表达谱数据,采用CMap 的药物重定位方法,鉴定了10 种治疗胃癌的候选小分子化合物。其中,PD-0325901、菲达替尼、NVP-AUY922、西地尼布和布雷非德菌素A 为已报道的具有胃癌治疗潜力的小分子化合物。如PD-0325901 作为MEK 抑制剂能够抑制胃癌细胞的生长[20];西地尼布为KIT 和VEGFR 抑制剂,具有抗血管生成的作用,文献[21]对西地尼布联合顺铂和氟嘧啶治疗日本初治晚期胃癌患者进行了临床I 期研究,发现20 毫克/天西地尼布联合顺铂和氟嘧啶是可以耐受的,具有抗肿瘤的活性。此外,左炔诺孕酮、TWS-119、tyrphostin-AG-1478、VU-0415374-1 和L-690488 为本研究新发现的治疗胃癌的候选小分子化合物,值得深入研究。
近年来,越来越多的研究表明,PPIN 是探究癌症致病机制和预测候选药物靶标的重要工具。通过鉴定PPIN 中的枢纽节点并将其分别与上述筛选得到的小分子药物进行分子对接,发现小分子药物西地尼布可与PDGFRB 结合,结合能为-6.28 kcal/mol,这与文献[18]报道的西地尼布能够结合PDGFR 家族成员的结果是一致的。另外,分子对接结果也显示,左炔诺孕酮可与TIMP1 的口袋结合,结合能为-9.24 kcal/mol。但是左炔诺孕酮对胃癌的治疗作用尚未报道,为本研究的新发现。
左炔诺孕酮是一种口服避孕药,主要通过抑制排卵、改变子宫内膜和宫颈黏液,达到避孕的效果。近年来,越来越多的研究表明,左炔诺孕酮或左炔诺孕酮宫内节育系统(levonorgestrel intrauterine system,LNG-IUS)还具有抗癌作用,尤其对于子宫内膜癌治疗有一定的疗效,但是它们对癌症的影响仍存在争议。如左炔诺孕酮宫内节育系统可通过降低异位子宫内膜中腺体和间质雌激素受体α(estrogen receptor α, ERα)、ERβ 和 孕 激 素 受 体(progesterone receptor, PR)的表达,改善轻度至中度子宫内膜异位症女性的症状[22]。文献[23]发现左炔诺孕酮宫内节育系统能够影响宫腺肌症患者子宫内膜中类固醇受体共调节因子的表达水平。文献[24]的研究结果显示,左炔诺孕酮能够通过雄激素受体抑制人子宫内膜内皮细胞中组织纤溶酶原激活物的分泌。另外,文献[25]的研究结果显示,孕酮宫内节育系统与低于预期的子宫内膜癌、卵巢癌、胰腺癌和肺癌发病率相关,但与高于预期的乳腺癌发病率相关[25]。需要注意的是,左炔诺孕酮作为一种激素类的药物,其对于男性患者和女性患者的治疗效果可能存在较大的差异。另外,长期使用左炔诺孕酮可能会产生抗癌和促癌的效应。一方面,左炔诺孕酮可在一定程度上降低子宫内膜癌等癌症的发生风险;另一方面,长期使用左炔诺孕酮可能会增加患乳腺癌的风险[26]。因此,在使用左炔诺孕酮时,需要注意其副作用和风险,并根据个体情况选择合适的用药方案。
综上,本研究利用基于CMap 数据库的药物重定位方法鉴定了10 种治疗胃癌的候选药物,其中小分子化合物左炔诺孕酮可与PPIN 中的枢纽节点TIMP1 结合,且结合能低于已报道的药物西地尼布与其靶点PDGFRB 的结合能,提示左炔诺孕酮可作为新型小分子药物来治疗胃癌,但具体的作用机制还需通过实验进一步验证。
