儿童先天性门体分流的影像学表现
2023-10-13姚琼谢婵来龚英阳朝霞乔中伟
姚琼 谢婵来 龚英 阳朝霞 乔中伟
(国家儿童医学中心/复旦大学附属儿科医院放射科 上海 201102)
门体分流(portosystemic shunt,PSS)指门静脉和体静脉之间发生先天性异常沟通,导致门静脉血流全部或部分直接引流入体静脉。其分类方法很多,最常用的分型为肝外型和肝内型[1-2]。肝外型又称为Abernethy畸形,分为:Ⅰ型,即肝内门静脉缺如,全部门静脉血汇入体静脉,进一步分为Ⅰa型(脾静脉和肠系膜上静脉分别引流至体静脉)及Ⅰb型(脾静脉和肠系膜上静脉形成共干引流至体静脉);Ⅱ型,肝内门静脉发育不良,部分门静脉血通过引流静脉汇入体静脉。肝内型是指肝内门静脉与肝静脉或下腔静脉之间存在异常连接,可分为:Ⅰ型,门静脉右支与下腔静脉形成分流;Ⅱ型,一个肝段的门静脉分支与肝静脉之间有单个或多个分流;Ⅲ型,门静脉分支与肝静脉的分流血管瘤样扩张;Ⅳ型,分布在多个肝段的门静脉、肝静脉交通分流。
先天性门体分流是一种少见的门静脉畸形,往往合并全身多系统的并发症及畸形,国内外报道较少。目前仅有一些小样本量的病例分析,对门静脉及其属支的形态、门体分流血管走形、侧枝血管分布描述及对CT血管造影(computed tomography angiography,CTA)和磁共振血管造影(magnetic resonance angiography,MRA)的诊断价值的讨论较少。本文收集复旦大学附属儿科医院经CTA/MRA确诊的先天性PSS患儿,分析其门脉系统影像学特征及并发病变,比较不同影像学检查的优缺点。
资料和方法
研究对象复旦大学附属儿科医院2008年3月—2022年12月间经CTA/MRA共确诊先天性PSS患儿26例,采集性别、年龄、临床表现、影像学检查[超声、CTA、MRA、数字减影血管造影(digital subtraction angiography,DSA)]、治疗方式和预后等信息。所有患儿均通过产前筛查超声或产后腹部超声提示存在PSS,后进入我院完善检查。本研究得到复旦大学附属儿科医院伦理委员会批准(复儿伦审2022326号),所有患儿家属均签署知情同意书或口头告知知情同意。
CTA检查技术采用Light speed 64排螺旋CT扫描仪(美国通用电气公司)。检查范围从肝顶至盆腔,行CT平扫和增强扫描,扫描参数:管电压80~100 kV,管电流40~70 mAs,准直0.625 mm×64,螺距1.375。增强扫描分动脉期、门脉期、平衡期,动脉期延迟时间为注射造影剂后25~30 s,门脉期延迟时间为60~70 s,平衡期延迟时间为100~120 s,根据病灶的性质可增加延迟期。对比剂为碘海醇注射液[300 mgI/mL,通用电气药业(上海)有限公司],剂量1.5~2 mL/kg,流速0.8~2.0 mL/s。对于<5岁不合作患儿给予0.5 mL/kg水合氯醛口服或灌肠镇静。
MRA检查技术采用Siemens Avanto 1.5T扫描仪(德国西门子公司),使用体线圈,3D FLASH序列,自由呼吸状态下多期扫描,获得动脉期、门静脉期及静脉期图像。扫描范围从肝顶至盆腔,扫描野262 mm×400 mm,扫描参数:TR/TE 3.14/1.29 ms,翻转角25°,带宽450 Hz/pixel,矩阵227×384,层厚1.5 mm,单期采集时间15 s。对比剂为钆双胺注射液0.5 mmol/mL[通用电气药业(上海)有限公司],剂量0.1 mmol/kg。对于<5岁不合作患儿给予0.5 mL/kg水合氯醛口服或灌肠镇静。
图像分析及后处理提取CTA及MRA原始图像,CTA薄层图像0.625 mm,MRA层厚1.5 mm,传入后处理工作站重建。重建方式包括:最大密度投影、多平面重建、表面投影。由2名放射科医师独立读片,观察门静脉及其属支的形态及走行、门体分流血管位置、途径、回流血管、侧枝血管分布及其他脏器合并病变。对于诊断有差异的病例由2名医师进行共同读片,获得统一结论。
结 果
临床资料26例中男19例,女7例;检查年龄1个月~10岁,其中<1岁15例,1~5岁8例,6~10岁2例,>10岁1例。合并畸形主要包括先天性心脏病、多种消化道畸形、胆管系统畸形、肾脏畸形、脊柱畸形等。6例患儿肝功能不全,表现为黄疸或实验室肝功能指标异常,另有4例发现肝脏富血供占位。肝外型患儿中,6例便血,3例呕血,1例发生肝性脑病;截至出院时,4例行结直肠切除术,1例胃底静脉断流术,2例接受肠系膜下静脉手术结扎,3例行门体分流堵闭术,其中1例堵闭术后死亡。
CTA及MRA影像学表现26例患儿均行CTA检查,2例同期行MRA。CTA检查诊断16例为肝外型PSS(Ⅰb型4例,Ⅱ型12例)。4例Ⅰb型患儿肝内门脉分支均未显影,门脉主干1例扩张,3例未显影,其中2例经DSA检查发现存在肝内发育不良门脉血管,修改诊断为肝外Ⅱ型;12例Ⅱ型患儿中,肝内门脉分支6例明显纤细、2例部分显示、4例形态尚可,门脉主干5例正常、7例狭窄。12例患儿引流静脉由肠系膜上静脉及脾静脉汇合形成,4例引流静脉发自脾静脉中段。回流静脉包括:下腔静脉2例、左肾静脉5例、髂内静脉6例、胃冠状静脉3例;其中回流入下腔静脉及左肾静脉的引流血管较粗短(图1A、1B);回流入髂内静脉(单侧3例,双侧3例)的引流血管均明显迂曲扩张,CTA可见直肠静脉丛曲张,直肠壁增厚、强化明显,临床均出现血便(图1C);3例患儿回流入胃冠状静脉,临床均出现呕血,检查显示食管、胃底静脉曲张。2例肝外Ⅱ型患儿同期行MRA检查,检查结果与CTA一致,脾静脉、肠系膜上静脉、引流静脉等大血管显示清晰,但肝内门脉细小分支显示较差。
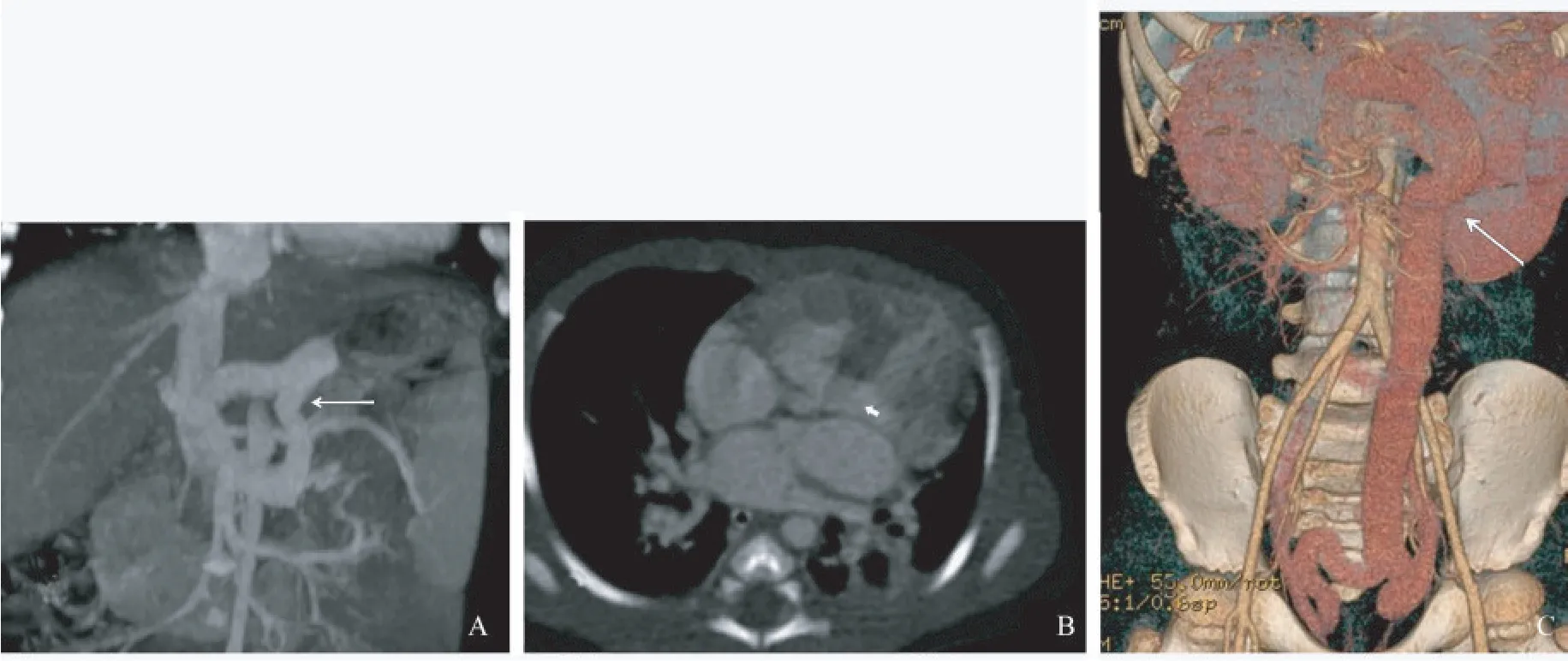
图1 肝外型门体分流CT图像Fig 1 Extrahepatic portosystemic shunt (PSS) CT images
肝内型PSS共10例(Ⅰ型5例,Ⅱ型2例,Ⅲ型2例,Ⅳ型1例)。Ⅰ型病例均为门脉右支与下腔静脉形成分流,分流血管较粗短,位于肝门区;Ⅱ型均发生于门脉左支,2例均连接到肝左静脉;Ⅲ型分流血管均起自门脉左支,呈瘤样扩张,1例连接到肝左静脉,1例连接肝右静脉;Ⅳ型为门脉左、右支与肝左、右静脉形成多发分流(图2)。所有患儿门静脉主干及肝内分支均发育可,受累门脉分支及回流血管可见扩张,Ⅱ、Ⅲ、Ⅳ型分流血管较迂曲,部分肝静脉提前显影。
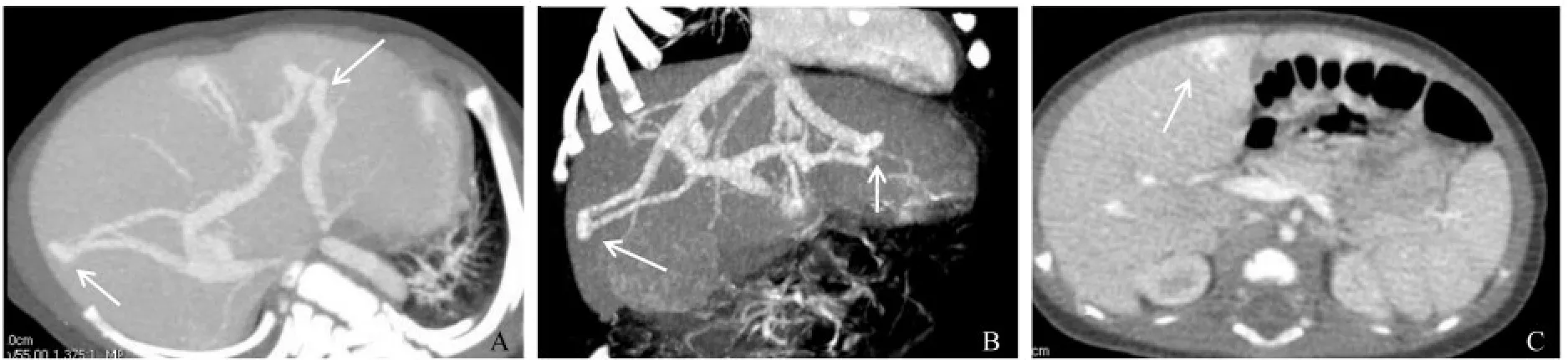
图2 1个月女婴肝内Ⅳ型门体分流影像Fig 2 Images of a 1-month-old baby girl with intrahepatic type Ⅳ PSS
CTA/MRA与超声比较共13例患儿同期行超声检查,4例超声漏诊,2例肝内型PSS超声误诊为肝脏富血供占位,6例超声提示存在门体分流,但不能具体分型及完整显示引流血管行径。
CTA/MRA与DSA结果比较CTA提示的4例肝外Ⅰb患者均同期行DSA检查,其中2例DSA造影可见纤细的门静脉分支,修改分型为Ⅱ型。3例肝外Ⅱ型行PSS堵闭术,所见门脉形态、分流血管走形与CTA基本符合。
随访及预后共9例患儿出院后继续门脉CTA及超声随访,随访时间为1~31个月。其中2例肝外Ⅰb型及3例肝外Ⅱ型患儿门脉及分流静脉形态同前;1例肝外Ⅱ型患儿食管胃底静脉曲张加重;1例肝外Ⅱ型患儿行血管结扎术后1个月,复查CTA可见纤细的门脉主干及左右分支,较术前略增粗;1例肝内Ⅳ型患儿第2次入院行DSA堵闭术,分别堵塞肝左、右静脉与门脉左、右支远端两处瘘口,后门诊随访CTA发现门脉扩张明显改善;1例肝内Ⅲ型随访31个月后分流血管明显变细,门脉左支扩张较前改善。
讨 论
门静脉系统的发育过程复杂,在胚胎第4~10周,卵黄静脉血管网选择性退化并发育为门静脉,如在这个过程中发生退化过度或退化不全则可导致先天性门体分流[1-3]。肝外型PSS发生时间较早,在肝内门脉分支形成之前;肝内型则发生在肝内门脉分支形成之后[4-5]。这也解释了为何肝内型门脉系统血管发育比较好。本组病例中肝内型占38%,其中Ⅰ型最为多见,肝内型门静脉及肝内属支发育较肝外型好。本组病例中肝外型(占62%)较肝内型多见。文献报道回流静脉以下腔静脉多见,但也可以是肾静脉、髂静脉、胃底静脉,奇静脉或右心房[2]。本组患儿以髂静脉最多,可能因该型患儿消化道出血症状明显而能早期明确诊断。
先天性PSS临床症状多种多样,主要包括多种先天畸形、肝脏血供异常以及异常分流血管引起的症状三大类;先天性PSS合并的畸形众多,可累及多个系统[6]。本组畸形以先天性心脏病最为多见,可能是由于心脏、腹部血管系统存在共同的疾病发生机制,或胎内心脏对分流后血流动力改变发生的适应性变化。先天性PSS导致肝脏血供减少会引起一系列肝脏疾病,包括肝功能不全、脂肪浸润、肝叶萎缩,并继发肝脏占位,包括再生结节、局灶结节性增生及肝癌、肝母细胞瘤,以再生结节为主[7]。有文献报道肝外型PSS并发肝脏占位发病率约50%[8]。本研究患儿发病率偏低,仅发现4例富血供占位,可能因为本组患儿年龄偏小。最为严重的并发症为肝性脑病,门脉血未经肝脏解毒直接进入体静脉会导致肝性脑病的发生,其发生与分流量大小及持续时间相关,发生率约15%,分流率高于30%则风险较高[9]。本组病例中仅1例肝外型患儿发生肝性脑病,此症状在儿童中虽然少见,但后果严重,应予以警惕。
消化道出血为PSS少见合并症,国内外报道均很少[10]。本组病例发现消化道出血比例较高,占34.6%,都出现于肝外型患儿中;6例便血、3例呕血,均发现回流静脉附近静脉丛曲张,这些静脉丛血管的扩张、破裂可能是引起消化道出血的原因。而引流至下腔静脉、肾静脉的肝外型PSS及各型肝内型PSS均无消化道出血症状。临床上多种疾病可引起消化道出血,因此对于消化道出血患儿应仔细查明原因。本组病例中1例便血患儿外院误诊为痔疮并进行手术治疗,术后症状无明显改善,至我院行腹部CTA后明确为肝外型门体分流,后行分流血管结扎治疗,术后症状改善明显。
对于先天性PSS患者,早期发现、准确诊断并及时治疗对疾病预后至关重要。超声具有简易、无创、无电离辐射等优点,结合彩色多普勒超声对异常血管显示较敏感,可作为先天性PSS的首选筛查方式,但易发生漏诊、误诊[11]。本组病例中2例患儿B超误诊为肝内富血供占位,行CTA后诊断为先天性肝内型PSS。本组2例MRA图像基本满足诊断,对于脾静脉、肠系膜上静脉、引流静脉等大血管显示清晰,但对门脉细小分支显示率较CTA差,但MRA无电离辐射是其最大的优势,更适合长期随访[1,12]。根据本组病例的研究,我们发现CTA图像清晰度、分辨率高于MRA,尤其是对于发育不良的门脉显示效果更好,虽然CTA相对MRA存在高辐射剂量、造影剂过敏等不良因素,我们仍建议选择CTA作为首要检查方法而非MRA[13-14]。CTA可以清晰直观地显示分流血管及迂张静脉丛分布。但本研究也发现了CTA的局限性,本组所有经CTA诊断为肝外Ⅰb型的患儿均行DSA检查,DSA证实其中2例肝内存在发育不良门脉,而CTA因血管过于细小无法显示导致误诊,后修改分型为肝外Ⅱ型。因此CTA诊断肝外Ⅰ型需谨慎,应行DSA后方可明确诊断,DSA对于CTA提示肝外Ⅰ型患儿仍是金标准,不能被CTA替代[13-14]。DSA还可进行门脉测压、选择性分流血管栓塞及肝穿刺活检,但因有创、价格贵等因素不能作为常规方法[4,6]。
如前所述,先天性PSS有多种分型,尽管各型临床表现部分相似,但其治疗方法不同,明确分流类型对于疾病治疗规划和预后非常重要。对于肝外Ⅰ型患者,结扎或堵闭分流血管不可随意进行,因为分流血管是肠系膜上静脉、脾静脉唯一引流途径,肝移植是其唯一治疗方法,通常在患者出现肝功能不全、肝性脑病或分流率大于60%后进行[15-16]。但也有研究表明门静脉分支在堵闭分流后可以进一步再生重建,提示肝移植不再是该型唯一治疗方法[17]。分流血管堵闭或手术结扎对肝外Ⅱ型以及大于2岁的肝内型患者是一种有效的治疗方法,但在治疗前须对肝内门脉发育情况进行评估,有研究显示,对于门脉压力过高患儿,可分批关闭引流静脉,控制门脉压力小于25 mmHg,促进肝内门脉进一步发育[18]。本组1例肝外Ⅱ型患儿堵闭后因发育不良的门静脉继发门脉高压而死亡。对于小于2岁的肝内型患者建议随访观察,因为有研究发现2岁以内小的肝内PSS有自愈可能[19],本组中1例2月龄大的肝内Ⅲ型患儿,随访2年后异常分流血管基本消失。
综上所述,先天性门体分流临床表现多样,分流解剖结构复杂,影像学检查应明确显示门脉系统、引流静脉形态,为手术或介入治疗提供信息,减少术中及术后并发症发生。CTA/MRA安全无创,对于先天性PSS诊断准确率高,有着巨大的优势及临床应用价值,对于肝外Ⅰ型诊断需谨慎,以DSA结果为金标准。
作者贡献声明姚琼 数据采集、解释和分析,论文撰写。谢婵来 数据采集、解释和分析。龚英 研究构思和设计,论文修改。阳朝霞 病例采集。乔中伟 论文审阅和指导。
利益冲突声明所有作者均声明不存在利益冲突。
