HPV阴性子宫颈胃型腺癌1例并文献复习
2023-10-13张云珠汪清张爱王梅毛亚男王宇华
张云珠 汪清 张爱 王梅 毛亚男 王宇华△
(1上海市浦东新区人民医院妇科 上海 201299; 2复旦大学附属妇产科医院宫颈疾病诊疗中心 上海 200011)
子宫颈胃型腺癌(gastric-type endocervical adenocarcinoma,G-EAC)是一种罕见的黏液性子宫颈腺癌变体,宫颈腺癌(usual-type endocervical adenocarcinomas,UEA)约占宫颈癌的20%~25%,近年来发病率不断上升[1]。在病因学上,G-EAC与HPV感染无关,在形态特征的高分化端有最小偏差腺癌(minimal deviation adenocacinoma,MDA)[2],预后比HPV相关UEA更差。G-EAC有独特的流行病学、病理学和分子遗传学特征,在生物行为学上具有侵袭性,大多数患者发现时已处于晚期,盆腔、腹部和远处转移较多见[3]。G-EAC恶性程度高,易漏诊和误诊,预后差,需引起重视。现将上海市浦东新区人民医院妇科收治的1例G-EAC诊治过程报告如下。
病例资料患者,女,39岁,已婚,1-0-1-1。剖宫产,节育器避孕,因“白带增多2年,下腹胀痛3月余”于2021年10月上旬入院。患者既往月经规则(5/30天),量中等,无痛经史,末次月经:2021年9月26日,近两年自觉白带增多。2021年6月中旬来我院门诊检查(首诊)。妇科检查示:外阴已婚式;阴道畅;宫颈肥大、光滑;宫体大小正常,无压痛;双侧附件区未见明显异常。查宫颈HPV、液基薄层细胞检测(thinprep cytologic test,TCT)结果均未见异常,阴道分泌物常规检测:清洁度Ⅲ度。诊断:阴道炎,给予保妇康栓每晚一粒,阴道用药治疗未进一步检查及治疗。2021年7月下旬因白带增多症状无改善,再次来我院妇科就诊。复查宫颈HPV、TCT、阴道分泌物均显示正常。B超示:内膜厚7 mm,宫颈58 mm,子宫肌层回声欠均匀,宫颈增大,回声不均(图1)。此后患者未来我院复查。2021年10月上旬因取环再次来我院妇科问诊,血常规示Hb为46 g/L,收住入院。自诉近3个月下腹部胀痛,白带明显增多,体重减轻2.5 kg。妇科检查示:外阴已婚式;阴道畅,内见大量淘米水样分泌物;宫颈质硬,桶样增大,直径约4.5 cm,表面光滑,外口见节育环尾丝脱出,宫颈口有烂肉样组织流出,触之易出血;阴道穹隆质地僵硬,表面光滑,未见明显病灶;子宫中位,活动可,有轻微压痛,宫旁未触及明显增厚;双侧附件区未触及明显异常。入院后再次检查TCT和HPV均为阴性。肿瘤学指标:鳞状细胞癌相关抗原0.60 ng/mL,糖类抗原153为18.90 U/mL,糖类抗原199为7.22 U/mL,癌胚抗原CEA为1.7 ng/L,糖类抗原125为43.18 U/mL,人附睾蛋白4为42.2 pmol/L。入院后行阴道镜检查,核磁共振检查示:子宫颈增宽,局限性不均匀DWI信号增高影(约54 mm×63 mm),T1WI信号不均匀减低,T2WI信号不均匀增高,增强后不均匀强化。子宫颈占位,考虑为宫颈恶性肿瘤,盆腔内淋巴结轻度增大(图2)。10月中旬,阴道镜活检病理切片(图3)示:“宫颈4点”慢性宫颈内膜炎,伴部分黏膜上皮输卵管化生及不典型性;“宫颈7点、10点”及“搔刮”宫颈腺癌。免疫组化示:肿瘤细胞Bcl-2(-)、CD10(间质+)、CEA(部分+)、ER(少量腺体+)、P16(-)、P53(局灶野生型+)、Vim(间质+)和Ki67(热点区约50%+)。
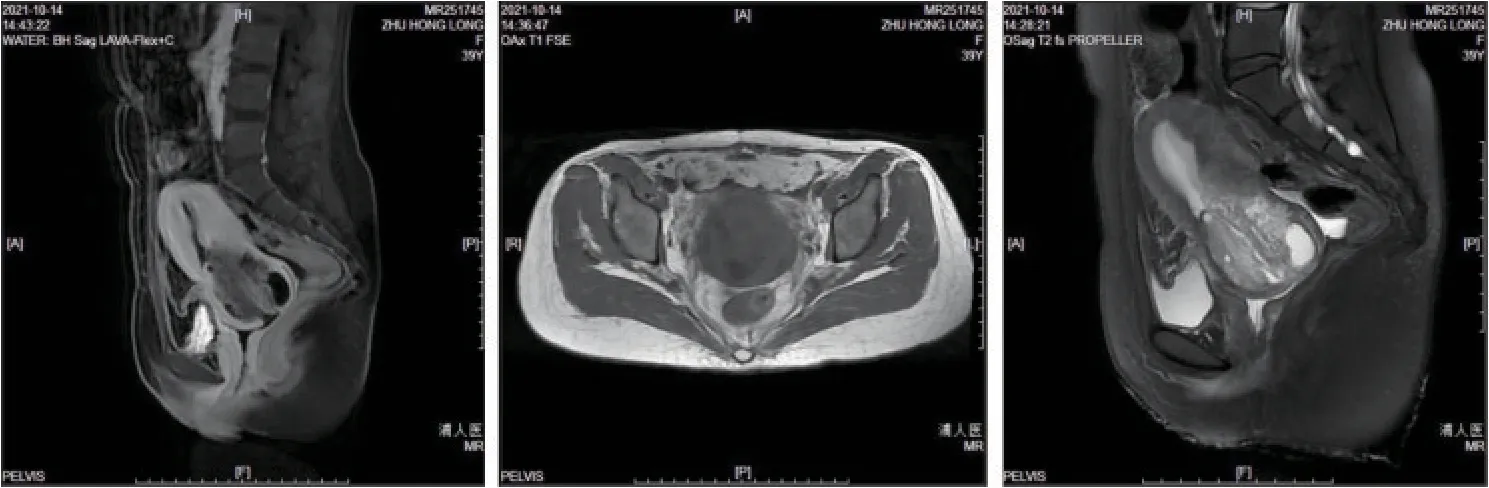
图2 G-EAC患者的核磁共振图像Fig 2 MRI image of the patient with G-EAC
复旦大学附属妇产科医院的病理会诊结果:“宫颈7点、10点”宫颈浸润性腺癌,非HPV相关性胃型,(宫颈管)高分化胃型腺癌。于2021年10月下旬行3D腹腔镜下广泛全子宫切除术+双侧输卵管卵巢切除术+盆腔淋巴结清扫术+腹主动脉旁淋巴结清扫术(肠系膜下动脉水平)+大网膜切除术。术后病理示:(1)宫颈浸润性胃型黏液腺癌,癌灶大小7 cm×6 cm×3.5 cm,浸润宫颈全层达外侧壁,癌灶侵犯神经,广泛脉管内见癌栓;癌灶向上侵犯下段子宫内膜及肌层,向下侵犯阴道壁深纤维间质,阴道壁纤维间质脉管内见癌栓。双侧宫旁组织及阴道壁切缘均未见癌累及2增生期子宫内膜。(2)双侧输卵管未见病变。(3)双侧卵巢未见病变。(4)双侧盆腔和双侧髂总淋巴结共17枚,右侧盆腔7枚中4枚见腺癌转移,左侧盆腔7枚中4枚见腺癌转移,其中1枚伴结外侵犯。(5)腹主动脉旁淋巴结10枚中2枚见腺癌转移。(6)子宫表面病灶平滑肌瘤。(7)大网膜脂肪组织未见癌累及。免疫组化结果示:AE1/AE3/CD31(脉管内见癌栓)、AE1/AE3/D240(脉管内见癌栓)、P16(-)、53(野生表型)、P63(-)、Ki-67(+,60%)、HPV高危型(-)。术后诊断:宫颈胃型腺癌ⅢC2期/T2aN2aM0。术后序贯TC方案化疗及放疗,随访患者一般情况好。
讨论
G-EAC的临床表现 G-EAC早期无明显症状,子宫颈表现为外观肥大,外口光滑或伴有糜烂状,多位于宫颈管中上部,形成“桶状”宫颈,无肉眼可见的外生性病灶,中晚期主要症状是阴道内水样分泌物、黏液分泌物量多,可伴有下腹部疼痛,病程数月至数年。Hirai等[4]报道了6例G-EAC患者都有阴道内黏液分泌物量多。Hino等[5]提出G-EAC患者可能会有阴道内不规则出血及异常水样分泌物排出。G-EAC通常和HPV感染无关,临床表现不同于UEA,而与卵巢癌的症状和体征相近似。GEAC具有高侵袭性,绝大多数患者确诊时已处于晚期,常规化疗效果欠佳,预后较UEA差[3,6-7]。
G-EAC的诊断标准 G-EAC极易误诊,主要是以临床病理学诊断为确诊依据。G-EAC诊断一般采用Kojima等[8]提出的3条形态学标准:(1)具备丰富的黏液性胞质,(2)透明或嗜酸性胞质,(3)胞界清楚。G-EAC与良性肿瘤外观相似,超声及MRI不能明确诊断,一般仅用于评估肿瘤是否转移[9]。病理学是诊断G-EAC的金标准,需进行深部活检或宫颈锥形切除。G-EAC看似良性肿瘤的外观可能造成临床医师对肿瘤浸润程度和病理阶段的错误评估[10]。
G-EAC需要和以下3种情况相鉴别。(1)正常的宫颈:腺体呈分支状,受到炎症等刺激时会出现相应变化,但不会有G-EAC的小叶状结构及胃型分化特征。(2)良性宫颈腺性病变:出现胃型分化的腺体,但不会有核分裂和细胞核异型性,而G-EAC可见明显腺体浸润,侵犯血管和神经,不典型的叶状宫颈内膜腺体增生可能是G-EAC病变先兆;组织学诊断提示病变的形态学梯度:正常宫颈、良性宫颈腺性病变、G-EAC。(3)胃型原位腺癌:无间质浸润。G-EAC表现为高分化黏液性腺癌,因此在组织形态学上与子宫内膜、卵巢或者胃肠道来源的高分化黏液性腺癌相类似[10-11]。
G-EAC胃型MDA的治疗现状 目前尚无针对G-EAC的治疗推荐,但考虑到G-EAC的高侵袭性,不推荐保留生育功能和保留卵巢。最新指南建议G-EAC早期患者选择积极手术治疗,术中全面探查盆腔、腹腔,行广泛性子宫切除术+盆腔淋巴结切除±腹主动脉旁淋巴结切除术,术中建议行双侧输卵管、卵巢、阑尾、大网膜及盆腹腔内转移病变切除术,注意腹膜种植病变的处理。依据术中情况和术后病理选择术后辅助治疗,如有淋巴结阳性、宫旁浸润、切缘阳性等高危因素,则术后补充放化疗;中危因素按照“Sedlis标准”,补充放疗±含铂药物同期化疗;腺癌肿瘤组织学类型也可作为中危因素之一,G-EAC恶性程度高,易远处转移,可放宽术后放化疗指征。鉴于G-EAC与宫颈小细胞神经内分泌癌的生物学行为特征类似,建议参照美国国立综合癌症网络子宫颈癌临床实践指南2021年(第1版)中新增的对子宫颈小细胞神经内分泌癌的治疗推荐:患者无论首选手术还是放疗,都建议补充化疗。对于G-EAC复发患者,化疗的缓解率与UEA相似[36.8%(7/19)vs.32.0%(8/25)];放疗的缓解率低于UEA[50.0%(6/12)vs.81.8%(9/11)][11-14]。
G-EAC的误诊分析 分析G-EAC的误诊原因如下:(1)发病率低,临床医师缺乏判断经验;(2)临床症状不典型,HPV阴性和TCT结果正常,未引起临床医师的重视;(3)临床医师过度依赖辅助检查,而忽略妇科检查。本例接诊医师对于白带异常增多缺乏警觉性,依赖宫颈TCT、HPV检查及B超,而B超对于早期症状的诊断较差,对于治疗后症状无改善也未做进一步分析,未重视宫颈膨大和妇科检查,未行进一步诊疗措施,如盆腔增强MRI检查、阴道镜检查或转诊至上级医院。
综上所述,G-EAC临床罕见,病灶隐匿,症状不典型,首诊妇科医师不能凭细胞学及HPV阴性结果就排除UEA的可能性。当白带量多,常规治疗无效,查体发现宫颈异常增大或B超等影像学检查提示宫颈明显增大,应及时行阴道镜检查、活检或搔刮病理,可提高诊断率。基层医院要加强三级诊疗程序,及时转诊至上级医院。
作者贡献声明张云珠 研究设计,论文撰写和修订,数据采集。汪清,王梅 研究指导。张爱研究设计。毛亚男 论文修订。王宇华 病史收集和修订。
利益冲突声明所有作者均声明不存在利益冲突。
