BMI-1影响全反式维A酸对皮肤鳞状细胞癌敏感性及其作用机制
2023-10-13刘彦婷张欣悦曾维惠马慧群牛新武耿松梅
刘彦婷,张欣悦,曾维惠,马慧群,牛新武,耿松梅
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma, cSCC)是最常见的皮肤恶性肿瘤,具有侵袭性和潜在的生命威胁[1-3]。低风险cSCC可通过局部治疗或手术切除治愈,但不适合切除及高风险cSCC则对治疗提出更高要求[1, 4]。全反式维A酸(all-trans retinoic acid, ATRA)具有调控细胞生长、分化和凋亡的重要作用,在多种肿瘤中抑制其发生和进展[5]。ATRA作为抗肿瘤药物,已成功应用于肿瘤的预防和治疗,包括急性早幼粒细胞白血病(APL)、非小细胞肺癌、乳腺癌和cSCC等[5-6],并在2021年为《中国皮肤鳞状细胞癌诊疗专家共识》推荐用于高风险SCC辅助治疗[7]。但是,临床上ATRA耐药情况常见,cSCC对ATRA治疗抵抗机制尚不明确[6]。
干细胞更新因子BMI-1在肿瘤的形成、浸润及转移过程和肿瘤耐药机制中都有着非常重要的作用[8]。研究表明,沉默BMI-1可显著改善胃癌、骨髓瘤和头颈部鳞癌等肿瘤的化疗敏感性,提高了抗肿瘤效率[8-10]。 BMI-1在cSCC组织和细胞系中的表达显著增加,包括A431 细胞[11]。cSCC中BMI-1高表达是否影响其肿瘤细胞对ATRA治疗的药物敏感性尚不清楚。笔者推测,降低BMI-1表达可能成为增强ATRA敏感性的途径。本研究通过构建BMI-1沉默的A431细胞株,通过细胞增殖能力及小鼠成瘤实验,探讨ATRA在cSCC治疗中药物敏感性的变化及其机制。
1 材料与方法
1.1构建BMI-1基因沉默A431细胞株 A431细胞系购于中国科学院细胞库,采用慢病毒转染的方法分别将无关序列vector和BMI-1干扰序列shBMI-1(上海吉凯基因医学科技股份有限公司)转染至A431细胞,经嘌呤霉素抗性筛选、传代、收集和提取细胞的总RNA和蛋白,进行Real-time PCR、Western blot和免疫荧光检测BMI-1的表达水平,确认成功构建BMI-1基因沉默的A431细胞系(A431-shBMI-1)。
1.2Real-time PCR 使用TRIzol试剂提取各组细胞RNA,借助Prime Script RT试剂盒 (Takara, 日本)反转录合成cDNA后进行PCR扩增 (Applied Biosystems PCR仪,美国),每个反应体系总体积为20 μL,每组设3个复孔,95 ℃ 30 s,95 ℃ 10 s,60 ℃30 s,40 cycles。检测指标的引物如下:BMI-1:5′-CTGGTTGCCCATTGACAGCG -3′ and 5′-AAATCCCGGAAAGAGCAGCC -3′; ABCB1:5′-TGACTCAGGAGCAGAAGTTTGAACA-3′ and 5′-AAATACATCATTGCCTGGGTGAAG-3′; ABCC3:5′-GACAGATCCCAGATGGTGGTG-3′ and 5′-GGTGCTGCTGAAGCCTTGTG-3′; β-actin (internal control):5′-TGGCACCCAGCACAATGAA -3′ and 5′-C TAAGTCATAGTCCGCCTAGAAGCA -3′。结果分析:采用2-△△Ct法分析。
1.3Western blot 提取各组细胞的蛋白,裂解后测定每个样本的蛋白浓度,上样、电泳、转膜、封闭后加入一抗BMI-1 (Abcam, 英国)、ABCB1 (Cell Signaling Technology, 美国)、ABCC3(Santa Cruz, 美国)和β-actin (Santa Cruz, 美国),4 ℃ 孵育过夜后用TBST洗膜液漂洗3次,再进行二抗 (Santa Cruz,美国)孵育,洗膜、发光、拍照,测定条带的面积及灰度值,以平均灰度值表示蛋白质相对含量,并计算目的蛋白/β-actin比值,表示目的蛋白在各组的相对表达水平。
1.4细胞增殖能力检测 ① MTT法:用含10%胎牛血清的培养液配成单个细胞悬液,以每孔2×104个细胞接种到96孔板,ATRA(浓度:10、20、40、60、80 μmol/L)作用培养细胞24/48 h后,每孔加入MTT溶液20 μL,孵育4 h后终止培养,加入DMSO,在酶联免疫监测仪上490 nm波长测定各孔光吸收值,记录结果。② EdU法:分组同前,干预24 h后,每孔加入EdU培养基(试剂盒购于广州锐博生物),细胞固定、染色、脱色、清洗等步骤后,于荧光显微镜下观察结果,红色荧光反应细胞DNA复制活性。
1.5小鼠成瘤实验 20只6周龄雌性裸鼠购自西安交通大学医学院实验动物中心,分为2组,每组10只,分别于小鼠右侧臀部注射A431-vector细胞和A431-shBMI-1细胞3×106个,于第6天进行随机分组,即将之前的两组分别再分为两组,共4组(A431-vector组;A431-vector+ATRA组;A431-shBMI-1组;A431-shBMI-1+ATRA组),每组5只,第6~14天给予腹腔注射ATRA(10 mg/kg·d),测量瘤体大小及重量,于15 d(对照组肿瘤直径10~15 mm)时处死小鼠,剥离瘤体并测量其大小及重量(瘤体体积=a×b2/2)。
1.6免疫组织化学 在动物实验中,选取A431-vector细胞和A431-shBMI-1细胞成瘤的瘤体,进行石蜡包埋、切片、抗原修复、封闭、孵育一抗(BMI-1和RARβ,Abcam, 英国)、二抗、DAB显色等步骤,完成BMI-1和RAR在瘤体中的免疫组化检测。

2 结果
2.1检测A431-shBMI-1细胞株的BMI-1表达 通过慢病毒转染使BMI-1-shRNA序列进入靶基因后,导致BMI-1基因沉默,靶基因序列为GAAAGTAAACAAAGACAAA。提取A431、A431-vector和A431-shBMI-1三组细胞的RNA和蛋白,Real-time PCR(F=235.30,P<0.001)和Western blot结果(F=163.10,P<0.001)一致显示,与阴性对照组(A431-vector)相比,A431-shBMI-1组细胞的BMI-1表达水平明显降低,表明稳定沉默BMI-1的A431细胞株构建成功,见图1。
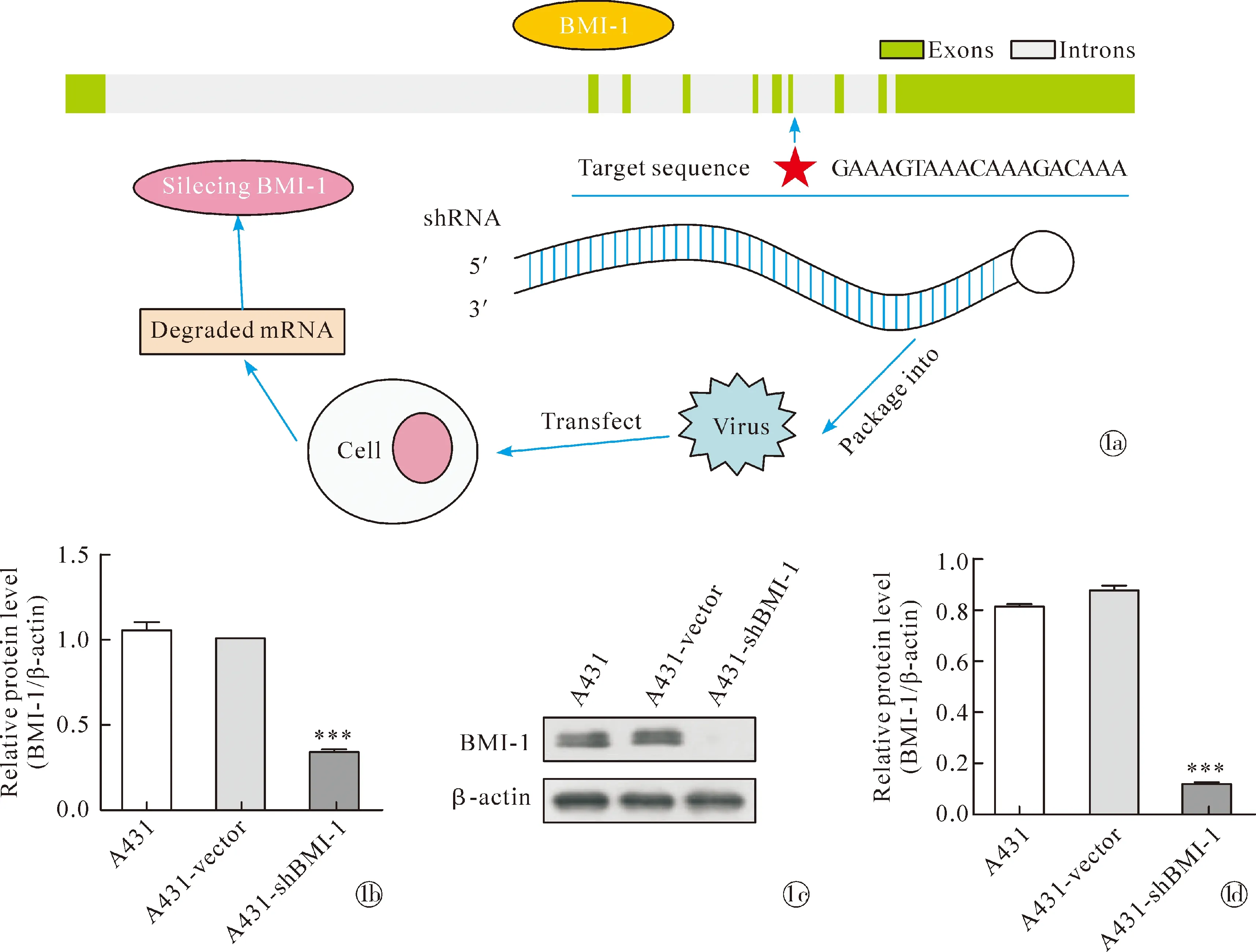
Note:* P<0.05 compared with the control group.
2.2沉默BMI-1后ATRA对A431细胞作用的影响 ATRA作用A431细胞48 h的杀伤效果强于24 h,且在同样浓度的药物作用下,BMI-1沉默组的细胞较对照组存活率更低,BMI-1沉默组的细胞需要较低的药物浓度就可以达到与对照组同样的杀伤率。BMI-1沉默组的细胞,增殖能力相比对照组细胞减弱;不同浓度的ATRA作用A431细胞24 h后发现,同样浓度的ATRA,BMI-1基因沉默组的细胞增殖能力明显低于阴性对照组(t=17.19、7.30、6.93、8.57,P<0.01)。MTT和EdU结果一致显示,沉默BMI-1能够增加A431细胞对ATRA的作用敏感性,见图2。
2.3检测耐药基因ABCB1和ABCC3的表达 通过Real-time PCR和Western blot方法检测了BMI-1沉默前后A431细胞耐药基因ABCB1和ABCC3的表达,结果显示,与阴性对照组相比,BMI-1基因沉默组细胞耐药蛋白的mRNA(F=54.45、13.85,P<0.01)和蛋白表达水平(F=469.54、172.10,P<0.001)明显减少,这提示了沉默BMI-1可能通过下调耐药蛋白在肿瘤细胞中的表达,从而提高A431细胞对ATRA的作用敏感性,见图3。
2.4沉默BMI-1对ATRA抑制A431细胞成瘤能力的影响 小鼠成瘤后进行ATRA干预,检测瘤体体积和肿瘤,瘤体体积的变化如下,与阴性对照组(612.01±231.74)mm3相比,BMI-1基因沉默组(205.13±46.05) mm3及ATRA作用组(283.20±98.12)mm3的肿瘤大小明显减小,沉默BMI-1与ATRA联合治疗组(147.65±57.43)mm3的肿瘤体积最小(n=5,F=4.82,P<0.05)。瘤体重量的变化如下,与阴性对照组(437.20±122.12) mg相比,BMI-1基因沉默组( 193.60±44.77) mg及ATRA作用组(223.00±58.69) mg的肿瘤重量明显降低,沉默BMI-1与ATRA联合治疗组(125.00±40.44) mg的肿瘤体积最小(n=5,F=5.36,P<0.05)。裸鼠成瘤实验的体积曲线和肿瘤重量结果的趋势一致,见图4。
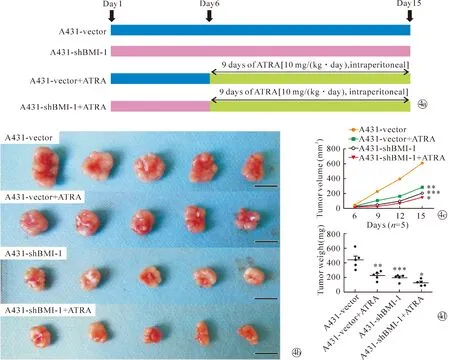
Note:*P< 0.05, ** P<0.01, *** P<0.001 compared with the control group.
2.5小鼠成瘤中沉默BMI-1对维A酸受体β(retinoic acid receptor β, RARβ)表达的影响 为了验证体内实验中BMI-1的敲减效率,在裸鼠成瘤的瘤体组织通过免疫组织化学方法检测了BMI-1的表达,结果显示,和阴性对照组相比,A431-shBMI-1组的瘤体中BMI-1表达显著降低,再次证实BMI-1基因敲减成功。为了进一步研究BMI-1增强ATRA敏感性的机制,在瘤体中检测RARβ的表达变化,与阴性对照组相比,BMI-1基因沉默组的RARβ表达明显增加(t=144.63、116.93,P<0.001),提示RARβ可能参与了BMI-1改善ATRA耐药的过程,见图5。
3 讨论
ATRA具有抑制肿瘤生长、诱导细胞分化和凋亡的能力,在多种癌症中发挥了抗癌活性,包括cSCC[5-6, 12]。既往研究发现,ATRA通过抑制端粒酶活性从而抑制cSCC细胞(HSC-1)的增殖[13],ATRA通过抑制丝裂原活化蛋白激酶(MAPK) -AP1途径从而抑制cSCC细胞生长、诱导细胞凋亡和细胞周期阻滞[14],表明ATRA对cSCC具有明确的抑制作用。笔者的研究发现,ATRA以浓度和时间依赖的方式抑制A431细胞的增殖,在加入ATRA并孵育24 h和48 h后,MTT结果表明,高浓度ATRA对cSCC增殖有明显抑制作用,这与文献报道一致,再次证实了ATRA对cSCC细胞增殖的抑制作用。然而,临床中存在高危型cSCC对ATRA治疗不敏感,提示部分cSCC存在对ATRA耐药的现象。为了避免高浓度ATRA药物不良反应,提高ATRA对cSCC的疗效,分析ATRA耐药机制,探索增强ATRA的药物敏感性具有非常重要的临床意义。
肿瘤干细胞在ATRA耐药过程中有重要贡献,组蛋白脱乙酰酶(histone deacetylase,HDAC)能够通过诱导肿瘤干细胞分化从而改善ATRA的治疗抵抗[15]。已知干细胞更新因子BMI-1在肿瘤耐药中发挥重要作用,且在cSCC及维A酸作用不敏感的A431细胞中高表达,提示下调BMI-1可能成为增强ATRA作用cSCC的重要途径。在本研究中,构建BMI-1沉默的A431细胞株,探讨沉默BMI-1是否能增强ATRA对鳞状细胞癌的药物敏感性。结果表明,在ATRA处理后,沉默的BMI-1细胞的存活率与对照组相比显著下降,并呈浓度和时间依赖性。此外,EdU结果显示,ATRA处理24 h后,BMI-1沉默组细胞的增殖能力较对照组细胞明显下降。上述结果提示,BMI-1高表达可能是A431细胞对ATRA治疗抵抗的重要阻碍因素,而下调BMI-1表达可增加ATRA的药物敏感性。
裸鼠成瘤实验进一步证实了BMI-1对ATRA作用cSCC敏感性的影响,沉默BMI-1后,肿瘤的成瘤能力显著下降,ATRA干预组的成瘤能力较对照组也显著下降,这与细胞学实验一致,表明沉默BMI-1或ATRA干预能够抑制cSCC的进展。此外,单独沉默BMI-1基因与单独ATRA作用相比,前者对肿瘤生长的抑制作用更明显,提示BMI-1基因对鳞癌的进展非常重要,是一个不可忽视的有效的治疗靶点。值得关注的是,在BMI-1沉默组使用ATRA干预后,肿瘤的成瘤能力下降最为显著,提示沉默BMI-1和ATRA治疗对抑制cSCC的增殖具有协同作用,也就是说,降低BMI-1表达能够增加cSCC对ATRA的敏感性。
ATRA耐药机制复杂,与维A酸受体异常、肿瘤干细胞、维A酸代谢和CRABP-Ⅱ和FABP5信号通路、耐药蛋白表达等相关[5, 15]。在本研究中,沉默BMI-1一方面降低了肿瘤的干性,从而增强了ATRA的敏感性。另一方面,ABC转运蛋白在多种恶性肿瘤中高表达,它们通过影响化疗药物的摄取和运输,导致肿瘤的化疗敏感性降低[16]。但是,在BMI-1调控A431细胞对ATRA敏感性的过程中,是否涉及ABC家族蛋白的改变尚不可知。本研究检测了沉默BMI-1前后ABCB1和ABCC3两种耐药蛋白的表达,结果显示,上述两种耐药蛋白的表达与BMI-1的表达呈正相关,降低BMI-1的表达明显下调了ABCB1和ABCC3的蛋白表达水平。这一结果提示沉默BMI-1在增加ATRA作用敏感性的过程中,除了细胞干性降低以外,耐药蛋白的表达下调也参与其中。此外,既往研究发现,RARβ表达减少或缺失,是导致肿瘤对ATRA不敏感的重要原因之一,而重新升高RARβ表达后可恢复ATRA对细胞的促凋亡和周期停滞作用[17]。本研究在瘤体组织中检测RARβ表达,发现BMI-1沉默组的RARβ表达显著升高,因此,笔者推测,RARβ表达的增加可能参与了BMI-1对ATRA作用敏感性的调控。
综上所述,沉默BMI-1和ATRA均可抑制cSCC肿瘤细胞增殖,且二者具有协同作用,即沉默BMI-1能够显著增强cSCC对ATRA的敏感性,耐药蛋白的降低和维A酸受体RARβ表达的升高可能参与这一过程,提示BMI-1可能成为调控cSCC进展的重要靶点,并且,抑制BMI-1联合ATRA可能成为治疗cSCC的潜在策略。
