雌激素受体相关的乳腺癌复发骨转移差异表达基因的生物信息学分析
2023-10-12蒋艳萍彭亚琴
蒋艳萍 秦 健 汪 璐 彭亚琴
乳腺癌是女性发生率最高的肿瘤,其发生率可达女性肿瘤总发生率的1/3[1]。近年来,由于社会大众对疾病的警惕性提高,疾病早期诊断技术和治疗技术的持续改进,乳腺癌的病死率已较20世纪末大大降低,且逐渐趋于平稳[1]。乳腺癌早期被认为是一种可以治愈的疾病,一旦发生转移,患者的5年总生存率就会显著下降[2]。骨组织是乳腺癌发生转移最常见的部位,乳腺癌晚期骨转移的发生率可高达65%~75%[3]。乳腺癌骨转移通常伴有严重的并发症,将引起患者骨痛、骨折及高钙血症等骨相关事件,严重影响患者的生活能力和质量。骨转移发生与否与乳腺癌的预后密切有关,约有超过70%的乳腺癌患者死于骨转移[4]。因此寻找乳腺癌骨转移特异性的预测、治疗靶标,对于乳腺癌骨转移的早期诊断、预防及治疗均有重要的意义。
本研究通过生物信息学方法探讨乳腺癌复发骨转移的相关基因和生物学信号通路,利用Gene Expression Omnibus (GEO)公共数据库,筛选雌激素受体相关的乳腺癌复发骨转移差异表达基因,并对其进行功能富集分析,并分析骨代谢相关基因的表达与雌激素受体表达和乳腺癌复发骨转移的相关性,以进一步了解乳腺癌复发骨转移的发生机制,以期为寻找乳腺癌骨转移早期诊断指标提供线索和依据,促进乳腺癌骨转移分子诊断、治疗技术发展。
资料与方法
1.资料来源:在美国国立生物技术信息中心的GEO DataSets数据库中以“breast cancer”和“bone metastasis”作为关键词搜索,设置研究类型为“expression profiling by array”,设置种属类型为“homo sapiens”。根据临床信息及样本量,选择获得具有雌激素受体表达临床分型及骨复发转移临床信息,且含有286个乳腺癌样本的乳腺癌数据集GSE2034[5]。根据GSE2034的临床信息,该数据集共含107例乳腺癌复发样本,其中ER临床分子分型为阳性的80例,阴性的27例。
2.差异表达基因分析:利用R软件GEOquery和limma软件包下载GSE2034数据集并进行分析,对芯片数据进行log2均一化,并对差异表达分析结果进行FDR(false discovery rate)矫正。校正后的P值,即Padj.<0.05,表达水平相差的倍数>2为差异表达基因。
3.目的表达的获得及相关性分析:本研究根据GSE2034芯片平台信息,获得ESR1(estrogen receptor 1)、SFRP1、TNFAIP3和NEK1相应的探针信息。在GSE2034数据集中,ESR1的探针有217163_at、217190_x_at、205225_at、211233_x_at、211234_x_at、211235_s_at、215551_at和215552_s_at;SFRP1的探针有202035_s_at、202036_s_at和202037_s_at;TNFAIP3的探针有202643_s_at和202644_s_at;NEK1的探针有211086_x_at、213328_at和213331_s_at。对每个基因对应的全部探针对应的表达量值取平均值,代表该基因的表达水平进行复发骨转移相关性、基因表达相关性分析。
4.基因富集分析(gene sets enrichment analysis,GSEA):采用 GSEA软件对 GSE2034复发样本进行了分析,按照ER的临床分型分成ER阳性和ER阴性两组,并在Molecular Signatures Database (MSigDB) 上下载基因集C5[6]:ontology gene sets作为参照基因集,此基因集共含15473种基因集,包括生物学过程、细胞组成成分和分子功能相关的基因集等。按default weighted enrichment statistics方法进行富集分析,随机组合重复次数设置为1000次,FDR<25%且标准化的P<0.05的基因集定义为显著富集的基因集。
结 果
1.雌激素受体的表达状态与乳腺癌骨复发转移有关:乳腺癌数据集GSE2034,是共含有286例乳腺癌患者的肿瘤样本的转录组芯片数据,并含有雌激素受体(estrogen receptor,ER)表达的临床分型、是否有复发以及是否为复发骨转移等临床信息。利用GSE2034数据集临床信息,对乳腺癌样本的ER临床分型以及雌激素受体1(estrogen receptor 1,ESR1)的表达水平与复发骨转移是否有关进行了χ2检验,结果显示临床分子分型为ER阳性的乳腺癌患者发生复发骨转移的比例显著高于ER阴性乳腺癌患者(P=0.0224)。此外,利用测序平台的探针信息,笔者还对ESR1进行了分析,按其是否高于平均值分为高、低两组,并对ESR1的表达水平与复发骨转移进行了分析验证,χ2检验的结果再次提示ESR1表达较高的乳腺癌患者发生复发骨转移的比例显著高于ESR1表达较低的患者(P=0.035,表1)。

表1 雌激素受体表达状态与乳腺癌骨复发转移的统计学分析(n)
2.ER有关的乳腺癌骨复发转移相关差异表达基因的分析:利用R软件limma软件包,分别根据GSE2034数据集中复发样本的ER临床分子分型信息和复发骨转移情况(骨复发转移与非骨复发对比)的差异表达基因进行了分析。经Benjamini &Hochberg矫正后,其表达差异有统计学意义(P<0.05),且表达水平的倍数差异>2的基因中,高表达于骨复发转移样本的基因共有30个(60%),也同时显著高表达于ER阳性的复发样本中。ER阳性复发样本较ER阴性复发样本高表达、骨复发转移较非骨复发样本差异表达基因的韦恩图详见图1。同时显著高或低表达于ER+复发样本和骨复发转移样本的基因列表详见表2。

图1 复发乳腺癌ER表达状态与骨复发转移情况差异表达基因韦恩图

表2 ER+复发样本和骨复发转移样本的共有差异表达基因
3.GSEA分析:为了进一步探讨雌激素受体与乳腺癌复发骨转移的相关性及其可能的分子机制,笔者利用GSEA软件对GSE2034数据集ER不同临床分子分型的样本进行了基因富集分析,以全面了解与乳腺癌复发样本中与ER表达状态相关的骨组织代谢相关的功能基因集。结果显示,ER阴性乳腺癌复发样本显著富集了骨重构负调节(negative regulation of bone remodeling)和骨吸收调控(regulation of bone resorption)相关的功能数据集;而ER阳性乳腺癌复发样本显著富集了胫骨发育不全(HP_Aplasia_Hypoplasia_of_the_Tibia)和四肢骨骼发育不全(aplasia involving bones of the extremities)相关的功能数据集(图2和表3)。
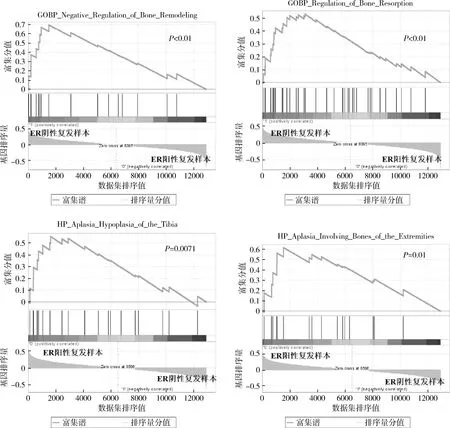
图2 GSEA分析显示骨组织代谢有关的功能基因集

表3 骨组织代谢相关的功能基因集的GSEA分析结果
4.差异表达基因表达相关性:为了进一步探讨ER相关的乳腺癌复发骨转移的差异表达基因的表达特征,笔者对上述GSEA富集的骨发育、代谢相关通路中显著富集基因的表达水平与乳腺癌复发骨转移情况及与ESR1表达水平的相关性进行了分析。其中SFRP1和TNFAIP3均显著富基于Negative_Regulation_of_Bone_Remodeling数据集,且其在骨复发组的表达水平显著低于非骨复发组,其表达水平与ESR1的表达水平呈负相关;NEK1显著富集于Hp_Aplasia_Hypoplasia_of_the_Tibia数据集,且其在骨复发样本的表达水平显著高于非骨复发组,且其表达水平与ESR1的表达水平呈正相关(图3)。

图3 SFRP1、TNFAIP3和NEK1基因相对表达水平与乳腺癌骨复发转移及ESR1表达水平的关联A.SFRP1与骨复发转移相关性;B.TNFAIP3与骨复发转移相关性;C.NEK1与骨复发转移相关性;D.SFRP1与ESR1表达水平的相关性;E.TNFAIP3与ESR1表达水平的相关性;F.NEK1与ESR1表达水平的相关性
讨 论
乳腺癌是全球范围最常见的肿瘤之一,也是女性致死率第2高的癌症[7]。近年来,随着人们对乳腺癌认识的逐渐加深,早期诊疗技术的发展,促进了乳腺癌的诊断初筛和分子分型及治疗,乳腺癌的病死率呈缓慢下降趋势[1]。相较于乳腺癌本身,远处转移尤其是骨转移是其更为重要的致死原因。因而寻找有助于预测乳腺癌骨转移和判断其预后的分子标志物,对于乳腺癌的诊断和治疗极具意义。
雌激素受体的表达水平与乳腺癌骨复发转移有关。70%以上乳腺癌为雌激素受体阳性(ER+),即管腔型(luminal-like subtype)乳腺癌,其骨转移的发生率是基底型(basal-like subtype)乳腺癌的2.5倍[8]。降低雌激素水平,或通过ER阻滞剂、ER调节剂等阻断雌激素作用的内分泌疗法可以显著降低乳腺癌复发[8]。根据数据集GSE2034的临床资料,本研究首先对ER的临床分子分型和芯片平台中ESR1全部探针的表达情况与复发骨转移进行了关联分析。两种分析结果均提示,ER表达水平较高的乳腺癌患者发生骨复发转移的比例显著高于ER表达水平较低的患者。与许多其他研究一致,本研究的这一结果进一步证实ER可能促进乳腺癌骨转移,其表达水平的高低对乳腺癌患者是否发生骨复发转移具有一定的提示作用。
GSEA可在基因组织水平根据数据分组,探寻其相关的生物功能、信号通路,展示相关基因在各组中的表达情况及其统计学意义,已被各种生物医学大数据分析广为应用[6]。笔者利用GSEA软件,根据ER的临床分子分型对乳腺癌复发样本进行了分析,结果显示有4条与骨组织代谢、骨发育相关的基因功能集被显著富集。GSEA结果提示ER的临床分型与乳腺癌细胞中骨组织代谢相关基因的表达有关。
乳腺癌的骨转移过程是乳腺癌细胞与骨微环境相互作用的一个复杂的演变过程。经典的“种子与土壤”和“恶性循环”理论,形象地解释了乳腺癌与骨微环境之间如何相互适应、相互影响并共同完成乳腺癌在骨组织的定植、生长,形成骨转移,并造成骨损伤的过程[9]。在这一过程中,除了人体骨组织微环境这个富含各种生长因子的“肥沃的土壤”外,乳腺癌细胞所合成并释放的成骨分化、破骨分化相关的蛋白,可促进肿瘤细胞对骨稳态的破坏,并最终导致骨损伤[10]。这些由乳腺癌细胞表达的骨相关蛋白对于乳腺癌骨转移具有一定的指示作用。
为了寻找雌激素受体表达有关的乳腺癌复发骨转移相关的基因,笔者对GSEA富集的数据集中显著富集的基因的表达水平进行分析。其中SFRP1、TNFAIP3和NEK1均在骨复发和非骨复发乳腺癌样本中差异表达,且其表达水平与雌激素受体的表达水平显著相关。其中SFRP1和TNFAIP3显著低表达于骨复发转移组,且其表达水平与雌激素受体表达水平呈负相关;NEK1显著高表达于骨复发转移组,且其表达水平与雌激素受体表达水平呈正相关。SFRP1(secreted frizzled-related protein 1)是Wnt信号通路的负向调控因子,在成骨细胞和骨髓间充质肝细胞分化的过程中发挥重要的负向调控作用[11, 12]。TNFAIP3(tumor necrosis factor alpha-induced protein 3,A20)是NF-κB信号通路的负向调控因子,可通过负向调控该通路信号转导抑制破骨细胞生成[13]。NEK1(NIMA-related kinases 1)是一种磷酸激酶,参与了初级纤毛的形成,其表达缺陷与骨组织发育障碍有关[14, 15]。GSE2034数据集的分析结果提示,SFRP1、TNFAIP3和NEK1是与雌激素受体表达水平相关的,可能参与了乳腺癌骨转移复发的基因,可作为预测、治疗乳腺癌骨转移的分子标志物。
寻找具有预测、诊断、治疗价值的乳腺癌骨转移分子标志蛋白任重而道远。本研究利用公用数据库及多种生物信息学分析手段,对雌激素受体表达情况相关的乳腺癌复发骨转移有关的生物学功能和基因进行了分析。乳腺癌具有高度异质性,本研究分析所得的结果仍需大量的临床样本及生物实验进行综合验证,旨在更准确地了解乳腺癌骨转移机制,并为预测和治疗乳腺癌提供科学依据。
