骨髓间充质干细胞外泌体源性miR-128调控GSK3B参与脑梗死进展
2023-10-12李云莹张伟华吕亚楠
李云莹 梁 栋 张伟华 吕亚楠 王 芳 刘 敬
脑梗死又称为缺血性脑卒中,可诱导脑细胞损坏与凋亡[1]。近年来外泌体成为多种疾病治疗的新策略[2]。有研究表明,外泌体能穿透血-脑脊液屏障,对治疗脑梗死具有重要意义[3]。间充质干细胞是一种多功能干细胞,间充质干细胞来源的外泌体已被报道能治疗多种脑部疾病,如人脐带间充质干细胞来源的外泌体分泌miR-146a-5p能降低缺血脑卒中后小胶质细胞介导的神经炎症[4]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCS)来源的外泌体通过激活SphK1/S1P1信号通路,减少Aβ沉积并改善阿尔茨海默病小鼠的认知功能恢复[5]。研究发现,上调miR-128-3p水平有助于缺血诱导的脑损伤神经元的存活[6]。据报道,miR-128-3p在BM-MSCS外泌体中高表达,能促进骨愈合[7]。但是BM-MSCS外泌体源性miR-128-3p对于脑梗死是否具有调控作用仍有待于进一步明确。
材料与方法
1.试剂与器材:TTC染色液购自北京索莱宝科技有限公司;杜氏改良Eagle 培养基购自北京诺博莱德科技有限公司;TRlzol试剂、第1链cDNA合成试剂盒、SYBR Green预混液、Lipofectamine 3000转染试剂均购自美国Thermo Fisher公司;CD9抗体、Flotillin抗体、Calnexin抗体、GSK3B抗体、β-actin抗体、IgG抗体、ELISA试剂盒(TNF-α、IL-6)均购自英国Abcam公司;LC3抗体购自武汉艾美捷科技有限公司;293T细胞购自武汉普诺赛生命科技有限公司;RIPA裂解液购自上海碧云天生物技术有限公司;双荧光素酶报告检测试剂盒购自上海翊圣生物科技有限公司;流式细胞仪购自美国BD公司;酶标仪购自美国REAGEN公司;7500实时荧光定量PCR仪购自美国ABI公司。
2.大脑中动脉闭塞模型(middle cerebral artery occlusion, MCAO)建立:使用5只6~7周龄C57BL/6J雄性大鼠建立MCAO模型,体质量为192~213g。将大鼠安置在SPF级环境中,按照之前描述的线栓法制备模型[8]。大鼠腹腔注射3%戊巴比妥钠(50mg/kg),并固定在手术台上,消毒颈部并切开,分离右侧颈总动脉,尼龙线涂上石蜡,从颈外动脉缓慢插入右颈内动脉,闭塞2h。拔出尼龙线,24h后进行缝合与消毒。假手术组(sham组)仅分离颈动脉后便缝合伤口,未插入尼龙线。之后40mg/kg戊巴比妥钠麻醉大鼠后将其以颈椎脱位法处死,取出梗死脑组织,切成2mm的薄片备用。
3.生物信息学分析:采用GEO数据库进行数据挖掘,选中GSE29287数据集进行分析。R语言limma包对GSE29287中差异表达miRNA进行筛选,TargetScanHuman7.1网站用于预测miRNA的下游靶基因。
4. BM-MSCS和外泌体的分离与鉴定:取2周龄C57BL/6J雄性大鼠提取BM-MSCS,提取方法与鉴定如之前描述[9]。将BM-MSCS在上述培养基中培养48h。采用差速离心法分离外泌体。透射电子显微镜观察外泌体形态,Western blot法检测外泌体中CD9、Flotillin、Calnexin的表达。
5.动物分组与细胞处理:尾静脉注射100μg外泌体(3×108颗粒/微升)治疗MCAO大鼠作为exo组,尾静脉注射同剂量的外泌体抑制剂GW4869作为GW4869组。将大鼠分为sham组(假手术组)、MCAO组、exo组(MCAO大鼠尾静脉注射BM-MSCS外泌体)、GW4869组(MCAO大鼠尾静脉注射100μg外泌体抑制剂GW4869)、exo-miR-128mimic组(MCAO大鼠尾静脉注射转染了miR-128mimic的BM-MSCS外泌体)、exo-miR-128 inhibitor组(MCAO大鼠尾静脉注射转染了miR-128 inhibitor的BM-MSCS外泌体)、exo-miR-128 inhibitor+si-GSK3B组(MCAO大鼠尾静脉注射转染了miR-128 inhibitor的BM-MSCS外泌体以及si-GSK3B),以上转染借助Lipofectamine 3000试剂盒完成。
6.RT-qPCR:TRlzol试剂用于提取组织中总RNA,使用第1链cDNA合成试剂盒将1μg的RNA反转录为cDNA。使用引物与SYBR Green预混液,在7500实时荧光定量PCR仪上对miR-128与GSK3B的表达量进行检测,程序反应设定为:50℃ 2min,95℃ 2min;95℃ 15s、52℃ 15s、72℃ 1min循环40次。以GAPDH与U6作为内部参考,采用2-ΔΔCt公式计算相对表达量。miR-128上游引物:5′-GATACGAGCAGCTACAGC-3′,下游引物:5′-AAGCTACGAGCGCGTAAAGCC-3′。GSK3B上游引物:5′-AATCGACGCGCGCGCGAAAGC-3′,下游引物:5′-CCCATCGAGGAAGGGAGATATATAC-3′。GAPDH上游引物:5′-TTAGCGCGAGAGAGTTAGATCG-3′,下游引物:5′-AATGCGCGAAGTCTATGCGGC-3′。U6上游引物:5′-TAATTAGCAGCGAGCAAACCCC-3′,下游引物:5′-CGGCGATCTATCTGCGTTCGGTGC-3′。
7.双荧光素酶报告实验:借助StarBase在线预测网站预测miR-128与GSK3B的靶向结合位点,使用双荧光素酶报告实验验证miR-128与GSK3B的靶向关系。扩增GSK3B中含有miR-128序列的3′UTR片段,克隆到pmirGLO载体上,命名为GSK3B-WT,对GSK3B中含有miR-128结合位点的片段进行定点突变,扩增并克隆到pmirGLO载体上,命名为GSK3B-MUT。使用Lipofectamine 3000转染试剂将GSK3B-WT、GSK3B-MUT分别与miR-128NC、miR-128mimic共转染到293T细胞中,在培养箱中孵育48h,按照双荧光素酶报告检测试剂盒说明书的要求对各组细胞的荧光素酶活性进行检测。
8.Western blot法检测:使用RIPA裂解液裂解组织中蛋白,BCA法检测总蛋白的浓度,将提取的蛋白用10%十二烷基硫酸钠聚丙烯酰胺凝胶进行电泳,转移至PVDF膜上。使用5%脱脂牛奶进行封闭。之后加入一抗CD9(1∶2000)、Flotillin(1∶10000)、Calnexin(1∶20000)、LC3-Ⅰ(1∶2000)、LC3-Ⅱ(1∶2000)、GSK3B(1∶10000)、β-actin(1∶10000),TBST洗膜,使用辣根过氧化物酶偶联的山羊抗兔二抗IgG(1∶1000)孵育1h。TBST洗膜,使用ECL试剂检测蛋白信号,借助Image J软件对蛋白信号进行分析。
9.ELISA:将组织剪碎,取2ml放入玻璃匀浆器,加入10ml预冷的PBS充分研磨,超声破碎,5000×g离心5min,收集上清液使用ELISA检测TNF-α、IL-6的表达。检测步骤按照ELISA试剂盒说明书进行。酶标仪测定450nm的吸光度(A)值,绘制标准曲线并计算浓度。

结 果
1.BM-MSCS外泌体鉴定:透射电子显微镜观察外泌体发现其呈典型杯状或囊泡状结构(图1A),Western blot法实验显示外泌体标志物CD9、Flotillin均表达阳性,Calnexin表达阴性(图2B)。以上实验证实BM-MSCS源性外泌体分离成功。
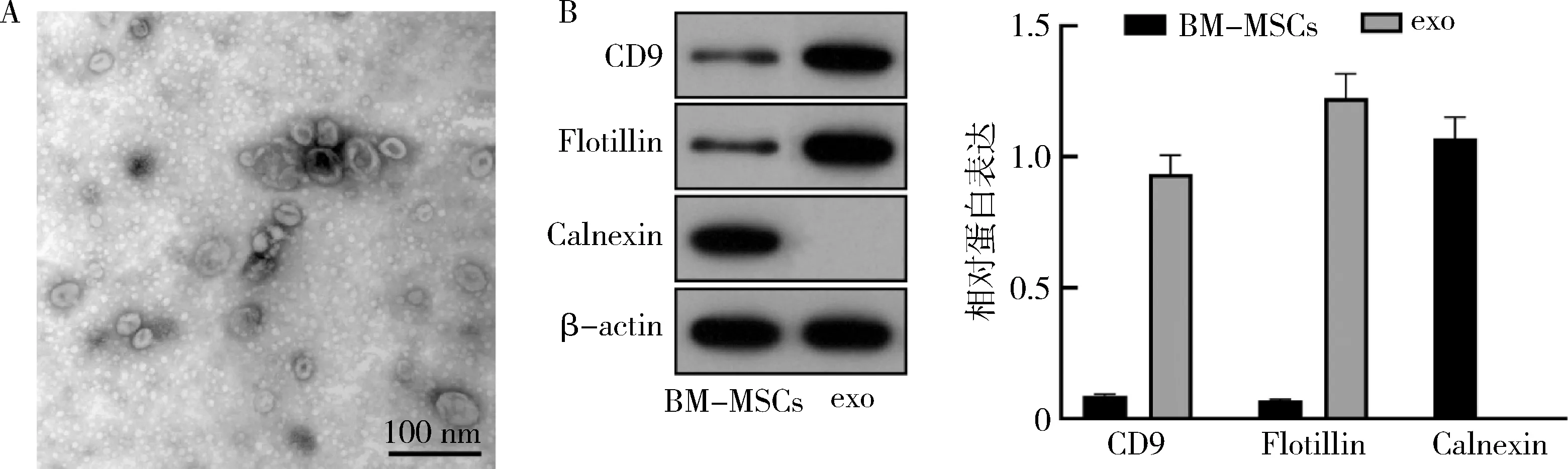
图1 BM-MSCS与外泌体鉴定A.透射电子显微镜观察出典型的外泌体形态;B.Western blot法检测外泌体标志物的表达
2.miR-128在MACO大鼠脑组织中表达下调:GSE29287数据集中显示miR-128在脑卒中神经祖细胞中表达降低(图2A)。由于BM-MSCS一般在疾病中发挥治疗作用,因此本研究关注在脑卒中中表达下调的miRNA,查阅文献后发现miR-128在脑缺血中发挥保护作用因此将其纳入研究。与sham组比较,MCAO大鼠脑组织中miR-128表达下调(图2B,P<0.05)。以上实验说明,异常表达的miR-128可能在脑梗死发展中具有重要意义。
3.BM-MSCS外泌体能抑制MCAO大鼠自噬与炎性细胞因子分泌:与sham组比较,MCAO大鼠组织中LC3-Ⅱ/LC3-Ⅰ表达以及TNF-α、IL-6浓度增高(P均<0.05)。与MCAO组比较,exo组中LC3-Ⅱ/LC3-Ⅰ表达下降,TNF-α、IL-6浓度降低(P均<0.05)。与exo组比较,GW4869组中LC3-Ⅱ/LC3-Ⅰ表达以及TNF-α、IL-6浓度升高(P均<0.05, 图3)。
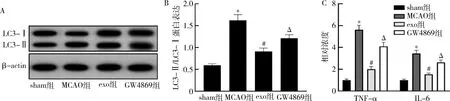
图3 BM-MSCS外泌体能抑制MCAO大鼠自噬与炎性细胞因子分泌A、B.自噬标志物LC3-Ⅱ/LC3-Ⅰ的表达;C.各组TNF-α、IL-6水平。与sham组比较,*P<0.05;与MCAO组比较,#P<0.05;与exo组比较,ΔP<0.05
4.BM-MSCS外泌体通过miR-128发挥治疗作用:与 sham组比较,MCAO组中miR-128表达下调,与MCAO组比较,exo组中miR-128表达上调,加入GW4869后miR-128的表达被抑制(图4A,P均<0.05)。功能实验检测结果显示,与MCAO组比较,exo-miR-128mimic组中LC3-Ⅱ/LC3-Ⅰ表达下降,而exo-miR-128 inhibitor组中LC3-Ⅱ/LC3-Ⅰ表达升高(图4中B、C,P均<0.05)。与MCAO组比较,exo-miR-128mimic组中TNF-α、IL-6浓度均下调,而exo-miR-128 inhibitor组中TNF-α、IL-6浓度提高(图4D,P均<0.05)。以上实验说明,在外泌体中下调miR-128能抑制外泌体的治疗作用,提示外泌体通过miR-128发挥作用。

图4 BM-MSCS外泌体通过miR-128发挥治疗作用A.qRT-PCR检测miR-128的表达;B、C.自噬标志物LC3-Ⅱ/LC3-Ⅰ的表达;D.各组TNF-α、IL-6水平。与sham组比较,*P<0.05;与MCAO组比较,#P<0.05;与exo组比较,ΔP<0.05
5.miR-128靶向调控GSK3B:借助Targetscan靶向关系预测网站发现miR-128和GSK3B存在特异性结合位点,双荧光素酶报告实验结果显示较GSK3B-WT+miR-128NC组,GSK3B-WT+miR-128mimic组的荧光素酶活性下降(P<0.05,图5A)。此外,与sham组比较,MCAO大鼠脑组织中GSK3B的mRNA和蛋白表达增强(P均<0.05,图5中B、C)。

图5 miR-128与GSK3B的靶向关系验证A.GSK3B和miR-128的特异性结合位点以及靶向关系验证结果;B、C.MCAO大鼠脑组织中GSK3B的表达检测结果
6.敲减GSK3B能部分挽救exo-miR-128 inhibitor发挥的作用:Western blot法和ELISA结果显示(图6),与MCAO组比较,exo-miR-128 inhibitor组中LC3-Ⅱ/LC3-Ⅰ表达升高,TNF-α、IL-6浓度上调,而较exo-miR-128 inhibitor组,exo-miR-128 inhibitor+si-GSK3B组LC3-Ⅱ/LC3-Ⅰ表达下降,TNF-α、IL-6浓度降低(均P<0.05)。以上实验结果证实,下调外泌体中miR-128的表达能抑制外泌体的治疗作用,但转染si-GSK3B后外泌体的治疗作用得到部分恢复。

图6 敲减GSK3B能部分挽救exo-miR-128 inhibitor发挥的作用A、B.各组自噬标志物LC3-Ⅱ/LC3-Ⅰ的蛋白表达;C.各组TNF-α、IL-6水平。与sham组比较,*P<0.05;与MCAO组比较,#P<0.05;与exo-miR-128 inhibitor组比较,ΔP<0.05
讨 论
近年来BM-MSCS在缺血性脑病治疗方面取得良好成效。研究表明BM-MSCS释放的外泌体能维持缺血缺氧状态下神经细胞存活[10]。此外,间充质干细胞外泌体能够分泌miR-542-3p抑制TLR4来抑制炎症发生并预防脑梗死[11]。本研究首先结合生物信息学筛选在急性脑梗死中差异表达的miRNA,由于BM-MSCS一般在疾病中发挥治疗作用,因此本研究选择在急性脑梗死中低表达的miRNA进行研究。Mao等[6]研究发现,miR-128-3p表达降低会增加小鼠脑梗死体积而增强miR-128-3p的表达有利于促进缺血性脑损伤中神经元的存活。本研究进一步对MCAO大鼠模型脑组织中miR-128的表达进行检测,发现miR-128在MCAO大鼠脑组织中的表达被抑制,这与Mao等[6]的研究结果一致。此外,加入BM-MSCS外泌体后miR-128表达增强,提示BM-MSCS外泌体中miR-128高表达。
研究显示,自噬在缺血性脑损伤中发挥重要作用,长期自噬能导致细胞死亡,也称为Ⅱ型程序性细胞死亡[12]。已有研究证实,短暂性大脑中动脉闭塞模型和缺氧/糖剥夺/再灌注细胞模型中自噬标志物LC3-Ⅱ/LC3-Ⅰ、Beclin-1的表达升高[13]。此外,脑梗死会诱导神经炎症也与脑损伤相关,促炎细胞因子TNF-α、IL-6、MCP-1会促进炎性发生[14]。本研究通过功能实验进一步证实了将外泌体注射进大鼠体内能显著抑制大鼠体内自噬标志物LC3-Ⅱ/LC3-Ⅰ的蛋白表达水平以及TNF-α和IL-6的浓度,改善MCAO大鼠的自噬与炎性反应,但下调miR-128后外泌体的治疗作用被抑制,说明外泌体是通过分泌miR-128对MCAO大鼠发挥治疗作用,因此本研究认为BM-MSCS外泌体中高表达的miR-128可能是脑梗死的潜在治疗靶点。
本研究还发现miR-128能调控 GSK3B发挥作用。既往研究表明,GSK3B异常激活可触发tau蛋白磷酸化,导致阿尔茨海默病的神经元损伤和认知功能受损[15]。此外也有研究揭示了GSK3B抑制剂YQ138能够通过激活Nrf2信号通路来预防谷氨酸和脑缺血引起的神经元损伤[16]。本研究证实了GSK3B和miR-128之间存在靶向关系且GSK3B在MCAO大鼠脑组织中高表达。进一步设计挽救实验验证GSK3B在脑梗死中的作用发现,当在外泌体中敲减miR-128抑制外泌体的治疗作用后,下调GSK3B能部分恢复外泌体的功能。进一步揭示了BM-MSCS源性外泌体通过分泌miR-128调控GSK3B发挥细胞自噬与炎性抑制作用。
本研究仍存在一定不足,如未对大鼠体内的自噬进行原位检测,外泌体中发挥功能的分子除了miRNA,还有其他非编码RNA如LncRNA或者circRNA,以及编码RNA等,这都将是以后继续研究的方向。
综上所述,BM-MSCS外泌体源性miR-128可能通过靶向GSK3B抑制脑梗死自噬与炎性反应发生,过表达miR-128可能是缓解脑梗死缺血性损伤的潜在靶点。
