内皮细胞在心肌重构中的作用研究进展
2023-10-12刘方圆唐其柱
刘方圆 唐其柱
慢性心力衰竭(以下简称心衰)是对特定的应激源(如持续压力负荷或心肌梗死)的反应所引起心脏结构和功能发生异常变化的一组复杂的临床综合征。心肌重构被普遍认为是慢性心衰进展的关键过程,心脏最初通过增加大小和质量以使壁应力正常化并允许静止时的正常心血管功能对额外的负荷或心脏损伤进行补偿性反应[1]。随着时间的推移,持续的压力负荷或疾病会导致心室扩张、间质纤维化、收缩功能下降并最终发展为心衰[2]。Pinto等[3]研究发现,内皮细胞(endothelial cells, ECs)是非心肌细胞中数量最多的细胞类型,分布在血管的内表面,包括毛细血管、小动脉、动脉、静脉和淋巴管,作为血液和血管壁之间的功能和结构屏障,具有调节血流和维持血管壁通透性的基本功能。内皮功能和冠状动脉微循环的变化已被证明在心肌重构和心力衰竭的进展中发挥重要作用。Wan等[4]利用单细胞测序技术系统地探究了小鼠慢性心力衰竭非心肌细胞谱系的变化轨迹和内在调节反应,发现内皮细胞是导致晚期心力衰竭心脏进一步恶化或功能障碍的关键驱动因素。
心脏毛细血管密度降低、冠状动脉血流储备降低以及随后的组织缺氧、细胞死亡和间质纤维化会导致收缩功能障碍和心力衰竭的发展。尽管有很多研究者对心肌重构的病理生理学方面进行研究,但尚未确定临床有效的靶点。本文讨论了心脏内皮细胞在心肌重构中的作用,着重关注内皮代谢、内皮间质转化和内皮细胞衰老等内皮功能变化在心肌重构中的作用及研究进展,加深对心脏的复杂细胞环境在心肌重构中作用的理解,为找到治疗心肌重构的策略提供可能性。
一、心脏内皮细胞
心脏是一个复杂的多细胞器官,由心肌细胞和非心肌细胞组成,包括心肌成纤维细胞、内皮细胞、平滑肌细胞、周细胞和免疫细胞等,它们密切合作和相互作用以维持正常的心脏功能和调节心脏修复[5,6]。近年来,单细胞RNA 测序技术(single-cell RNA sequencing, scRNA-seq)的发展帮助研究人员进一步准确地揭示了心脏的细胞组成和细胞表达网络的异质性[7,8]。心脏中5 种最多的细胞类型分布是心肌细胞、内皮细胞、成纤维细胞、周细胞和巨噬细胞[7~9]。心脏的主要细胞组成如图1。
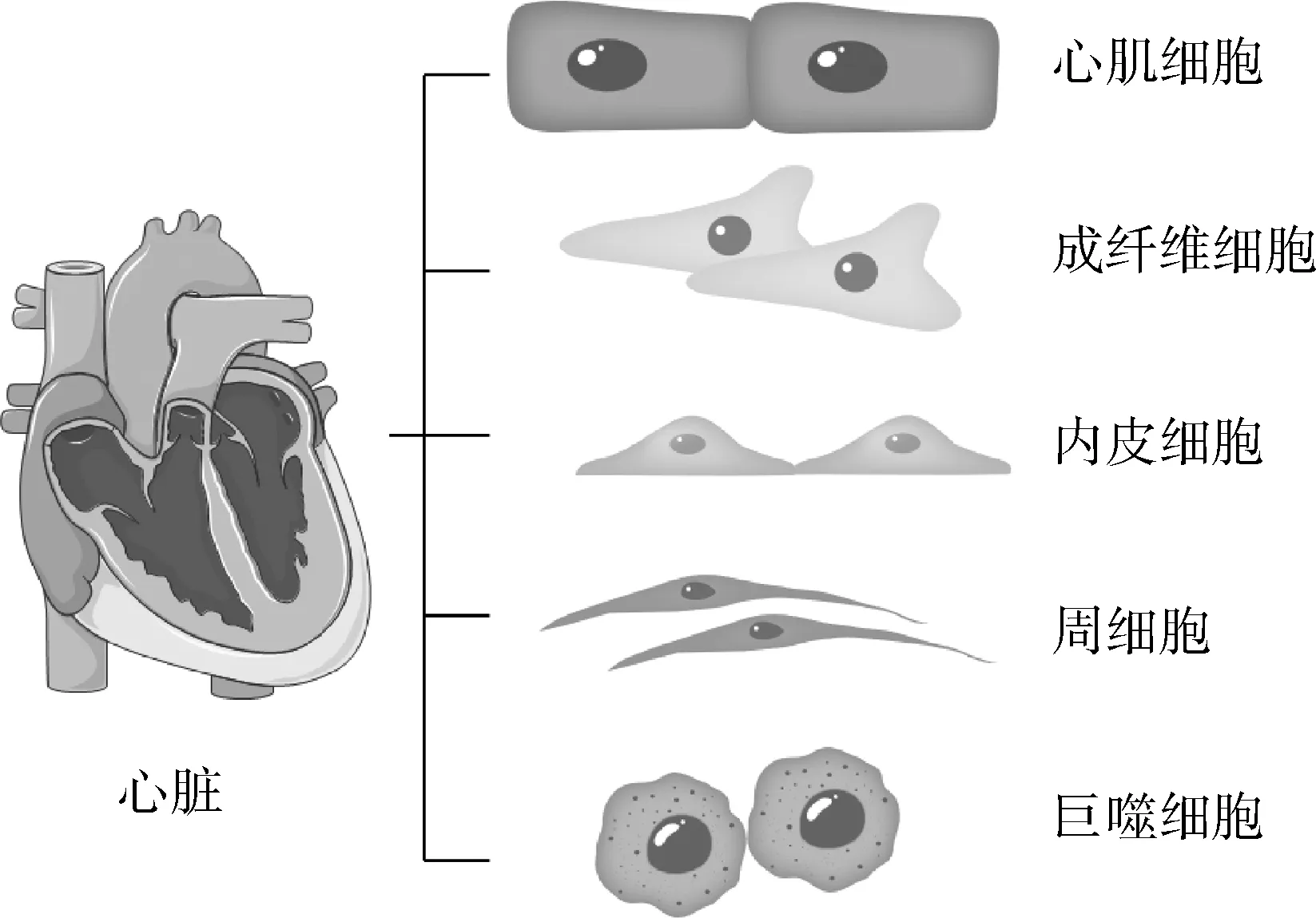
图1 心脏的细胞组成示意图
虽然心肌细胞占心肌组织体积/质量的 70%~85%,其数量仅占心脏实际细胞数量的约1/3,非心肌细胞群的数量庞大,且对于正常的心脏稳态和功能同样重要[10]。它们提供细胞外基质,介导细胞间通讯,并提供心肌细胞收缩和长期存活所需的血管供应。Pinto等[3]使用新的遗传示踪剂和增强的流式细胞术技术来分析人和小鼠的心脏,显示内皮细胞是主要的非心肌细胞,数量占非肌细胞总数的 60%。在正常哺乳动物的心肌中,每个心肌细胞都被一个错综复杂的毛细血管网络所包围,并且紧挨着内皮细胞,每个心肌细胞与微血管内皮细胞的距离不超过 2~3μm[11]。内皮细胞表型在不同器官之间、同一器官内血管环的不同节段之间以及同一器官和血管类型的相邻内皮细胞之间存在异质性。
二、scRNA-seq揭示内皮细胞在心肌重构中的作用
在组织细胞水平上,心脏重构是心肌中存在的所有细胞类型改变的结果,这些细胞类型也因心脏损伤、损伤、神经激素激活和压力而相互密切相互作用。在心衰患者中发现心脏组织中的非心肌细胞会因衰竭而发生大规模的分子特征转化,而成纤维细胞和内皮细胞是主要来源[4,8]。Wan等[4]研究发现,缺血引起的小鼠慢性心力衰竭增加了心脏成纤维细胞、内皮细胞及其亚群中特异性标志基因的数量。不仅是细胞数量上的变化,小鼠在心力衰竭阶段基因表达水平变化也主要集中在这些细胞上[4,12]。Wang等[8]研究发现,与健康对照组比较,衰竭心脏中 EC3的保护因子分泌减少(从69.19%减少到27.56%),他们将配体与其相应的受体相关联构建细胞-细胞相互作用图,发现EC3与其他细胞类型的相互作用数量最多,突出了其在细胞串扰中的核心作用。
Ren等[13]用横主动脉收缩模型(transverse aortic constriction, TAC)诱导的压力过载后的不同阶段来描述心肌肥厚过程中不同心脏细胞类型的时空相互作用,TAC早期观察到EC亚型从正常心脏的炎性反应负调控(EC2)到心力衰竭的肌细胞发育(EC5和EC6)的功能转变,导致心肌细胞肥厚。使用传统的批量分析工具几乎不可能在不同的细胞和组织类型之间分析和解释旁分泌信号通路。用于分析 scRNA-seq 数据的信息学工具的开发为研究细胞间通讯和信号转导提供了一个有前景的解决方案。内皮不仅控制血管内外物质的交换,还可通过分泌和释放活性因子发挥调节作用[14]。Wan等[4]研究发现,在心力衰竭晚期,成纤维细胞与其他细胞的信号通讯明显减弱,可能与在重构阶段成纤维细胞整体过度老化有关,而内皮细胞与其他细胞的通讯加强。scRNA-seq 分离广泛不同的细胞亚群,对细胞表型理解的突破为心血管基础科学带来了新的见解,有助于揭示与 HF 发病和进展有关的分子机制和开发新的改进疗法。
三、内皮细胞代谢
心肌是具有高代谢需求的组织,需从密集的血管和毛细血管网络接收血液和能量供应。与其他常驻细胞类型不同,心脏 ECs,特别是微血管 ECs,线粒体含量较低,葡萄糖是其用于产生能量的主要底物[15]。尽管可以立即获得血液中的氧气,ECs严重依赖糖酵解途径(获取超过 85% 的能量需求),而不是氧化磷酸化(oxidative phosphorylation, OXPHOS),将葡萄糖转化成乳酸产生三磷酸腺苷(adenosine triphosphate, ATP),且利用糖酵解产生的ATP进行细胞增殖、迁移和血管新生,在此过程中产生的少量丙酮酸用于为 OXPHOS 提供燃料[16, 17]。当从静止状态转变为增殖和迁移时,ECs 会增加糖酵解通量[17]。营养物质须通过毛细血管床运输到心肌细胞,心脏 EC 表达高水平的脂肪酸转运蛋白,以不断地将脂肪酸输送到心脏。
近年来的研究强调了 ECs 代谢在心肌重构和心衰中的重要性。He等[18]研究发现,在 SIRT3 缺陷型 ECs 中,内皮糖酵解代谢受损,导致心肌毛细血管稀疏、冠状动脉血流储备降低、血管周围纤维化和舒张功能障碍。Gao等[19]研究发现,AngⅡ通过增强内皮细胞糖酵解诱导内皮-间质转化(endothelial-mesenchymal transition, EndMT)从而影响血管周围纤维化。此外,糖酵解代谢物之一乳酸还可以通过充当信号分子来调节血管生成。ECs 被认为是旁分泌信号的重要来源,作用于其环境中的细胞。最初被视为代谢废物的乳酸(作为代谢燃料或诱导旁分泌效应的信号分子)因其在细胞间通讯中的作用而备受关注。在有氧条件下,细胞-细胞和细胞内的乳酸穿梭在心脏和其他组织之间实现能量底物的产生和分配以及细胞信号转导的基本目的,乳酸脱氢酶的过表达诱导了肌成纤维细胞的形成[20]。
通过结合使用体外共培养系统和条件培养基实验,Zhang等[21]研究表明,内皮细胞糖酵解代谢产生的乳酸经血管分泌启动了乳酸穿梭,通过单羧酸转运蛋白(monocarboxylate transporter 1,MCT1)被巨噬细胞摄取,激活巨噬细胞中 MCT1 依赖性氧化开关,促进巨噬细胞向具有促血管生成和促再生的M2 样表型的极化。乳酸极化巨噬细胞还上调血管内皮生长因子的表达,从而形成进一步刺激血管生成的正反馈回路[21]。ECs不再是一个简单的屏障,而是被组织损伤所激活,成为乳酸等代谢物的储存库。以含有大量乳酸的ECs为原料和燃料,与免疫细胞的乳酸转运蛋白结合,促进细胞因子的释放,增强免疫细胞对受损组织的修复作用。ECs 的主要能量来源来自葡萄糖酵解,而脂肪酸代谢和谷氨酰胺氧化通常被认为通过 OXPHOS 补充三羧酸循环。当糖酵解速率降低时,脂肪酸和氨基酸的氧化代谢提供的能量可能会增加,以支持 ECs 活性。抑制脂肪酸代谢和谷氨酰胺氧化导致ECs增殖减少。然而,这些ECs代谢途径在心肌重构和心衰中的研究匮乏值得深入研究,ECs 和心脏环境中其他细胞之间的串扰中的作用和机制仍有待于充分探索,了解 EC 代谢的作用和潜在机制将促进调节血管生成相关疾病的新治疗方法。
四、内皮间质转化与心肌重构
尽管ECs的经典作用是确保血管内壁的正常功能,但越来越多的证据表明,ECs在器官发育、内稳态和组织修复中发挥着更直接和积极的作用。EndMT是一个复杂的生物学过程,在此过程中内皮细胞进行性和动态丧失其典型的鹅卵石形态和紧密连接,显示典型的间充质细胞形态和功能,获得增加的运动性和分泌 ECM 蛋白的能力[22, 23]。内皮细胞在EndMT过程中失去内皮细胞特异性蛋白的表达,如CD31/血小板-内皮细胞黏附分子、血管性血清学因子和血管内皮黏附蛋白,并开始间充质细胞特异性基因的表达和编码蛋白的产生,包括α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)、成纤维细胞特异性蛋白-1以及Ⅰ型和Ⅲ型胶原(COL-1、COL-3)等[23]。内皮间质转化示意图详见图2。
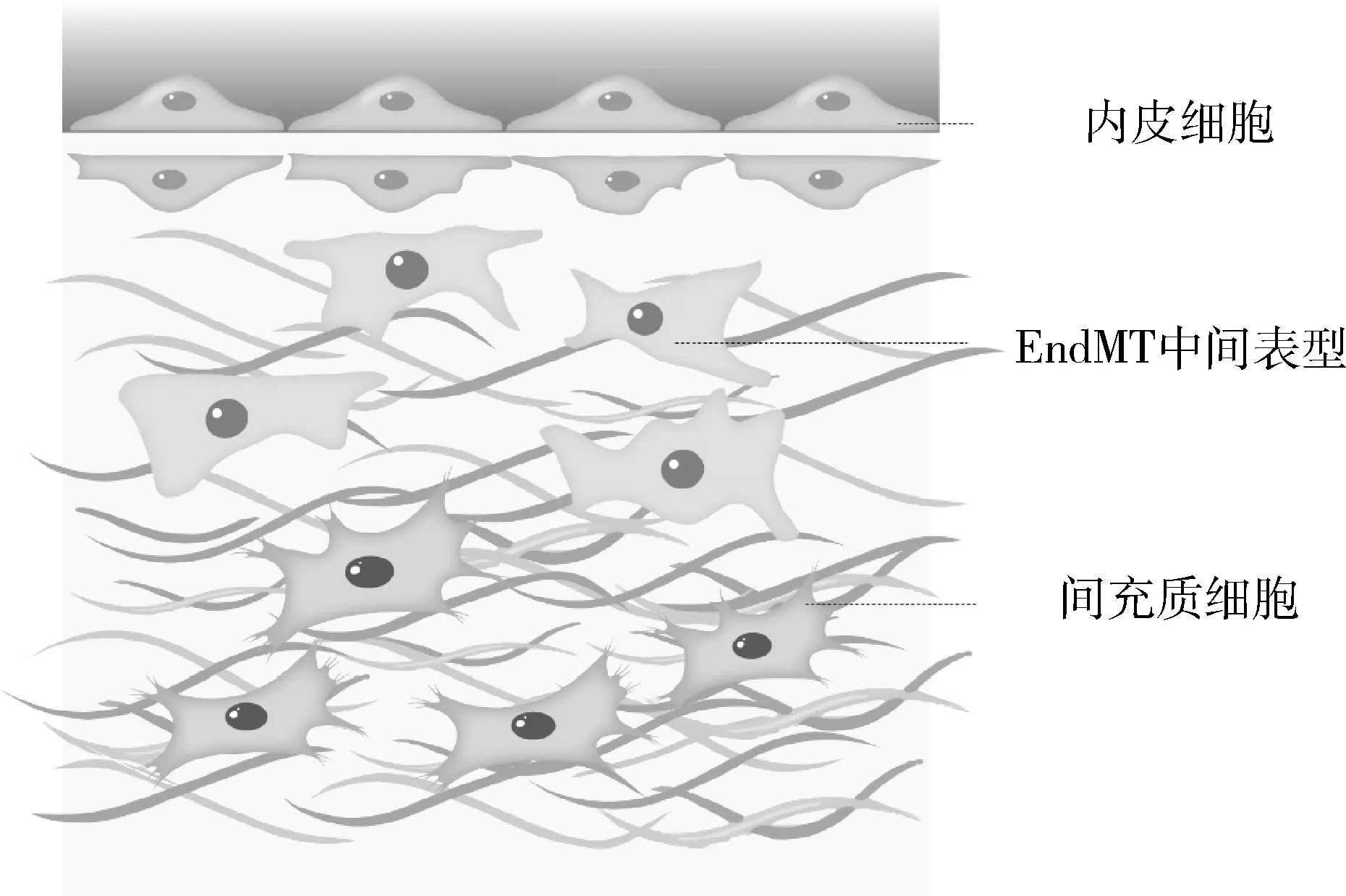
图2 内皮间质转化示意图
单细胞测序发现心脏组织中的非心肌细胞会因衰竭而发生大规模的分子特征转化,而内皮细胞是主要来源之一[4]。EndMT通常被认为与心肌重构中的心肌纤维化、伤口修复和炎症有关[24]。心脏纤维化是晚期心力衰竭患者的共同特征,主要与舒张功能障碍和心脏僵硬度增加有关。心肌纤维化瘢痕的数量与心律失常和猝死的发生率增加密切相关[25]。Ricard等[26]诱导内皮特异性敲除Erk2小鼠在 5 周内死亡,影响心脏传导系统的纤维化是这些小鼠普遍致死的原因。免疫染色和内皮命运图谱显示这些小鼠 TGF-β 信号转导的强烈增加导致广泛的EndMT,室间隔和左心室内广泛存在心肌纤维化[26]。然而,内皮细胞对间充质细胞谱系的贡献始终存在争议。Tombor等[27]揭示了小鼠心肌梗死后经历短暂间充质激活(transient mesenchymal activation, EndMA)而不是完整的EndMT,即部分EndMT。在小鼠心肌梗死后的第1周ECs 主要聚集在具有间充质基因的簇中,获得了短暂的间充质激活状态,在14天后恢复到基线水平。这些EndMA 细胞表达适度水平的间充质标记基因,且在体外是可逆的[27]。
Peisker等[28]将遗传命运追踪与共聚焦成像和单细胞 RNA 测序相结合,对小鼠心力衰竭期间细胞类型特异性转录组的变化进行分析,没有观察到TAC后内皮细胞中内皮间质转化或瞬时间充质激活基因组的富集。但这些争议并不能完全排除ECs 对心脏纤维化的贡献,首先来源于内皮细胞间充质细胞扰乱了内皮细胞的屏障功能,增强了内皮细胞与心肌细胞的相互作用,有助于心肌成纤维细胞的积累和心肌细胞的丢失,从而促进心肌纤维化。其次在心脏纤维化过程中,其他未被检测的基因,如骨膜素等,仍有可能被瞬时激活。另外,经历 EndMA/EndMT的内皮细胞可能分泌细胞外基质和相关炎症蛋白,这会影响伤口愈合反应,从而可能间接促成纤维化。
五、内皮细胞衰老
内皮功能随年龄的增长而逐渐衰退,在细胞水平上,氧化和炎症应激的持续积累导致内皮细胞衰老,导致遗传和表观遗传改变,表现为形态改变、表型改变、DNA损伤、细胞周期阻滞和代谢途径紊乱。基底毛细血管密度降低和血管反应性降低使衰老组织易缺血,对血管生成刺激的反应性降低和内皮细胞增殖能力降低限制了组织的恢复和修复。衰老与内皮细胞的血管生成功能相关,在衰老的内皮细胞中,增殖减少可能会限制形成新血管结构的能力,血管生成和血管消退过程之间的动态平衡对于维持心脏和其他器官(包括大脑)中的微血管网络至关重要。衰老还通过改变控制增殖、黏附、迁移、细胞凋亡、生长因子和细胞因子的合成和释放、平滑肌募集和血管稳定的关键细胞信号转导途径,损害内在的内皮血管生成过程。
在老化的内皮细胞中,内皮一氧化氮合酶(endothelial nitric oxide synthase, eNOS) 的丰度或活性降低,内源性 NOS 抑制剂水平升高,L-精氨酸供应减少,由 NOX 氧化酶产生的活性氧水平增加,一氧化氮(nitric oxide, NO)的生物利用度降低,不仅会导致血管舒张功能障碍,还将损害血管生成和血管退化过程之间的动态平衡,并促进微血管稀疏。在代谢方面,衰老降低内皮细胞的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)水平,衰老细胞(如衰老 ECs)分泌的衰老相关分泌表型因子可以增加体外非衰老细胞中CD38 的表达,CD38 是一种消耗 NAD+ 的酶,通过其外酶活性降低组织 NAD+ 的水平[29,30]。有研究表明,NAD+中间体——烟酰胺单核苷酸治疗可逆转年龄相关的内皮功能障碍,并改善内皮血管生成过程。谷氨酰胺分解是衰老内皮细胞在体内和体外存活所必需的,而抑制谷氨酰胺分解可以消除衰老内皮细胞并改善与年龄相关的器官功能障碍。
近年来研究发现,抑制谷氨酰胺酶1(glutaminase 1, GLS1,谷氨酰胺分解的第一个酶和限速酶)改善ANG Ⅱ诱导的小鼠心肌重构中的心肌肥厚和纤维化[31]。烟酰胺核苷 (nicotinamide riboside, NR) 是研究最多的 NAD+ 前体之一,可用于恢复包括内皮在内的多种组织中随年龄增长而稳步下降的 NAD+ 水平,已在心衰的几个临床前模型中显示出有希望的治疗前景[31]。Zhang等[32]研究发现,使用NR治疗提高了人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)线粒体未折叠蛋白反应的水平,降低了HUVECs中成纤维细胞特异性标志物波形蛋白和α-SMA 的表达,并增强了EC 特异性标志物 CD31的表达,由 TGF-β1 诱导的HUVECs内皮间质转化得以抑制。衰老内皮细胞和周围心脏细胞群之间存在串扰,衰老的内皮细胞显示内皮素-1 (endothelin-1, ET-1,血管收缩剂之一) 产生增加, ET-1 分泌导致衰老的心脏成纤维细胞中胶原蛋白合成增加,导致胶原蛋白和纤连蛋白积累,这是与年龄相关的心脏重构的特征。衰老内皮细胞群可能是药物去除衰老细胞或抑制衰老表型来治疗与年龄相关的血管功能障碍的潜在靶点。
六、展 望
综上所述,心脏中的内皮细胞通过代谢,内皮间质转化以及内皮衰老在调节心肌纤维化、心肌肥厚以及血管生成发挥了重要作用。心脏内皮细胞对来自邻近细胞的血流动力学和旁分泌信号做出反应,通过刺激心肌细胞的生长和收缩力或在肌成纤维细胞中产生细胞外基质蛋白,甚至会改变其表型并转分化为产生细胞外基质的细胞,积极参与心脏重构过程,在从适应性心脏肥大到心力衰竭的转变中起着核心作用。然而,潜在的治疗策略目前仅限于实验、临床前阶段,尚未进入临床。未来可利用scRNA-seq 进行组学分析进一步探究心脏不同位置内皮细胞和衰老内皮细胞在心肌重构和心衰中的作用,寻找可能的心衰的治疗靶点。
在临床干预之前创建患者特异性细胞图谱,基于scRNA-seq 的细胞数量、基因表达谱和细胞异质性评估将补充现有的诊断测试,并告知医生确定最有效、个性化的治疗选择。通过直接或间接干扰激活EndMT的信号通路抑制内皮间充质转化和心肌纤维化在众多临床前实验被研究。除此之外还应关注到部分EndMT是动态可逆的,间质细胞还通过间充质-内皮细胞转化 (mesenchymal-endothelial transition, MEndT) 获得内皮样功能,参与受损心脏区域的血管生成,修复受损血管,逆转心肌纤维化,详见图2。未来可深入探索控制 EC 可塑性的调节机制,寻找新的可能的靶点特异性调节和促进MEndT,以MEndT替代EndMT响应环境压力,提高MEndT衍生细胞的功能成熟度,识别MEndT衍生细胞的表型特性和特征,寻找MEndT衍生细胞如何被精确调控并转化为特定功能性内皮细胞群的新机制,为治疗心肌纤维化和心脏肥大提供新的策略。总之,内皮细胞在心肌重构和心衰进展中发挥着重要作用,继续研究靶向内皮细胞的治疗策略有助于将相关疗法推广至临床应用中。
