PGC-1α调控非酒精性脂肪肝病线粒体功能的作用研究
2023-10-12王雪梅王怡婷汪洁英
王雪梅 王怡婷 车 悦 汪洁英 门 可
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是指没有过量饮酒史,以脂肪变性和蓄积为主要病理特征。约1/5的NAFLD患者由于炎性反应进展成非酒精性脂肪性肝炎,肝纤维化发生肝硬化甚至肝细胞癌[1]。NAFLD的患病率是25.24%,胰岛素抵抗、2型糖尿病、肥胖等代谢性疾病也更容易发生在NAFLD患者身上[2]。NAFLD的发病机制常见的是“二次打击”理论,即先是脂质代谢紊乱、脂质蓄积,后是炎症和氧化应激加重病变[3]。NAFLD的细胞模型复制方法都是打破能量代谢平衡,促进脂肪变性和蓄积。人肝癌细胞HepG2、人胚胎肝细胞L02和小鼠肝实质原代细胞都是良好的模型载体,干预方式常用棕榈酸和油酸按照不同的比例混合成游离脂肪酸孵育细胞,或者用高浓度血清干预,还有就是葡萄糖和胰岛素共同干预[4,5]。
线粒体是细胞内相对独立的细胞器,有双层膜结构和独立的DNA。线粒体通过呼吸链的氧化还原反应,完成氧化磷酸化产生ATP[6]。过氧化物酶体增殖物激活受体α(peroxisome proliferators-activatedreceptors alpha,PPARα)是一种核激素受体,参与调节脂质分解相关酶基因的转录[7]。PPARα的靶基因肉毒碱棕榈酰转移酶-1A(carnitine palmitoyltransferase-1A,CPT-1A)是催化脂肪酸氧化的关键限速酶[8]。过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferators-activated receptors gamma co-activator 1α,PGC-1α)参与调节线粒体生物合成相关转录因子的表达,其中核呼吸因子1(nuclear respiratory factor-1,NRF-1)、线粒体转录因子A(mitochondrial transcription factor A,mtTFA)参与调控线粒体DNA的生物合成,NRF-1和mtTFA都是PGC-1α的靶基因[9,10]。线粒体功能在NAFLD脂质蓄积中的作用有待于进一步阐明,本研究旨在探讨PGC-1α介导线粒体功能调控肝细胞脂质蓄积,为寻找NAFLD治疗新靶点提供理论依据和参考。
材料与方法
1.主要试剂与材料:HepG2人肝癌细胞株由西安医学院病理教研室赠予;人源过表达慢病毒载体PPARGC1A,NM_001330751和阴性对照病毒(LV-control)购自上海吉凯基因医学科技股份有限公司;甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)试剂盒、肝功能指标丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、油红O染液均购自南京建成生物工程研究所;实时荧光定量试剂盒购自Life Technologies公司;DNA引物购自生工生物工程(上海)股份有限公司;PPARα、CPT-1A、PGC-1α、NRF-1、mtTFA蛋白一抗购自英国Abcam公司,蛋白一抗GAPDH购自美国Cell Signaling Technology公司;蛋白二抗试剂盒购自北京中杉金桥生物技术有限公司;增强型化学发光显影液(enhanced chemiluminescence,ECL)试剂盒购自美国Invitrogen公司;1%磷酸酶抑制剂购自美国Thermo公司;0.5%蛋白酶抑制剂、RIPA缓冲液、BCA蛋白质分析、粒体膜电位检测C2006、活性氧检测S0033S购自上海碧云天生物技术有限公司;油酸SLB07659V、棕榈酸SLB02406V购自美国Sigma公司。
2.细胞转染方法:待HepG2生长至50%~70%融合度,不同病毒感染复数(multiplicity of infection,MOI)转染慢病毒LV-PPARGC1A(2×108TU/ml);阴性对照病毒LV-control(CON238,uBI-MCS-SV40-EGFP-IRES-puromycin,1×109TU/ml),加入病毒感染增强剂A和P,待转染72h后观察转染效果。实时荧光定量PCR法检测PGC-1α过表达情况,引物序列:上游引物::5′-CAGAGAGTATGAGAAGCGAGAG-3′,下游引物:5′-AGCATCACAGGTATAACGGTAG-3′。GAPDH为内参基因,引物序列:上游引物:5′-GCAAATTCCATGGCACCGT-3′, 下游引物:5′-TCGCCCCACTTGATTTTGG-3′。
3.HepG2细胞脂肪堆积模型和分组:取油酸和棕榈酸按照2∶1(浓度0.66mol/L∶0.33mol/L)的比例用DMSO分别溶解,混合制成游离脂肪酸(free fatty acid,FFA)。10%胎牛血清溶于DMEM高糖培养基,置于CO2细胞培养箱培养。分为对照组、FFA模型组(1.5mmol/L FFA孵育24h)、LV-PGC-1α干预组(PPARGC1A慢病毒转染后,1.5mmol/L FFA孵育24h)、LV-control 干预组(阴性对照慢病毒转染后,1.5mmol/L FFA孵育24h)。
4.细胞内脂质:细胞裂解液裂解细胞,BCA法测定蛋白质浓度,试剂盒测定TC、TG含量,表示为mmol/(g·prot)。油红O染色,于510nm处测定吸光度(A)值,检测细胞内脂质蓄积情况。
5.肝损伤指标和细胞内氧化应激指标:试剂盒检测细胞上清液中AST、ALT的含量变化。比色法检测细胞内中SOD和GSH-PX的活性,MDA含量。
6.线粒体ATP含量和线粒体DNA(mitochondrial DNA,mtDNA)复制倍数:裂解细胞测定蛋白浓度和细胞内ATP含量,单位为纳摩尔/克(nmol/g)。试剂盒提取细胞DNA并测定浓度,检测ND1基因代表线粒体mtDNA的复制倍数,GAPDH是内部参数。配置20μl反应体系进行DNA扩增,用2-ΔΔct方法得出定量结果。ND1引物序列:上游引物:5′-GGAGTAATCCAGGTCGGT-3′,下游引物:5′-TGGGTACAATGAGGAGTAGG-3′。GAPDH引物序列:上游引物:5′-AAGGTGGAGGAGTGGGTGT-3′,下游引物:5′-TCAAGAAGGTGGTGAAGCAG-3′。
7.Western blot法检测脂质分解相关蛋白、线粒体生物合成蛋白表达:冰上裂解细胞得到蛋白上清液,BCA法测定蛋白质浓度,蛋白变性后10%SDS-PAGE分离等量的蛋白质40μg并转膜。封闭1h,孵育蛋白一抗于4℃下过夜。37℃二抗体孵育1h,ECL显影固定。使用Image J软件分析A值,以GAPDH蛋白校正结果。比较PPARα、CPT-1、PGC-1α、NRF-1和mtTFA的蛋白表达。

结 果
1.细胞转染效率:LV-PGC-1α干预过表达PGC-1α基因,过表达效果显著(图1)。比较3种不同病毒感染复数MOI=30、MOI=50、MOI=100在4种转染条件下的转染效率,荧光倒置显微镜观察显示,随着MOI的增加,慢病毒对HepG2的转染效率逐步增加,并且增高程度呈线性关系,荧光强度随转染效率增高。MOI=100,72h时病毒转染加入增强剂P后的转染效率最高,MOI=50接近MOI=100时的转染效率,因此选择MOI=50,添加增强剂P,转染72h为实验终点。实时荧光定量PCR测定HepG2细胞中PGC-1α的表达情况,结果显示,与LV-control干预组比较,LV-PGC-1α干预组的PGC-1α显著过表达,详见图2。
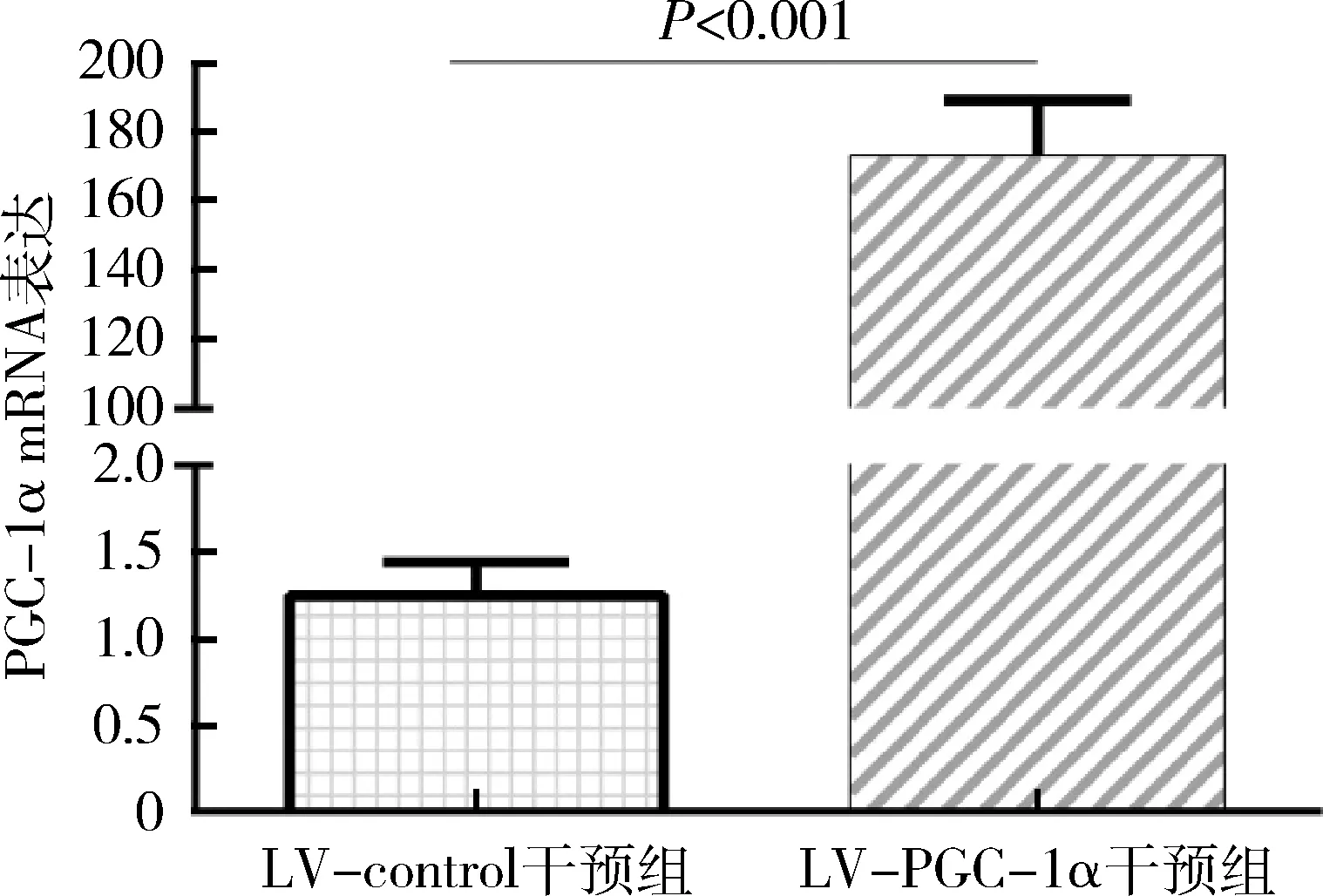
图2 慢病毒转染后PGC-1α基因过表达
2.PGC-1α过表达对HepG2细胞脂质蓄积的作用:油红O染色检测细胞脂质蓄积,与对照组比较,FFA模型组的脂质蓄积显著增加;与LV-control干预组比较,LV-PGC-1α干预组的脂质负荷显著降低。510nm处的A值组间差异显著(F=25.431,P<0.001),详见图3。LV-PGC-1α干预显著降低细胞内TG和TC含量,详见表1。
表1 HepG2细胞内TG和TC的含量
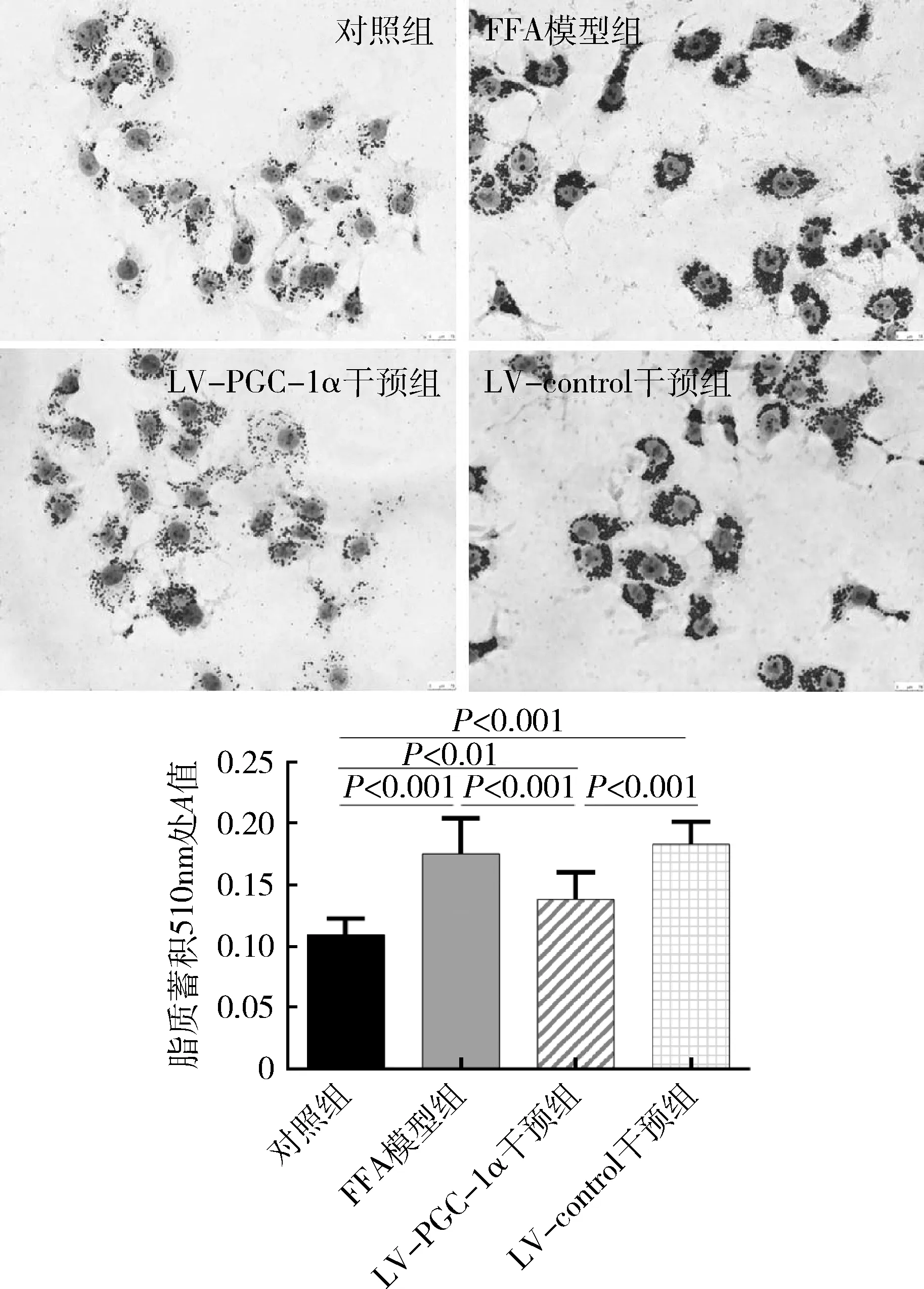
图3 HepG2细胞油红O染色观察脂质蓄积情况(×400)及半定量检测510nm处的A值
3.肝细胞损伤指标:与对照组比较,FFA模型组细胞上清液中ALT和AST显著增高,LV-PGC-1α干预组的ALT和AST较LV-control干预组降低,详见表2。

表2 细胞上清液AST和ALT变化
4.肝细胞氧化应激指标:与对照组比较,FFA模型组细胞中的SOD酶活性显著降低、GSH-PX酶活性显著降低,MDA含量显著增加;与LV-control干预组比较,LV-PGC-1α干预组的SOD活性增加,GSH-PX酶活性显著升高,MDA水平下降,提示PGC-1α可减轻高脂导致的氧化应激,详见表3。

表3 HepG2细胞内氧化应激指标
5.PGC-1α过表达对HepG2细胞ATP含量的影响:检测细胞ATP含量,组间差异显著(F=21.675,P<0.001)。与对照组比较,FFA模型组的ATP含量显著降低(3.80±0.42μmol/g vs 8.08±0.89μmol/g,P<0.001);与LV-control干预组比较,LV-PGC-1α干预组的ATP含量增加(5.30±1.10μmol/g vs 3.82±0.26μmol/g,P<0.05),详见图4。
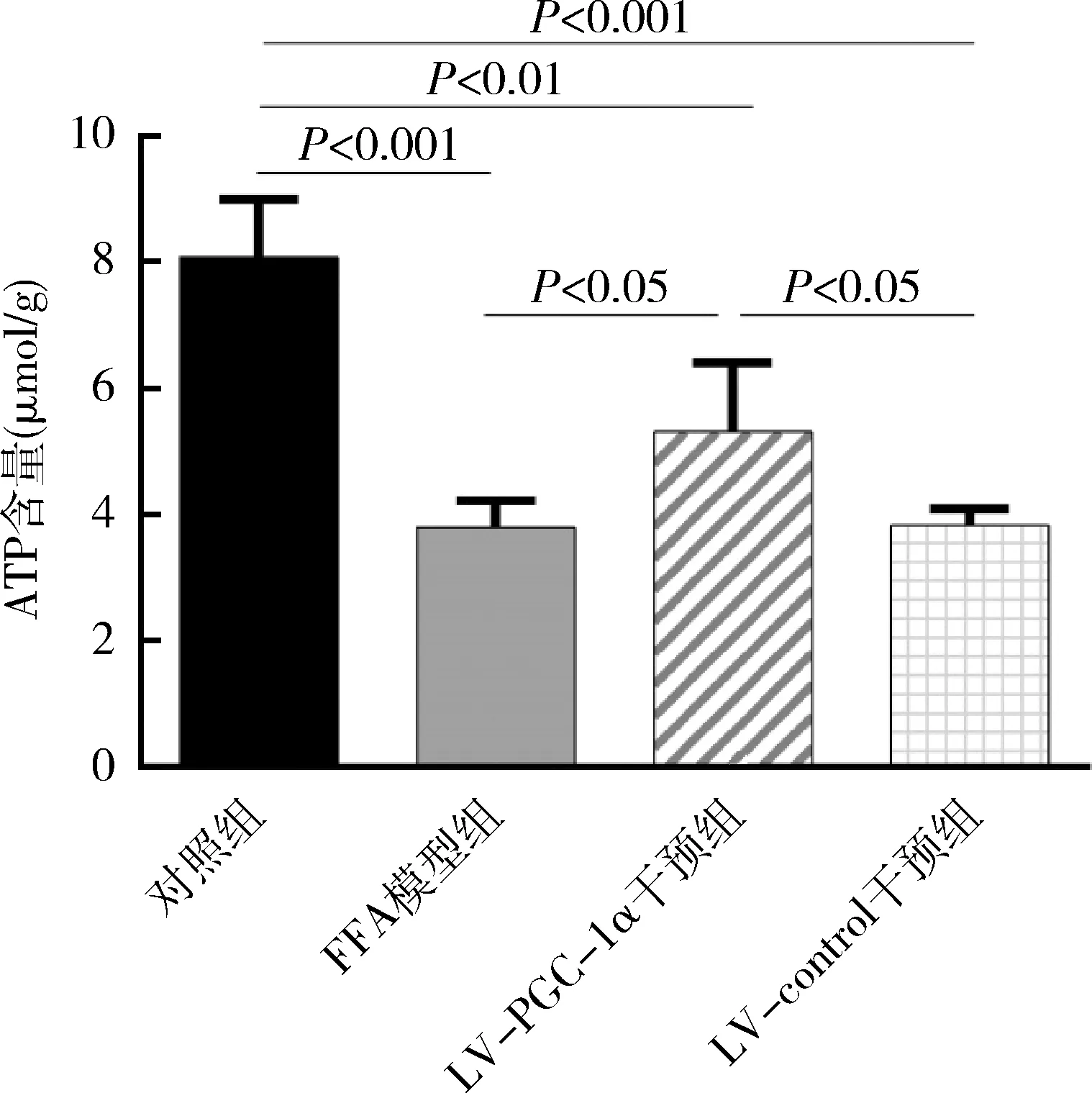
图4 HepG2细胞线粒体ATP含量
6.PGC-1α过表达对HepG2细胞mtDNA复制数作用:结果显示,mtDNA复制数组间差异显著(F=13.780,P<0.001),FFA干预降低细胞的mtDNA复制倍数。与对照组比较、FFA模型组的mtDNA复制数显著降低;与LV-control干预组比较,LV-PGC-1α干预组的mtDNA复制数增加,详见图5。

图5 HepG2细胞mtDNA拷贝数变化
7.Western blot法检测脂质氧化相关因子、线粒体生物合成因子的蛋白表达:与对照组比较,FFA模型组的脂质氧化相关因子PPARα和CPT-1A的表达显著下调、线粒体生物合成相关因子PGC-1α、NRF-1、mtTFA的表达下降。与LV-control干预组比较,LV-PGC-1α干预组PPARα显著上调,PGC-1α、NRF-1、mtTFA的表达显著增加,详见图6、表4。PGC-1α过表达通过增加线粒体的生物合成,促进脂质氧化分解来减轻FFA引起HepG2细胞的脂质蓄积。

表4 各组细胞脂质分解相关因子、线粒体生物合成因子的蛋白表达
讨 论
NAFLD病理表现为脂质异常积聚在肝细胞,其中棕榈酸和油酸是人体内普遍的饱和脂肪酸和单不饱和脂肪酸[11,12]。多项机制研究表明,FFA和TG造成的肝脏脂毒性与NAFLD严重程度密切相关。FFA激发内质网应激、线粒体应激,通过激活氧化应激相关信号通路以及炎性信号通路,诱导脂质代谢紊乱、炎性反应和凋亡[13,14]。本研究用FFA诱导HepG2细胞造成NAFLD模型,LV-PGC-1α干预后观察其对脂质蓄积的作用。结果表明,PGC-1α过表达,细胞内TG和TC含量显著降低,脂滴蓄积减少,AST和ALT水平降低,氧化应激指标下降,细胞ATP含量增加,mtDNA复制倍数增加,脂质氧化和线粒体生物合成相关蛋白的表达增加。即PGC-1α通过增强线粒体生物合成、ATP生成、加强脂肪酸氧化分解,降低HepG2细胞脂质蓄积。
NAFLD患者肝脏以TG的形式堆积脂肪,而TG主要来源于FFA等的酯化作用[15]。核激素受体包括调节脂质代谢的遗传网络的配体激活的转录因子,包括PPARα,固醇调节元件结合蛋白等[16,17]。核激素受体不仅能作为转录因子调节基因表达,还可以结合脂质分子作为细胞内受体。固醇调节元件结合蛋白-1c主要控制脂肪酸生物合成基因,PPARα参与调节脂肪酸的氧化,CPT-1是催化脂肪酸氧化的关键限速酶,促进脂肪酸分解。肝脏脂质的分解途径有脂肪酸氧化,以极低密度脂蛋白将TG运出肝脏[18]。脂代谢吸收、合成和分解过程中的任何一个环节异常,都可能导致肝脏脂质过度蓄积。本研究结果显示,PGC-1α过表达后,脂质分解相关基因PPARα和CPT-1上调。
NAFLD病理情况下,TG分解时脂肪酸β氧化作用加强。线粒体氧化磷酸化过程中会产生活性氧(reactive oxygen species,ROS),适量的ROS被机体的抗氧化系统清除,但是过量的ROS引起细胞的氧化应激[19]。mtDNA是独立的双链DNA,因为缺乏DNA修复酶,更容易受到ROS的攻击[20]。线粒体既是ROS的主要来源,也是ROS攻击的主要靶标。首先,ROS攻击mtDNA发生氧化损伤,氧化应激通过形成氧自由基破坏细胞蛋白质和核酸分子(DNA/RNA)的结构与功能。8-羟基脱氧鸟嘌呤核苷是mtDNA损伤的一种分子标志物[21]。氧化应激加速细胞膜脂质过氧化,期间伴随着MDA的含量增加,抗氧化酶SOD和GSH-PX经过消耗其活性降低[22,23]。其次,线粒体PGC-1α调控mtDNA的生物合成,表现为其靶基因下调后,mtDNA的拷贝数减少,氧化磷酸化速率减慢,使得ATP含量下降[24]。
本研究中PGC-1α过表达减轻脂质氧化应激,线粒体生物合成增加,ATP含量上调,脂质氧化分解增强,降低肝细胞的脂质蓄积[25]。先前研究证实,在PGC-1α基因缺乏小鼠的主动脉中NRF-1和mtTFA蛋白表达下降,加速小鼠主动脉血管的老化,这与本研究结果一致[26,27]。
综上所述,FFA诱导HepG2细胞形成过量的TG,造成脂质蓄积,引起细胞氧化应激和线粒体功能障碍,脂质氧化速率减缓。本研究进一步明确,PGC-1α过表达促进脂质分解相关因子PPARα和CPT-1上调,线粒体生物合成因子NRF-1、mtTFA的表达显著增加,增强肝细胞线粒体的β氧化,降低肝脏的氧化应激损伤和脂质蓄积,为非酒精性脂肪肝病的治疗找到新的作用靶点提供了思路和参考依据。
本研究也存在一定局限性,如仅探讨了NAFLD病变中线粒体生物合成相关的因子和肝脏脂质氧化分解相关的基因的表达,有待于全面系统探讨肝脏脂质合成和代谢的其他转录因子的表达情况。肝脏作为人体脂质代谢的核心器官,通过调节TG和TC的代谢,影响作用于循环系统的的脂质水平,深入探讨肝脏线粒体对于脂质的调节机制,对于预防和治疗高脂血症、动脉粥样硬化等疾病具有重要的参考价值。
