鸡血藤治疗糖尿病周围神经病变的网络药理学研究及机制探讨
2023-10-11铁岩李潇杨鑫伟刘浩龙许利平
铁岩 李潇 杨鑫伟 刘浩龙 许利平
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病常见并发症之一,临床上主要通过控制血糖、改善神经微循环和营养神经等措施来防治DPN,但是西药治疗效果有限、成本较高且易发生药物依赖,DPN的治疗仍存在局限性[1]。中医认为DPN属于肢痹、脉痹、痹证、痿证等范畴,治疗在分型论治基础上多加用化瘀通络之品[2]。因鸡血藤具有良好的活血补血、舒筋活络功效,常用于治疗DPN[3],但其作用于DPN的物质基础和作用机制研究尚不清楚。
本研究通过网络药理学和分子对接技术预测鸡血藤治疗DPN的活性成分及作用机制,采用UPLC-MS/MS测定鸡血藤水煎液化学成分,并通过细胞实验探究鸡血藤药效物质对DPN中雪旺细胞(schwann cell,SCs)可能的作用机制。
1 材料与方法
1.1 网络药理学分析
1.1.1 鸡血藤活性成分及疾病靶点收集与筛选 通过数据库与分析平台(TCMSP,http://lsp.nwu.wdu.cn/tcmsp.php)中查找鸡血藤化合物信息,以口服生物利用度≥30%、药物相似性≥0.18筛选鸡血藤活性化合物。使用TCMSP、Symmap(http://www.symmap.org/)、pharmmapper(http://www.lilab-ecust.cn/pharmmapper/)数据库对化合物进行DPN靶点预测。在GeneCards(http://www.genecards.org/)、 OMIM(http://omim.org/)和DrugBank (https://go.drugbank.com/)数据库中以“diabetic peripheral neuropathy”为关键词检索DPN相关靶点。将所有靶点在uniprot(http://www.uniprot.org/)数据库进行规范。
1.1.2 蛋白质—蛋白质相互作用(protein-protein interaction,PPI)网络构建 将鸡血藤活性成分靶点与DPN相关靶点进行韦恩分析,交集靶点即为鸡血藤治疗DPN的潜在靶点,将其提交至String11.0数据库,得到PPI网络并进行可视化,计算各靶点度值。将排名前5的靶点作为鸡血藤作用于DPN的关键靶点。
1.1.3 通路与功能富集分析 基于Metascape平台对鸡血藤治疗DPN的潜在靶点进行GO注释分析和KEGG通路分析,筛选排名靠前的生物过程和通路并对结果可视化。
1.1.4 鸡血藤成分—DPN靶点—通路网络图构建 使用Cytoscape3.7.1软件构建鸡血藤成分—DPN靶点—通路网络图,利用该软件内置工具分析有效成分及靶点的网络拓朴学参数,包括连接度(degree)、介度(betweenness)及紧密度(closeness)等,根据Degree选取度值排名前10的化合物作为鸡血藤治疗DPN的关键化合物。
1.1.5 分子对接 在TCMSP、Pubchem数据库中获得鸡血藤治疗DPN的关键化合物结构,在Auto Dock Tools中进行去水、加氢操作,保存为pdbqt格式;在PDB数据库中下载5个关键靶点的蛋白质结构,于Pymol软件中进行去溶剂、去配体,并在Auto Dock Tools中进行加电荷等操作,使用Auto Dock Vina软件进行分子对接。
1.2 实验验证
1.2.1 主要试剂与仪器 鸡血藤饮片(购自北京同仁堂药店,经首都医科大学副教授罗容鉴定为正品);芒柄花黄素(formononetin,FMNT)(485-72-3,上海源叶生物有限公司);乙腈(AH015,Honeywell);雪旺细胞(Schwann cells,SCs)RSC96细胞系(CRL-2765,ATCC);胎牛血清(C0230,Bovogen);DMEM高糖培养基(C11965500BT,gibco);细胞用双抗(PB180120,普诺赛);细胞用DMSO(D2650,Sigma)。
CCK8试剂盒(C6005,新赛美);Tunel试剂盒(A112-02,Vazyme);4%多聚甲醛(BL539A,biosharp);白细胞介素6(interleukin 6,IL-6)抗体(ab9324,abcam);肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)抗体(ab205587,abcam);核转录因子(nuclear factor kappa B,NF-κB)抗体(100745-1-AP,proteintech);磷酸化NF κB抗体(ab76302,abcam);信号传导转录激活因子3(signal transducer and activator of transcription 3,STAT3)抗体(10253-2-AP,proteintech);磷酸化STAT3抗体(9145T,CST);β-actin抗体(ab826,abcam);荧光二抗(ab150081,abcam)。
UPLC-MS/MS液质联用系统(Q Exactive HF,Thermo);冷冻干燥仪(alpha2-4,CHRIST公司);二氧化碳培养箱(310,Thermo公司);酶标仪(Spectramax iD,melecular公司);荧光显微镜(TE2000,nikon);化学发光&凝胶成像系统(Fusion Fx6 XT 型,Vilber Lourmat 公司);高内涵筛选分析仪(Cellomics ArrayScan VTI 600,Thermo)。
1.2.2 鸡血藤水煎液化学成分鉴定 取适量鸡血藤饮片以10倍水浸泡30分钟后,煎煮两次,每次1小时,合并水煎液冷冻干燥成粉末。分别精密称定鸡血藤粉末及FMNT对照品配制成溶液,使用UPLC-MS/MS液质联用系统、Agilent C18色谱柱(2.1 mm×100 mm,1.8 μm)进行鸡血藤水提物化学成分分析。
色谱条件:流动相为体积分数0.1%甲酸水溶液(A)-乙腈(B),洗脱梯度为:0~1分钟,95%A;1~3分钟,95%~70%A;3~11分钟,70%~35%A;11~14分钟,35%~15%A;进样量1 μL;流速0.3 mL/分钟;柱温25 ℃。
质谱条件:电喷雾电离(electrospray ionization,ESI),正离子模式(喷雾电压3.8 kV),负离子模式(喷雾电压-3.1 kV);毛细管温度320 ℃;鞘气流速45 arb;辅助气流速15 L/分钟;全扫描和二级扫描模式;质谱扫描范围m/z 200~1200。
1.2.3 雪旺细胞(Schwann cell,SCs)培养及分组 SCs培养于含10%胎牛血清和1%双抗的完全培养基中,培养条件为37℃、5%CO2。分为以下五组:空白对照组(25 mmol/L葡萄糖DMEM培养基+10%FBS),高糖模型组(150 mmol/L葡萄糖DMEM培养基+10%FBS),FMNT高剂量组(150 mmol/L葡萄糖DMEM培养基+10%FBS+100 nM FMNT),FMNT中剂量组(150 mmol/L葡萄糖DMEM培养基+10%FBS+10 nM FMNT),FMNT低剂量组(150 mmol/L葡萄糖DMEM培养基+10%FBS+1 nM FMNT)。
1.2.4 细胞活力测定 CCK8法检测细胞活力。将SCs接种于96孔板中按组别对应条件培养48小时后,每孔加入10 μL CCK8溶液孵育并测定450 nm处吸光度。细胞活力=(OD实验组-OD对照组)/(OD空白组-OD对照组)×100%。
1.2.5 细胞凋亡实验 TUNEL法检测细胞凋亡。将SCs接种于24孔板中按条件培养48小时,获得细胞爬片。用4%多聚甲醛固定,0.1% TritonX-100透化细胞,滴加TUNEL反应液于37 ℃避光孵育2小时。荧光显微镜观察细胞,每组随机选择3个视野,记录凋亡细胞和总细胞数目,计算细胞凋亡率。
1.2.6 高内涵实验 参考Yang等[4]方法,将SCs接种于96孔板中培养48小时后,弃去培养基,使用4%多聚甲醛进行固定,0.1%TritonX-100透化细胞后使用3%BSA封闭。弃去封闭液,分别加入100 μL的IL-6(1∶100)和TNF-α(1∶100)一抗于4℃条件下孵育过夜。使用对应荧光二抗(1∶200)于室温下孵育1小时,DAPI对细胞核进行染色。高内涵分析仪获取目标蛋白荧光图片及荧光强度。
1.2.7 Western Blot实验 将各组细胞按条件培养后吸弃培养基,用PBS洗涤后加入RIPA裂解液,获得细胞蛋白质。使用BCA法对总蛋白质含量进行测定,加入上样缓冲液煮沸变性,进行SDS-PAGE电泳分离蛋白并电转移到PVDF膜上,使用5%脱脂奶粉封闭1小时后,加入一抗于4 ℃下孵育过夜。使用的一抗有:NFκB(1∶2000)、p-NFκB(1∶1000)、Bcl2(1∶2000)、STAT 3(1∶2000)、p-STAT 3(1∶2000)、β-actin(1∶2000)。加入对应二抗(1∶20000)室温孵育1小时,TBST洗膜后加ECL发光液曝光,保存扫描结果。应用Image J软件获取条带灰度值,以β-actin为内参,计算蛋白相对表达量。
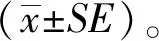
2 结果
2.1 鸡血藤活性成分的获取
基于TCMSP数据库共筛选出包括儿茶素、芒柄花黄素、β-谷甾醇、豆甾醇等化合物共24个化合物,见表1。
2.2 鸡血藤—DPN交集靶点蛋白互作网络(PPI network)及关键靶点筛选
经数据库筛选获得鸡血藤活性成分相关靶点150个,DPN相关靶点1533个,二者靶点经Venn分析后得到59个交集靶点(见图1A)。将59个交集靶点提交至String11.0平台并用Cytoscape3.7.1对PPI网络进行可视化,结果显示网络涉及52个节点,404条边。使用内置功能进行网络分析,设置节点大小反映连接度(degree)大小,即与节点相连的边越多,连接度值越大,节点也就越大(见图1B)。选取度值排名前五的靶点,即IL-6、AKT1、STAT3、JUN、MAPK1,认为是鸡血藤作用于DPN的关键靶点,其主要参数见表2。

注:A:鸡血藤—DPN靶点韦恩图;B:交集靶点PPI网络图。
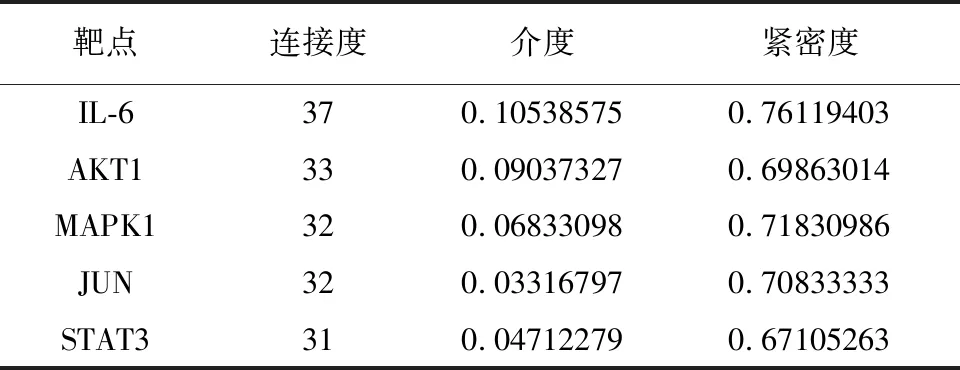
表2 关键靶点网络节点特征参数
2.3 交集靶点GO注释与KEGG通路富集分析结果
GO注释分析结果得到生物学过程1686条、分子功能93条、细胞组分81条共1860条信息。结果表明(见图2A),鸡血藤主要参与生物学过程包括对无机物质的反应、细胞对有机氮化合物的反应等,主要发挥的分子功能是细胞因子结合、蛋白激酶活性等,主要影响的细胞组分是膜筏、胞浆外区域等。
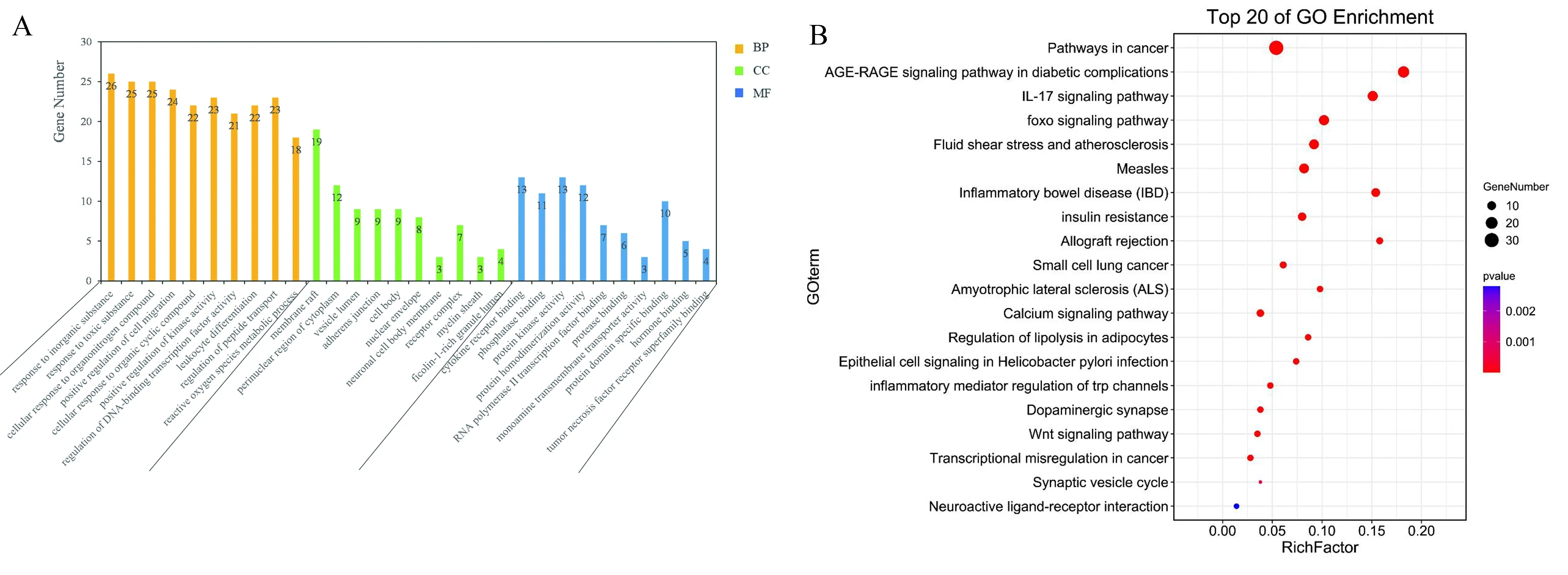
注:A:GO富集分析;B:KEGG通路富集分析。
KEGG通路富集分析表明交集靶点显著富集的通路有糖尿病并发症中AGE-RAGE信号通路、胰岛素抵抗通路等(见图2B)。
2.4 鸡血藤活性成分—靶点—通路网络
构建活性成分—靶点—通路图,通过内置插件分析鸡血藤治疗DPN网络拓扑学参数,认为鸡血藤发挥作用的关键化合物是木犀草素、芒柄花黄素、甘草查儿酮A、维斯体素、 β-谷固醇等,见图3、表3。
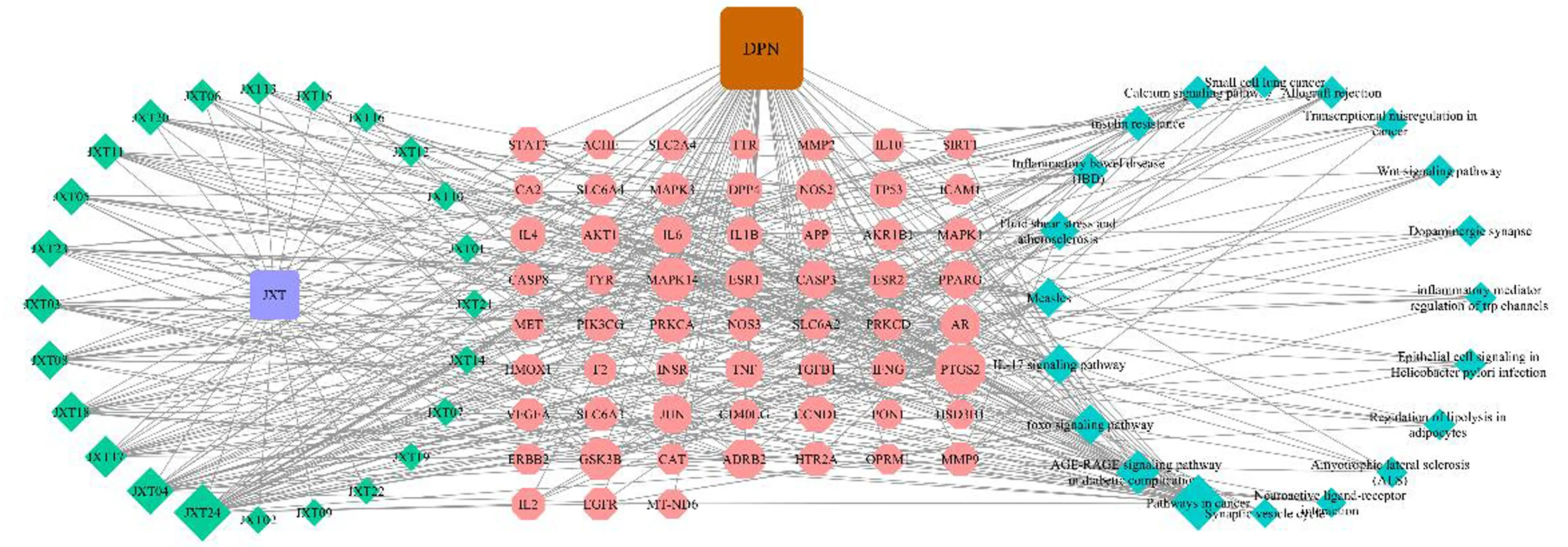
图3 鸡血藤活性成分—靶点—通路—DPN网络图
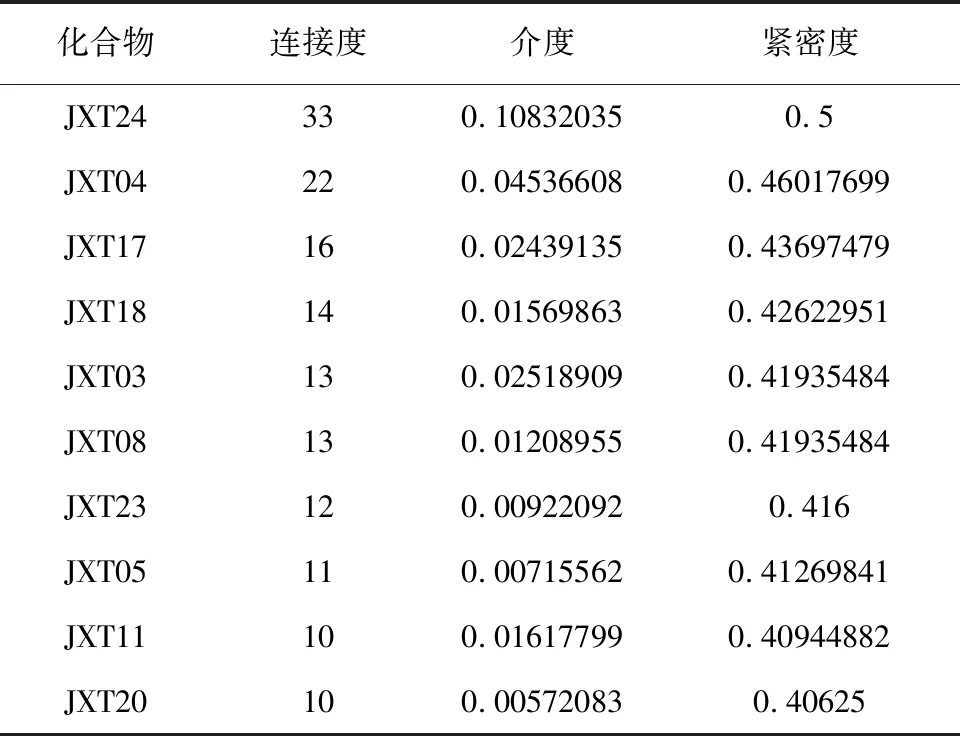
表3 鸡血藤治疗DPN的关键活性化合物网络节点特征参数
2.5 分子对接验证
将表2所得关键靶点和表3关键活性化合物进行分子对接。一般认为结合自由能<-5.0 Kcal/mol二者结合能力较高,结合自由能<-7.0 Kcal/mol二者结合能力高,可见鸡血藤关键活性化合物与关键靶点均有较好的结合(见图4)。

注:A:关键活性成分与关键靶点结合自由能;B:FMNT化学结构;C:FMNT与(1)IL-6(2)AKT1(3)MAPK1(4)STAT3结合模拟图。
2.6 鸡血藤水煎液化学成分鉴定
鸡血藤水煎液成分正离子图谱见图5,经与对照品及文献[5-6]比对,鉴定了以下9个化合物(见表4)。

图5 鸡血藤水煎液谱图

表4 鸡血藤水煎液UPLC-MS/MS分析
2.7 芒柄花黄素对高糖环境下SCs活性的影响
CCK8结果表明,高糖组细胞活性比空白对照组显著降低(P<0.01),经不同浓度FMNT治疗后,FMNT中低剂量组SCs活性比高糖组有明显提高(P<0.01)。见表5。

表5 FMNT对SCs细胞活力的影响
2.8 FMNT对高糖环境下SCs凋亡的影响
TUNEL结果表明,高糖处理后SCs中呈绿色的凋亡细胞比例增加,而经过FMNT处理后,凋亡细胞比例降低,表明FMNT可以减少高糖引起的SCs凋亡。发挥抗凋亡作用的Bcl2经高糖处理后表达明显降低(P<0.01),给与FMNT后可以逆转了这一现象。进一步证实FMNT可以减少高糖引起的SCs凋亡。见图6~7,表6~7。

图6 各组SCs的TUNEL染色
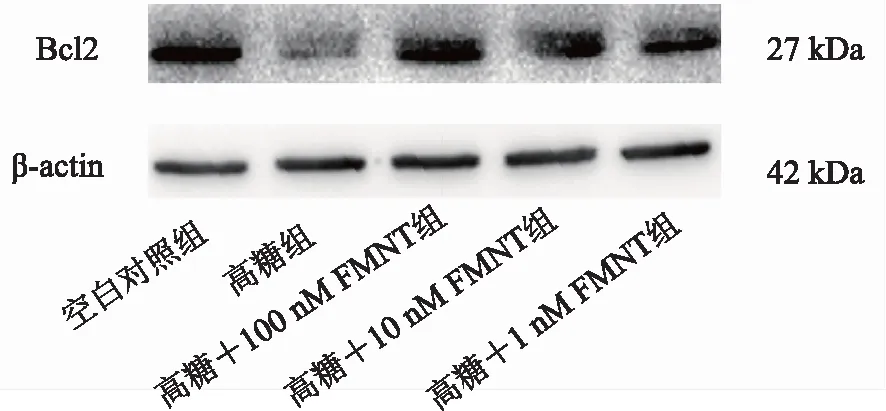
图7 各组SCs的Bcl2的表达

表6 FMNT对SCs凋亡的影响

表7 FMNT对SCs的Bcl2表达的影响
2.9 FMNT对高糖环境下SCs中IL-6、TNF-α表达的影响
由于SCs并不能像炎症细胞一样能够产生大量的炎性因子,ELISA法难以测出低于常规检出限的炎性因子,因此采取高内涵法测定IL-6和TNF-α的水平。结果表明,高糖环境下的SCs中IL-6和TNF-α的表达水平升高,说明高糖环境下SCs发生了炎症反应[与空白对照组比较,差异有统计学意义(P<0.01和P<0.05)],而经过 FMNT的处理后,二者的表达水平显著降低[与高糖组比较,FMNT中低剂量组作用明显(P<0.05,P<0.01)],表明 FMNT可以抑制高糖环境下SCs的炎症反应。见图8、表8。

表8 FMNT对SCs的IL-6、TNF-α表达的影响
2.10 FMNT对高糖环境下SCs中STAT3-NF κB信号通路的影响
Western Blot法测定经典炎症通路NF κB及其磷酸化蛋白表达和上游磷酸化STAT3表达水平,验证FMNT对高糖环境下SCs的的影响。与空白对照组相比,高糖组p-NF κB/NF κB表达显著增加(P<0.05),p-STAT3表达明显增加(P<0.05);与高糖组相比,FMNT高、低剂量组p-NF κB/NF κB表达降低(P<0.05),FMNT中低剂量组p-STAT3表达显著降低(P<0.01)。见图9~10,表9。

图9 各组SCs的p-NF κB/NF κB的表达

图10 各组SCs的p-STAT3的表达

表9 FMNT对SCs中STAT3-NF κB信号通路的影响
3 讨论
DPN作为糖尿病常见并发症,具有高致死率、高致残率的特点,寻求高效低毒的药物一直是研究的热点[1]。鸡血藤具有良好的补血活血功效,临床常用于治疗DPN。中药具有多成分—多靶点—多途径共同调节的特点,本研究基于网络药理学方和分子对接技术筛选鸡血藤治疗DPN的主要活性成分及潜在靶点,试图探讨其治疗DPN的可能机制。
网络药理学及分子对接结果表明,鸡血藤治疗DPN的核心化合物可能是木犀草素、FMNT、甘草查儿酮A、维斯体素、 β-谷固醇。有研究认为,木犀草素具有抗氧化作用,通过降低活性氧和丙二醛水平、增加神经中Nrf2表达,减轻糖尿病大鼠的感觉异常增加神经传导速度[7];β-谷固醇通过改善胰岛素分泌、抑制α-葡萄糖苷酶、降糖和抗氧化作用从而改善DPN大鼠的感觉异常,起到神经保护的作用[8];FMNT可以有效降低DPN大鼠血糖,降低胰岛素抵抗,通过增加坐骨神经组织中SIRT1和NGF表达提高神经传导速度,减少坐骨神经组织的氧化应激[9]。由此可见,鸡血藤中不同类型化合物均对DPN有一定的效果,但是鸡血藤化学成分复杂,何种物质主要发挥作用并不明晰。因此相较于针对鸡血藤化学成分研究,本研究更关注常用的水煎液成分。使用UPLC-MS/MS系统对鸡血藤水煎液化学成分进行鉴定,结果表明其主要化合物为黄酮类及其苷类,如FMNT及芒柄花苷。结合网络药理学及文献报道,本研究选择FMNT作为鸡血藤治疗DPN的关键化合物开展作用机理验证。
DPN发病机制复杂,涉及多个基因及信号通路,包括神经炎症、晚期糖基化终末产物堆积等[10],而周围神经系统中形成神经轴突髓鞘的SCs因其能够在神经修复和再生中起到关键作用,被认为是DPN的主要靶点[11]。网络药理学结果表明,鸡血藤通过影响糖尿病的晚期糖基化终末产物通路作用于IL-6、STAT3、AKT、MAPK1、JUN等靶点从而起到治疗DPN的作用,分子对接实验证实FMNT与以上靶点均有较好的结合。文献研究表明,长期高血糖会使葡萄糖与蛋白质氨基反应的产物不断堆积生成不可逆的糖基化产物,即AGEs,堆积在周围神经表面,与细胞表面的受体,如RAGEs结合,引起下游一系列有害信号级联,包括预测靶点中IL-6、STAT3涉及的炎症相关通路,如NF κB信号通路[12],以及AKT、JUN涉及的凋亡相关通路[13],最终造成SCs凋亡。IL-6是NF κB下游的炎症指标,其表达水平在DPN患者体内显著升高[14]。当周围神经损伤时,损伤部位近端轴突观察到磷酸化的STAT3,存在STAT3-IL-6信号轴将免疫反应从SCs传递到感觉神经元[15];此外,在高糖环境下的SCs中也观察到磷酸化STAT3表达升高[16]。因此本研究对糖尿病中AGE-RAGEs信号通路的下游炎症相关通路即STAT3-NF κB通路进行了实验验证。
在本研究中,采用DPN细胞模型—高糖环境下SCs,探讨鸡血藤中主要化合物FMNT的作用。实验结果表明,高糖环境增加了SCs的炎症因子IL-6和TNF-α的表达,增加p-NF κB表达量,虽未影响非磷酸化的STAT3表达量,但显著提高了p-STAT3水平,意味着STAT3-NF κB炎症通路被激活,导致SCs细胞活力降低,凋亡增加。而经FMNT处理后,逆转了高糖带来的不利影响,增加高糖环境下SCs的细胞活力,减少了SCs凋亡,说明FMNT可以保护高糖环境下的SCs,这与抑制STAT3-NF κB通路减少炎症因子有关。
鸡血藤作为临床常用于治疗DPN的药物,其疗效显著,但其发挥作用的物质基础及作用机制并不明晰。通过本研究对鸡血藤水煎液进行了化学成分鉴定,并运用了网络药理学研究方法,建立了“化合物—靶点—通路”网络,对鸡血藤作用于DPN的作用机制进行了探究。但由于网络药理学方法从理论层面预测鸡血藤的作用机制较为宽泛且针对性不强,本研究只对STAT3-NF κB信号进行了初步验证,但该通路是否是治疗DPN的主要通路?通过通路的阻断或基因敲高或敲低将能更加明晰其作用机制。其他作用机制是否也参与发挥作用,尚需进一步深入研究。
