MTT-分光光度法快速测定地衣芽孢杆菌发酵液活菌数的研究
2023-10-11甄丽王婕朱彩彩程娇梅
甄丽,王婕,朱彩彩,程娇梅
( 青岛蔚蓝生物集团有限公司,山东 青岛 266102 )
活菌计数方法广泛应用于对比试验方案、优化发酵指标、测定发酵生长曲线、评价产品性状等方面[1]。常用的活菌计数方法有平板稀释计数法、直接染色观察法、比浊法、菌体干重法等[2]。平板稀释计数法可准确反映出活菌含量,但操作烦琐、耗时长;其他几种活菌计数方法无法区别细菌细胞的死活,且易受到培养基、菌体代谢产物等因素的影响[3]。噻唑蓝(MTT)是一种噻唑盐,广泛应用于动物细胞活性计数、生物因子活性检测、细胞毒性试验、抗肿瘤药物筛选等[4-5]。MTT法原理为活性细胞内的琥珀酸脱氢酶将MTT还原成蓝紫色的结晶物甲臜[6],形成的甲臜量与活性细胞数量成正比,而死细胞无此反应[7-8]。加入四氯化碳溶解反应生成的甲臜[9],在一定波长下的吸光度可间接反映活细胞的数量[10-11]。活菌细胞同样可在酶的作用下产生甲臜[12],因此,MTT法成为一种快速的活菌检测方法[13]。地衣芽孢杆菌可调节动物肠道环境,作为动物饲料添加剂具有广阔的应用前景[14]。地衣芽孢杆菌活菌量是发酵水平和产品质量的重要指标,因此研究一种能够快速、准确检测活菌数的方法具有重要意义。本试验在新鲜菌液中加入MTT后立即计时,一定时间后加入盐酸溶液使地衣芽孢杆菌失活终止显色反应,将四氯化碳加入反应溶液中萃取甲臜,检测萃取液的吸光度[15],最终通过计算测定地衣芽孢杆菌发酵液生长情况,以此优化菌液中地衣芽孢杆菌含量的检测方法并为MTT-分光光度法应用于活菌计数提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试剂与培养基
PBS溶液配制:8 g氯化钠、1.15 g磷酸氢二钾、0.2 g磷酸二氢钾、去离子水定容至1 000 mL,pH值7.2,121 ℃灭菌15 min[16]。
MTT(阿拉丁试剂(上海)有限公司)溶液配制:0.5 g MTT溶于100 mL灭菌的PBS中。
1.0 mol/L盐酸配制:9 mL盐酸缓慢注入去离子水中,定容至100 mL。
四氯化碳:由国药集团化学试剂有限公司提供。
地衣芽孢杆菌发酵培养基:玉米粉20 g、葡萄糖15 g、磷酸氢二钾3 g、磷酸二氢钾1.5 g、硫酸镁0.5 g、硫酸锰0.2 g、硫酸亚铁0.1 g、碳酸钙0.1 g、去离子水1 000 mL,pH值7.2,121 ℃灭菌15 min。
LB培养基:蛋白胨10 g、酵母粉5 g、氯化钠10 g、去离子水1 000 mL,pH值7.0,121 ℃灭菌15 min。
1.1.2 试验菌液
试验所使用的菌液为青岛蔚蓝生物集团有限公司地衣芽孢杆菌新下罐发酵液。
1.1.3 仪器设备
TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司);5.0、1.0、0.2 mL eppendorf移液器(艾本德中国有限公司);THERMO SCIENTIFIC 2864型循环水浴锅(赛默飞世尔科技公司);7 mL离心管等。
1.2 试验方法
1.2.1 MTT-分光光度法测定步骤
在无菌7 mL离心管中加入灭菌PBS适当稀释后的新鲜发酵菌液1 mL,37 ℃水浴保温5 min,依次加入1 mol/L盐酸1 mL和一定量MTT溶液。放置室温后,加入2 mL四氯化碳,充分混匀后,显色10 min,吸取下清液作为比色的空白对照[17]。
在无菌的7 mL离心管中加入灭菌PBS适当稀释的新鲜发酵菌液1 mL,37 ℃水浴保温5 min,加入一定量MTT溶液,准确计时相应时间后加入1 mol/L盐酸终止反应。放置室温后,加入2 mL四氯化碳,显色10 min,吸取下清液,以空白对照调零,测定吸光度。
1.2.2 稀释平板法测定
每份发酵样品10倍系列稀释,取相应稀释样品0.1 mL涂布于NA培养皿,36 ℃培养18 h,采用稀释平板法计数发酵菌液中的活菌量。之后分析MTT-分光光度法与平板法的对应关系[18]。
1.3 MTT-分光光度法优化
1.3.1 显色反应终止液最适浓度
试验选择2.0、1.0、0.5 mol/L的盐酸溶液作为显色反应的终止液。取1 mL地衣芽孢杆菌发酵液,分别加入上述浓度的盐酸溶液1 mL,充分混匀后测定pH值和地衣芽孢杆菌的活菌数,确定显色反应终止液最适浓度。
1.3.2 最适吸收波长
不同类型的菌株产生的二甲基亚砜甲臜溶液的最大吸收峰不同[17]。因此,本试验以450~650 nm为扫描范围,测定吸光度(OD值)[19],确定最适吸收波长。
1.3.3 最适MTT添加量
相同的发酵菌液反应体系中分别加入0.1、0.2、0.3、0.4、0.5 mL的MTT溶液,反应1 h,测定OD值[19]以确定最适MTT添加量。
1.3.4 最适反应时间
相同的发酵菌液加入0.2 mL的MTT溶液,反应时间分别为0.5、1.0、1.5、2.0、2.5 h,测定OD值[19]以确定最适反应时间。
1.3.5 最适菌液浓度
将发酵菌液稀释0、10、100、1 000倍,同时按照1.2.1和1.2.2中步骤进行MTT-分光光度法、稀释平板法试验。菌液中加入0.2 mL MTT溶液,反应1 h,测定发酵菌液的OD值,并与稀释平板法测定的活菌量进行分析[20-21]。每个稀释倍数设3个重复。
1.3.6 不同培养基、培养液保存后和其他干扰物对测定结果的影响
分别测定地衣芽孢杆菌发酵培养基发酵液、LB培养基发酵液、100 ℃煮沸10 min灭菌后的LB培养基发酵液、4 ℃储存24 h后的发酵液、MTT溶液、PBS溶液、空白LB培养基对本方法检测结果的影响[17]。
2 结果与分析
2.1 MTT-分光光度法最适条件
2.1.1 不同浓度盐酸溶液对地衣芽孢杆菌活性的影响(见表1)

表1 不同浓度盐酸溶液对地衣芽孢杆菌活性的影响Tab.1 Effects of different concentrations of hydrochloric acid on the activity of Bacillus licheniformis
由表1可知,1.0 mol/L的盐酸可降低地衣芽孢杆菌的活菌数,可使甲臜的显色反应迅速终止,从而得到精确的控制反应时间。
2.1.2 不同波长对吸光度的影响(见图1)
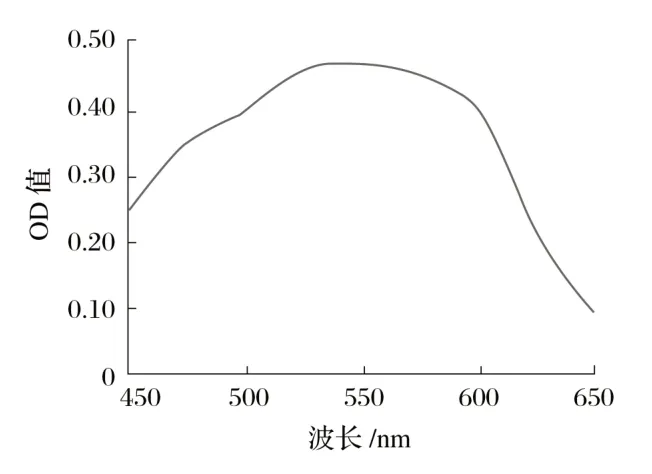
图1 不同波长对吸光度的影响Fig.1 Effect of different wavelengths on absorbance
由图1可知,波长在550 nm时,地衣芽孢杆菌吸光度最大。因此,地衣芽孢杆菌的最适吸光度为550 nm。
2.1.3 不同MTT添加量对发酵菌液吸光度的影响(见图2)

图2 不同MTT添加量对发酵菌液吸光度的影响Fig.2 Effect of different MTT supplemental levels on absorbance of fermented bacterial solution
由图2可知,在一定范围内增加MTT添加量可使吸光度增大,当MTT含量为0.2 mL时,吸光度最大。MTT添加量超过0.2 mL后,随着添加量增大,吸光度呈降低趋势。
2.1.4 不同反应时间对发酵菌液吸光度的影响(见图3)

图3 不同反应时间对发酵菌液吸光度的影响Fig.3 Effect of different reaction time on absorbance of fermentation liquid
由图3可知,反应时间在30~60 min范围内,延长反应时间可显著增加吸光度;超过60 min后,随着反应时间增加,吸光度会有一定程度的增加。但考虑到时间成本,选择反应时间为60 min。
2.1.5 不同菌液浓度对测定结果的影响(见表2)

表2 不同菌液浓度对测定结果的影响Tab.2 Effect of different concentration of bacterial solution on determination results
由表2可知,菌液浓度为108~109CFU/mL时,OD550nm值与稀释平板法得到的活菌数具有很好的线性对应关系,当菌液浓度<108CFU/mL时对应关系不再成立。
由此可知,MTT分光光度法测定地衣芽孢杆菌发酵液,菌液浓度最低应≥108CFU/mL。
2.1.6 干扰物和菌液储存后对测定结果的影响(见表3)

表3 各种干扰物和菌液储存后对测定结果的影响Tab.3 Effect of various interferences and bacterial solutions on assay results after storage
由表3可知,MTT-分光光度法测定地衣芽孢杆菌的菌量不受空白培养基、灭活培养液和其他干扰物的影响,均可快速地测定发酵液的OD值,通过OD值即可准确地计算出发酵液的活菌数。但该方法检测的发酵液必须是新鲜培养的菌液,4 ℃储存后地衣芽孢菌代谢活性下降,无法采用本方法进行检测。
2.2 MTT-分光光度法与稀释平板法的线性关系
取6支灭菌后的7 mL离心管,依次加入地衣芽孢杆菌新鲜菌液和灭菌PBS溶液。充分混匀后,在37 ℃水浴中保温5 min,加入0.2 mL MTT溶液,反应1 h后加1.0 mol/L盐酸1 mL,电磁振荡3 s终止反应。取出放置室温后加入2 mL四氯化碳,充分混匀后静置10 min,吸取1号离心管中的下清液作为空白对照,在550 nm波长下测定其他各离心管中下清液的OD值。同时使用稀释平板法测定每支离心管内的活菌量,结果见表4。

表4 离心管中发酵液、灭菌PBS添加量及相应的吸光度、活菌量Tab.4 Dosage of fermentation liquid and sterilized PBS solution in centrifuge tube and corresponding absorbance and viable bacteria value
以MTT-分光光度法测得的OD550nm值为纵坐标,稀释平板法得到的活菌量为横坐标绘制回归曲线,得到方程y=0.066 0x-0.0150,R2=0.998 1(见图4)。

图4 MTT分光光度法与稀释平板法的线性关系Fig.4 Linear relationship between MTT-spectrophotometry and dilution plate method
2.3 MTT-分光光度法、稀释平板法测定发酵液中活菌量结果对比(见表5)

表5 MTT-分光光度法、稀释平板法测定发酵液中活菌量结果对比Tab.5 Comparison of results of MTT-spectrophotometry and dilution plate method for determination of viable bacteria in fermentation broth
采用MTT-分光光度法和稀释平板法分别测定青岛蔚蓝生物集团有限公司研发中心5批不同的地衣芽孢杆菌发酵液,MTT-分光光度法测定得到的OD值换算为计算活菌量与稀释平板法得到的活菌量进行对比。
由表5可知,5次测定吸光度OD550nm的RSD值最高为1.86%,小于5.0%,符合定量检测方法要求。
3 讨论
地衣芽孢杆菌是一种具有抗逆性强、酶系丰富、产酶量高、安全稳定等多种优良特性的菌株。地衣芽孢杆菌在医药、畜牧业、工农业、环境保护等各个领域中应用前景广泛[22],是最早实现产业化且迄今为止用途最广、产量最大的菌株类型[23]。随着生产规模增加,快速高效地测定地衣芽孢杆菌含量的方法亟待开发。
MTT-分光光度法作为一种间接测定方法,测得的吸光度反映的是地衣芽孢杆菌新鲜发酵液活菌量的相对值。MTT-分光光度法应用的前提在于先建立待测菌株的稀释平板法活菌数与MTT分光光度法吸光度之间的回归关系曲线,不同菌株的回归曲线不同。此外,使用MTT-分光光度法测定活菌量时,待测菌液浓度必须调整到适用范围内。本研究结果显示,当发酵液活菌量<108CFU/mL时,由于系统误差造成的数据偏差相对于测定结果已经非常显著,因而线性关系弱化,此方法不适用。
4 结论
本研究结果显示,新鲜发酵液中地衣芽孢杆菌活菌量>108CFU/mL时,使用MTT-分光光度法测定发酵液中活菌总数具有线性稳定、可重复性好、试验周期短的特点,而且不受不同培养基、菌体代谢产物、死菌体以及其他物质的干扰。结果表明,MTT-分光光度法可作为科研、生产中快速测得活菌量的方法。
