和田羊FGF5基因RNA干扰载体构建及筛选
2023-10-11曹少奇陈岩高新梅喻恒彬王静胡广东
曹少奇,陈岩,高新梅,喻恒彬,王静*,胡广东*
( 1.新疆维吾尔自治区畜牧总站,新疆 乌鲁木齐 830000 ; 2.石河子大学动物科技学院,新疆 石河子 832061 )
和田羊是历史悠久的地方半粗毛羊品种,但由于育种工作落后,导致生产性能发生退化。因此,对控制和田羊羊毛的性状相关基因进行深入研究,进一步改善和田羊的羊毛品质,对和田羊种质资源的开发与保护具有重要意义[1]。毛囊是支持哺乳动物毛发形成和生长的重要器官,其周期受血管内皮细胞生长因子[2]、骨形态发生蛋白4[3]、胰岛素样生长因子1[4]、FGF5[5]等多种信号分子的调控,FGF5是控制毛囊从生长期向退行期转换的关键因子[6]。FGF5由3个外显子和两个内含子构成,具有调控毛囊周期的功能,是调节毛发生长的重要因子之一。在对小鼠、驴、犬、猫、人的试验中均发现FGF5基因的表达量与毛发生长有关,也有研究发现FGF5基因的表达与绒山羊的羊绒生长有关[7]。综上,沉默或敲除FGF5因子研究其对动物产毛性状的影响,对提高产毛动物的毛产量具有重要意义。
对绒山羊中使用RNAi技术进行FGF5敲除试验,结果表明,RNAi技术可有效降低FGF5的表达[8-9],且FGF5敲除后对绒山羊的血液生理生化指标[10]、发情能力[11]无显著影响。本研究中设计并合成了4个shRNA,将其与pGPU6/GFP/Neo质粒连接构建干扰表达载体,将干扰载体转染至和田羊成纤维细胞,检测其对和田羊FGF5基因的mRNA和蛋白表达水平的干扰效率,筛选出干扰效率最强的shRNA,为进一步探讨和田羊中FGF5基因的作用机制、改善和田羊毛质量奠定基础。
1 材料与方法
1.1 试验材料
试验用和田羊由石河子大学兽医站饲养,剪取和田羊耳部组织分离培养获得成纤维细胞。
大肠杆菌DH5α购自天根公司;质粒pGPU6/GFP/Neo购自上海吉玛技术有限公司。
胎牛血清(FBS)、DMEM培养基、0.25%胰蛋白酶购自Gibco;20×PBS、质粒提取试剂盒(上海生工生物工程有限公司);青霉素-链霉素(HyClone);Trizol(Invitrogen公司);反转录试剂盒、荧光定量试剂盒(TaKaRa公司);抗GADPH鼠单克隆抗体、抗FGF5鼠单克隆抗体、辣根过氧化物酶标记山羊抗小鼠IgG(Abcam公司)。
CO2培养箱(Thermo公司)、超净工作台(日本日立公司)、LightCycler 96实时荧光定量PCR仪(罗氏公司);垂直电泳仪、凝胶成像系统、半干转膜仪(美国BIO-RAD公司);水平板电泳仪(上海天能科技有限公司)。
1.2 和田羊FGF5基因靶向寡核苷酸的设计与制备
依据和田羊FGF5基因CDS区与shRNA的设计原则,使用Life Technologies公司网站(http://www.lifetechnologies.com/cn/zh/home/brands/ambion.html)中的shRNA target design工具,设计得到4条长度为54 bp的shRNA干扰片段PR-FGF1、PR-FGF2、PR-FGF3、PR-FGF4和1条长度为51 bp的阴性对照片段PR-FGF5,片段序列信息见表1。

表1 FGF5 RNA干扰片段序列信息Tab.1 FGF5 RNA interference fragment sequence information
shRNA干扰片段上下游分别引入BamH Ⅰ酶切位点和Bbs Ⅰ酶切位点,由上海生工生物工程有限公司合成相应的shDNA单链。
1.3 RNA干扰载体的构建
将所得的单链shDNA使用20 μL体系(Sense 1 μL、10×SSC 1 μL、Anti-Sence 1 μL、ddH2O补齐)进行退火连接;反应条件为95 ℃变性10 min,室温冷却1 h;获得双链shDNA。
4条干扰片段分别命名为shRNA-FGF1、shRNAFGF2、shRNA-FGF3、shRNA-FGF4,阴性对照片段命名为shRNA-FGF5。使用限制性内切酶BamH Ⅰ和Bbs Ⅰ对质粒pGPU6/GFP/Neo进行双酶切鉴定,1%琼脂糖凝胶电泳对酶切产物进行回收,得到线性化的质粒pGPU6/GFP/Neo。将合成的5条双链shDNA,分别与线性化的pGPU6/GFP/Neo质粒4 ℃过夜连接,连接产物转化入感受态细胞中,过夜挑取单菌落至培养管,摇菌扩大培养,进行质粒提取后获得重组质粒。重组质粒利用BamH Ⅰ进行单酶切鉴定后,经琼脂糖凝胶电泳鉴定,送至上海生工生物工程有限公司测序。
1.4 重组质粒酶切鉴定
重组质粒酶切体系为:10×buffer H 1 μL,BamH Ⅰ酶0.5 μL,BSA(10 g/L)0.25 μL,质粒4 μL,灭菌超纯水补至10 μL。离心混匀后,置37 ℃水浴2 h;65 ℃经10 min灭活内切酶,10 g/L琼脂糖凝胶电泳鉴定。
1.5 细胞培养和细胞转染
采取和田羊耳部组织块,使用PBS溶液(含有50万单位青霉素-链霉素)清洗,之后用75%酒精浸泡2 min,再次使用PBS溶液仔细清洗。在超净工作台中将组织块表皮去除,在PBS溶液中将组织块剪碎至糊状,使用PBS溶液离心清洗3~5遍,胰酶消化后再次使用PBS溶液离心清洗3~5遍,将清洗后的组织块种至60 mm培养皿中,在细胞培养箱(37 ℃、5% CO2)中放置5 min,待组织块贴壁后取出,在培养皿中添加含有10% FBS的DMEM/DF12完全培养基(含有20万单位青霉素-链霉素),放入细胞培养箱中培养,2 d后更换培养基,4 d后可见耳部组织块周围迁移出成纤维细胞,2 d更换一次培养基继续培养至细胞数量可用。利用电刺激转染的方式将5种RNA干扰载体转染至成纤维细胞,24 h后观察绿色荧光蛋白GFP6表达情况。
1.6 RT-PCR检测FGF5 mRNA表达水平
电转染24 h后,使用TRIzol试剂盒提取各组细胞的总RNA,反转录为cDNA通过RT-PCR检测细胞样品中FGF5基因表达量,重复3次。定量引物序列为:AAGACTGGGCGGGAGTGGTA;GGCTTGACGGGATTAGGTG。采用2-ΔΔCt法计算FGF5基因的相对表达量。
1.7 WB检测FGF5蛋白表达水平
电转染36 h后,弃掉培养液,使用RIPA裂解液裂解各组细胞提取细胞总蛋白,BCA蛋白定量试剂盒测定总蛋白浓度并计算出SDS-PAGE电泳上样量,电泳至溴酚蓝刚跑出,半干转法转膜,之后用5%脱脂奶粉室温摇床孵育,封闭1 h。剪取一次性塑料手套指头部分,将膜放入其中,将稀释好的一抗滴到膜上,使用封口机封口,4 ℃过夜孵育。TBST洗膜2次,向50 mL离心管中加入稀释过的二抗,将膜放入其中,室温摇床孵育1 h,TBST洗膜2次。使用HRP-ECL发光法进行鉴定,确定FGF5蛋白表达量。
1.8 数据统计与分析
使用SPSS 19.0统计学软件对转染后的成纤维细胞中FGF5基因表达量进行单因素方差分析。P<0.05表示显著差异,P<0.01表示极显著差异。
2 结果与分析
2.1 和田羊FGF5基因shRNA干扰载体的构建与鉴定结果
将合成的5条寡聚核苷酸片段与pGPU6/GFP/Neo载体连接,转化、挑菌、摇菌、质粒提取,获得重组质粒。重组质粒利用BamH Ⅰ进行单酶切鉴定,经琼脂糖凝胶电泳鉴定,重组质粒pGPU6-shRNA BamH Ⅰ单酶切鉴定结果见图1。

图1 重组质粒pGPU6-shRNA BamH I单酶切鉴定Fig.1 Gel electrophoresis of recombinant interference vector with single enzyme digestion
由图1可知,BamH Ⅰ单酶切后5个重组质粒均只出现1条条带,且大小符合预期。将提取的质粒送公司测序,测序结果与设计序列相符,表明4个干扰表达载体均构建成功,pGPU6-shRNA载体图谱见图2。
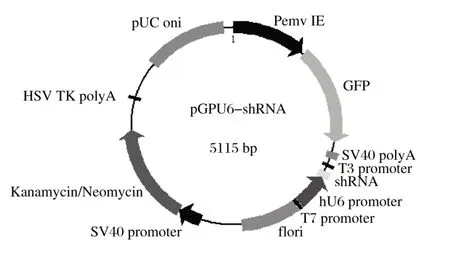
图2 pGPU6-shRNA载体图谱Fig.2 PGPU6-shRNA vector map
将5个pGPU6-shRNA的载体分别命名为pGPU6-shRNA-FGF1(即PR-FGF1)、pGPU6-shRNA-FGF2(即PR-FGF2)、pGPU6-shRNA-FGF3(即PR-FGF3)、pGPU6-shRNA-FGF4(即PR-FGF4)、pGPU6-shRNAFGF5(即PR-FGF5)。
2.2 绵羊耳部成纤维原代细胞及质粒转染细胞(见图3)

图3 绵羊耳部成纤维原代细胞及质粒转染细胞Fig.3 Sheep ear fibroblasts primary cells and plasmid transfected cells
由图3(a)可知,培养2 d后组织块周围迁移出绵羊耳部成纤维细胞;由图3(b)可知,组织块培养培养4 d后成纤维细胞的细胞密度约为80%。
利用电激转染的方式将5种RNA干扰载体转染至成纤维细胞,24 h后通过荧光显微镜观察荧光情况。
由图3(c)、3(d)可知,转染后细胞可见绿色荧光,表明成纤维细胞中开始表达外源绿色荧光蛋白,干扰载体转染成功。
2.3 干扰载体对FGF5基因沉默效率检测结果
以转染阴性质粒PR-FGF5的成纤维细胞为对照,采用qRT-PCR检测成纤维细胞转染4个干扰载体和阴性质粒后FGF5基因mRNA表达量,结果见图4。

图4 重组质粒转染后FGF5 mRNA表达量Fig.4 Expression of FGF5 mRNA after transfection with recombinant plasmid
由图4可知,4个shRNA干扰表达载体均能够不同程度干扰成纤维细胞中FGF5 mRNA的表达。PR-FGF1组、PR-FGF2组、PR-FGF3组、PR-FGF4组干扰效率分别为23.91%、58.85%、85.20%、43.59%,均显著低于PR-FGF5组(P<0.05),其中重组质粒PR-FGF3对FGF5基因的干扰效率最高。
以转染阴性质粒PR-FGF5的成纤维细胞为对照,以GAPDH为内参蛋白,采用WB检测成纤维细胞转染4个干扰载体和阴性质粒后FGF5蛋白表达量,结果见图5。

图5 重组质粒转染后FGF5蛋白表达量Fig.5 Expression level of FGF5 protein after transfection with recombinant plasmid
由图5可知,与PR-FGF5组相比,PR-FGF1组、PRFGF2组、PR-FGF3组、PR-FGF4组中FGF5蛋白表达量均明显降低。其中,PR-FGF3组中FGF5蛋白表达量降低最显著,WB结果与qRT-PCR结果趋势相同。
结果表明,PR-FGF3 RNA干扰片段抑制FGF5基因表达效果最佳。
3 讨论
成纤维细胞生长因子(FGFs)属于多肽类生长因子,通过与酪氨酸激酶型FGF受体(FGFRs)结合发挥作用[12]。目前在单细胞动物中并未发现FGFs基因,已发现的FGFs与FGFR基因全部存在于多细胞动物中。线虫中存在两种FGFs,人和小鼠中存在23种FGFs,因此,FGFs基因种类可能随着生物的进化不断增多,并构成越来越复杂的调控网络,参与更多的生物学功能。据此,深入研究FGFs及其受体FGFRs基因的调控网络将为研究动物生长、生理调控过程和演化中生物功能的变化奠定基础。
FGF5是FGFs家族的一员,广泛存在于多种哺乳动物中。但有研究发现,不同动物中FGF5蛋白存在明显的区别,目前,FGF5在人和小鼠体内的主要作用是调控毛囊生长,是已知最有效的诱导毛囊从生长期转换到休止期的因子。FGF5在毛囊生长期末期高表达,可促进毛囊从生长期至退行期的转换,从而抑制毛发生长[13]。采用RNAi技术或FGF5抑制剂对FGF5基因进行抑制后,FGF5蛋白表达量降低,毛囊生长期被延长。
与野生型小鼠相比,通过基因打靶技术敲除FGF5基因的小鼠毛发生长速度明显升高[14],FGF5基因敲除的绵羊羊毛长度和产量均有所提高[15]。研究表明,FGF5抑制因子对人类脱发具有治疗效果[16],也可以促进小鼠毛发生长[17]。FGF5能够改变真皮乳头细胞的活性,抑制真皮乳头细胞介导的外跟梢细胞的增殖,进而调控毛囊周期,抑制毛发生长,诱导毛发再生[18]。研究发现,将绵羊的FGF5敲除后,FGFR1、雄激素、Wnt/β-catenin、Shh/Gli2、c-MYC等因子产生了变化并存在一些相互作用[19]。有研究表明,FGF5可影响绵羊毛囊发育与毛发生长[20]。综上所述,在生物、细胞、分子水平上继续深入研究FGF5对毛发发育的影响具有重要的意义和较高的可行性。
本研究通过RNAi技术构建并筛选出了干扰效率达到85.2%的和田羊成纤维细胞FGF5基因干扰载体,可作为后续和田羊FGF5的RNAi序列,为研究FGF5对和田羊羊毛生长的调控、改善和田羊羊毛质量提供技术支持。在此基础上,可进一步在其他毛囊相关细胞中进行FGF5敲除试验,以探究FGF5在毛囊周期调控网络中的作用;同时可将FGF5基因干扰与FGF5抑制剂进行对比,探究FGF5抑制剂应用于和田羊毛生产的可能性。
4 结论
本研究构建并筛选出了和田羊FGF5基因的干扰表达载体,经细胞验证可高效干扰和田羊FGF5基因的表达,可应用于和田羊FGF5基因功能的研究中。
