从CaM-MLCK信号通路探究不同频率摩腹对脾虚家兔的手法效应
2023-10-10蔡伟蓝王继红许嘉英张强任雪晗黄志凯
蔡伟蓝,王继红,许嘉英,张强,任雪晗,黄志凯
(广州中医药大学,广东广州 510405)
摩法为推拿基础手法之一,《礼记·内则》曰:“濯手以摩之,去其皽。”《素问·病能》曰:“摩之切之。”摩腹作为摩法治疗脾胃病变的重要手法之一,通过摩法和腹部穴位结合,可调理脾胃功能,达到健脾的作用[1]。正如《理瀹·骈文》所言:“后天之本在脾,调中者摩腹。”脾虚证是中医学常见的证型,主要表现为胃纳差、脘腹胀满、大便稀溏等消化系统功能低下状态,与胃肠动力障碍有密切联系[2-3]。现代医学研究[4]表明,胃肠动力障碍与胃肠平滑肌收缩、舒张有关,而钙调蛋白(CaM)-肌球蛋白轻链激酶(MLCK)信号通路是典型的胃肠道平滑肌信号通路。本课题组前期研究[5]表明,摩腹可以治疗脾虚家兔,改善脾虚症状。为进一步分析摩腹的手法效应,探讨摩腹改善脾虚家兔胃肠动力机制,本研究从CaM-MLCK 信号通路切入,观察不同频率摩腹干预对通路中关键蛋白CaM、MLCK 的影响,以期为摩腹临床治疗脾虚证提供参考,现将研究结果报道如下。
1 材料与方法
1.1 动物SPF级成年新西兰SD家兔72只,体质量(2.0±0.5)kg,雌雄各半,购自山东省康大生物科技有限公司,实验动物生产许可证编号:SCXK(鲁)20160002。饲养于广州中医药大学科技园普通级家兔实验室,在温度24 ℃、相对湿度50%~70%的环境中进行为期1周的适应性喂养,期间家兔正常摄食、饮水、自由活动。本动物实验方案已通过广州中医药大学科技产业园动物伦理委员会审批通过(批号:PZ21027)。适应性喂养结束后,随机分为空白组、模型组、低频摩腹组、高频摩腹组、低频摩腹+抑制剂组、高频摩腹+抑制剂组,每组12只,雌雄各半。
1.2 仪器与试剂调制器、校对器、动态数据采集器、Tekscan 研制的多点薄膜压力测试系统(MFF)压力传感器(上海邑成测试设备有限公司);人工智能机械臂(疆越科技研制730C 型);SMA4000 超微量分光光度计(北京Merinton 公司);ABI7500 荧光定量PCR 仪(美国Life Technology 公司)。ML-9 试剂(为MLCK 选择性强效抑制剂,北京生物技术有限公司生产,批号:YZM002844);GAPDH 抗体(兔源)、CaM 抗体(兔源)、MLCK 抗体(兔源)(华安生物公司);山羊抗兔IgG(H+L)抗体(DL800)(美国Proteintech 公司);BestarTMqPCR RT KitBestar®、SYBR Green qPCR mastermix(德国DBI公司)。
1.3 手法频率与压力值校对本次实验选取10名测试者,行10 次测试,再将测试者的压力平均值作为机械臂操作的压力标准操作值。将数据采集器、调制器、传感器、智能机械臂有序连接,将机械臂置于家兔腹部操作手法,并控制频率在101~ 150 次/min、201~ 250 次/min 两个频率,维持同等力量值操作1 min,观察压力曲线变化,建立力-电压之间的拟合函数模型y=a+bx,然后通过校对器得出曲线的标准力量值和频率值。技术人员提前在电脑Dobot Studio 系统上设置,操作智能机械臂在多点薄膜压力测试系统(MFF)下进行手法操作,手法压力值以观察实时采集数据为度量标准,其均值应控制在以上标准操作值上下不超过5%[5]。
1.4 造模空白组家兔继续给予常规饲养,其余组采用苦寒泻下法联合饥饱失常法构建脾虚模型[6-7]。方法:将190 g 大黄放入900 mL 水中浸泡20 min,大火煎至沸腾后改小火再煎10 min,加水增至1 140 mL,纱布过滤;再将190 g番泻叶加入1 140 mL沸水中搅拌浸泡5 min,过滤;将大黄液和番泻叶液各1 140 mL 混合,溶化152 g 芒硝,最终浓度为6 mL 药液含大黄2 g、番泻叶1 g、芒硝0.4 g(大黄∶番泻叶∶芒硝=5∶2.5∶1)[5]。除空白组外,其他各组家兔按照24 mL/kg 剂量连续灌胃1周,每日1次。期间饲料量减半,饮水不限制,全程详细记录各家兔体质量、进食量、行为学表现及大便变化情况。家兔出现便溏后改灌胃量为18 mL/kg。造模后出现精神萎靡,反应明显迟钝,甚至出现胆怯易惊,体质量减轻,食量变小,毛发色泽黯淡、无光泽,大便干硬或稀溏、难以成形等脾虚症状,则表明造模成功[2]。
1.5 干预方法
1.5.1 穴位定位 本实验选取中脘穴、双侧天枢穴。按《实验针灸学》[8]定位:中脘穴,位于家兔腹中线上,脐与剑状软骨连线中点处;天枢穴,位于家兔脐旁开3 cm处。
1.5.2 手法操作 将家兔固定在操作台上,呈仰卧位,2 名助手固定住家兔前后肢,剃除腹部毛发以充分暴露穴位,并用标记笔标识,将传感器固定在穴位上。在电脑上运行Dobot Studio 软件,输入测试时求出的机械臂力值参数,操作机械臂远端人体拇指模型于家兔腹部的中脘穴、天枢穴(双)上行摩腹,全程保证拇指模型与家兔腹部皮肤表面垂直,同时为保证手法力度与波形稳定,需时刻留意手法的压力曲线变化。
1.5.3 分组干预 造模结束后,空白组、模型组不进行任何手法干预;低频摩腹组、低频摩腹+抑制剂组利用人工智能机械臂进行低频率(101~150 次/分)摩腹干预;高频摩腹组、高频摩腹+抑制剂组利用人工智能机械臂进行高频率(201~250 次/分)摩腹干预;低频摩腹+抑制剂组、高频摩腹+抑制剂组每次手法干预前行腹腔注射ML-9(2 mg/kg)[9]。每穴操作5 min,3 穴共15 min,每日1次,连续10 d。
1.6 观察指标与方法
1.6.1 脾虚观察指标 记录所有家兔每日的精神状态、毛色、体质量、进食量、二便等情况。
1.6.2 苏木素-伊红(HE)染色法观察胃黏膜病理变化 取胃小弯组织,固定,石蜡包埋。将石蜡切片脱蜡至水后,入苏木素染3~ 8 min,自来水洗;1%盐酸酒精分化数秒,自来水冲洗;0.6%氨水返蓝,流水冲洗;入伊红染液中染色1~3 min。脱水封片。光镜下观察胃黏膜病理变化。
1.6.3 qPCR 法检测胃小弯组织CaM、MLCK 的mRNA 表达 提取胃小弯组织总RNA,运用紫外分光光度法检测其纯度和浓度,将总RNA 逆转录为cDNA。进行PCR 反应,反应程序:95 ℃2 min预变性;95 ℃10 s 变性,60 ℃15 s 退火,72 ℃30 s 延伸,45 个循环;总延伸为95 ℃10 s,60 ℃3 s,98 ℃10 s。重复操作3次,通过PCR 仪运行ASA-9600 系统软件得出数据,采用2-ΔΔCT法计算目标蛋白的相对表达水平。GAPDH(为内参)、CaM 和MLCK 引物由Life Technology 公司合成,引物见表1。引物的扩增长度均为20 bp。

表1 PCR引物序列信息Table 1 PCR primer sequences information
1.6.4 Western Blot 法检测胃小弯组织CaM、MLCK 的蛋白表达 取胃小弯组织,加入蛋白裂解液和蛋白酶抑制剂后匀浆、离心,取上清液(即为所要提取的总蛋白)。利用二喹啉甲酸(BCA)法测定蛋白总浓度并调整浓度后上样、煮沸变性、制胶、电泳、转膜、5%脱脂奶粉室温封闭1 h,加入CaM、MLCK、GAPDH 一抗(1∶1 000)4 ℃孵育过夜、山羊抗兔IgG(H+L)二抗(1∶4 000)室温孵育1 h,显色,显影成像,拍照。运用ImageJ 软件测定条带灰度值,计算目的蛋白灰度值与内参蛋白GAPDH灰度值的相对表达量。实验重复3次。
1.7 统计方法运用SPSS 26.0统计软件进行数据分析。计量资料以均数±标准差()表示,多组比较采用单因素方差分析,组间两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组家兔脾虚指标比较造模前,各组家兔精神状态佳,动作灵活,毛发顺滑有光泽,饮食正常,大便正常,粪便成形。造模后,家兔表现为精神状态差,精神萎靡,反应明显迟钝,甚至胆怯易惊,毛发黯淡无光泽,体质量减轻,进食减少,大便干硬或稀溏,表明造模成功;给予摩腹干预后,低频摩腹组、低频摩腹+抑制剂组、高频摩腹+抑制剂组家兔反应较治疗前敏捷,毛发逐渐恢复光泽,体质量、饮食较治疗前改善,大便性状逐渐恢复正常,而高频摩腹组各项指标较治疗前均变差,脾虚症状加重。
进一步比较各组家兔造模前后体质量、进食量2 个指标。表2、表3 结果显示:与空白组比较,模型组、低频摩腹组、高频摩腹组、低频摩腹+抑制剂组、高频摩腹+抑制剂组家兔体质量、进食量均减少,差异有统计学意义(P<0.05);与模型组比较,低频摩腹组、高频摩腹组、低频摩腹+抑制剂组、高频摩腹+抑制剂组的体质量、进食量均无统计学差异(P>0.05)。结果进一步证明造模成功。
表2 各组家兔造模前后体质量比较Table 2 Comparison of body mass among each group of rabbits before and after modeling()
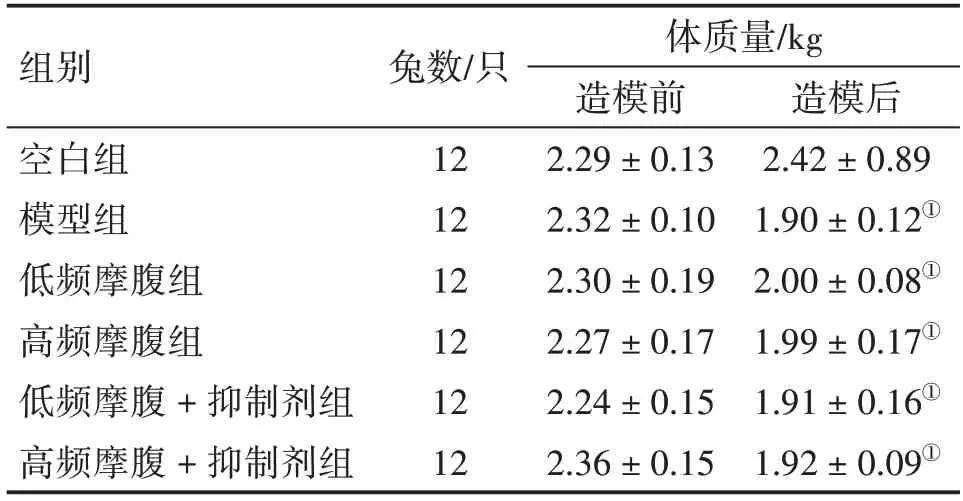
表2 各组家兔造模前后体质量比较Table 2 Comparison of body mass among each group of rabbits before and after modeling()
注:①P<0.05,与空白组比较
表3 各组家兔造模前后进食量比较Table 3 Comparison of the amount of food intake among each group of rabbits before and after modeling ()

表3 各组家兔造模前后进食量比较Table 3 Comparison of the amount of food intake among each group of rabbits before and after modeling ()
注:①P<0.05,与空白组比较
2.2 各组家兔干预后胃黏膜病理变化比较空白组:胃黏膜上皮细胞排列规则,隐窝及腺体结构清晰;模型组:胃黏膜上皮细胞排列规则,部分见淋巴细胞浸润;低频摩腹组:胃黏膜上皮细胞排列规则,黏膜稍微疏松水肿;低频摩腹+抑制剂组:胃黏膜上皮细胞排列规则,黏膜结构明显疏松水肿;高频摩腹+抑制剂组:胃黏膜上皮细胞排列规则,部分可见柱状上皮破坏;高频摩腹组:胃黏膜上皮细胞大部分柱状上皮破坏,部分淋巴细胞浸润。与模型组比较,低频摩腹组、低频摩腹+抑制剂组、高频摩腹+抑制剂组家兔胃小弯组织结构和形态均有恢复,而高频摩腹组家兔胃小弯组织结构和形态损伤均有所加重。见图1。
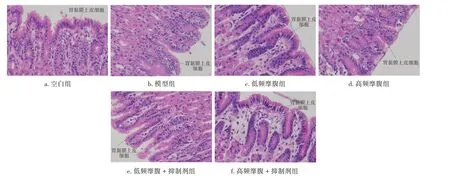
图1 各组家兔干预后胃黏膜病理变化比较(HE染色法,×400)Figure 1 Comparison of histopathological changes in the gastric mucosa among each group of rabbits after intervention(HE staining,×400)
2.3 各组家兔胃小弯组织CaM、MLCK mRNA表达水平比较表4结果显示:与空白组比较,模型组家兔胃小弯组织CaM、MLCK mRNA 表达水平显著降低(P<0.05);与模型组比较,低频摩腹组家兔胃小弯组织CaM、MLCK mRNA 表达水平上调(P<0.05),高频摩腹组CaM、MLCK mRNA 表达水平显著降低(P<0.05),低频摩腹+抑制剂组、高频摩腹+抑制剂组CaM、MLCK mRNA 表达水平亦显著降低(P<0.05);与低频摩腹组比较,高频摩腹组家兔MLCK 的mRNA 表达水平显著降低(P<0.05)。
表4 各组家兔胃小弯组织CaM、MLCK mRNA表达水平比较Table 4 Comparison of mRNA expression levels of CaM and MLCK in the tissue of the stomach lesser curvature among each group of rabbits()
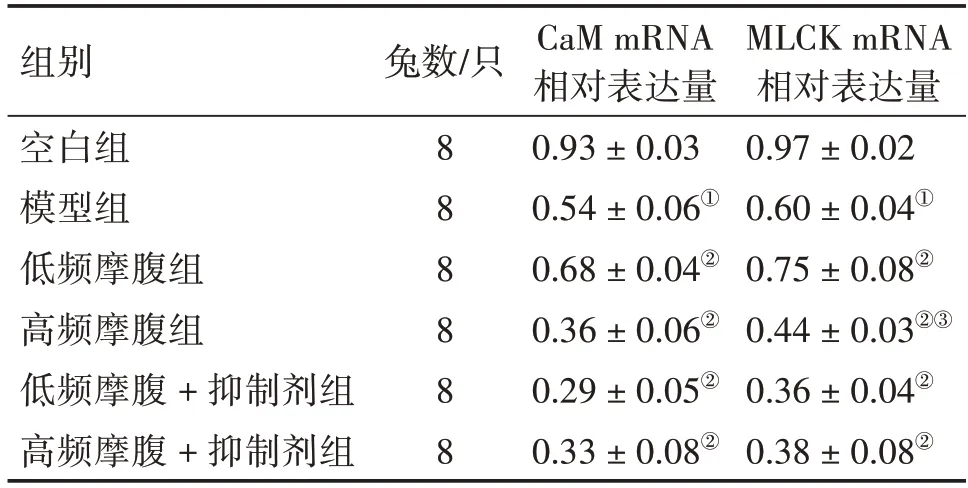
表4 各组家兔胃小弯组织CaM、MLCK mRNA表达水平比较Table 4 Comparison of mRNA expression levels of CaM and MLCK in the tissue of the stomach lesser curvature among each group of rabbits()
注:①P<0.05,与空白组比较;②P<0.05,与模型组比较;③P<0.05,与低频摩腹组比较
2.4 各组家兔胃小弯组织CaM、MLCK 蛋白表达水平比较图2、图3 结果显示:与空白组比较,模型组家兔胃小弯组织CaM、MLCK 蛋白表达水平显著降低(P<0.05);与模型组比较,低频摩腹组家兔CaM、MLCK 蛋白表达水平升高(P<0.05),高频摩腹组CaM、MLCK 蛋白表达水平显著降低(P<0.05),低频摩腹+抑制剂组、高频摩腹+抑制剂组CaM、MLCK 蛋白表达水平亦显著降低(P<0.05);与低频摩腹组比较,高频摩腹组家兔MLCK蛋白表达水平显著降低(P<0.05)。

图2 各组家兔CaM、MLCK、GADPH的蛋白电泳图Figure 2 Protein electrophoresis of CaM,MLCK and GADPH

图3 各组家兔胃小弯组织CaM、MLCK蛋白表达水平比较Figure 3 Comparison of protein expression levels of CaM and MLCK in the tissue of the stomach lesser curvature among each group of rabbits
3 讨论
中医认为,“脾”主运化,若饮食失节、脾失健运,则导致中焦气机升降失常,脾气上升受阻,胃气下降异常而发病。脾虚是胃肠道疾病发病的基本病机。平滑肌的收缩与舒张是维持消化功能稳定的基础[10]。解剖学表明,从食管至肛门这一系列器官和组织组成的消化系统,均由平滑肌构成。而CaM-MLCK 通路与胃肠道中维持消化功能的平滑肌收缩与舒张有关[11],是调节平滑肌收缩的经典信号通路[4]。在调节平滑肌收缩时,CaMMLCK 通路作为粗肌丝核心调节通路,在胃肠道上的平滑肌细胞接收刺激以及信号传导过程中起关键作用[12]。当外部电信号刺激,内质网和胞外的Ca2+浓度发生变化,胞内Ca2+浓度升高促使Ca2+向胞浆内释放,进而与胞内钙调蛋白结合后形成Ca2+-CaM 复合物,此时广泛分布于平滑肌等肌肉组织中的MLCK 被Ca2+-CaM 复合物激活,发生丝氨酸残基磷酸化后激活平滑肌肌球蛋白ATP 水解酶水解ATP,将化学能转换成机械能,释放能量后使肌球蛋白能够沿着肌动蛋白丝滑动,引起平滑肌收缩[13]。故本实验基于CaM-MLCK 通路探讨摩腹手法效应。
“补泻”的合理运用是中医治疗的基本原则之一,推拿手法治疗疾病时须遵循这一原则,摩腹也不例外。《厘正按摩要术》记载:“缓摩为补,急摩为泻。”强调了手法治病注重“补泻”原则,而手法的缓急补泻原则往往体现在手法频率的高低[14]。本课题组前期研究[15]指出,推拿手法治疗疾病存在一定的频率-效应关系,其中关于摩法治疗胃肠疾病时,101~ 150 次/分为最佳的治疗频率段,起到补的良性效应,而频率201~250 次/分则起到泻的损益效应。
本研究结果显示:与模型组比较,低频摩腹组家兔胃黏膜上皮细胞排列规则,稍有水肿,胃小弯组织CaM、MLCK 的mRNA 及蛋白表达水平显著升高,高频摩腹组家兔胃黏膜上皮细胞大部分柱状上皮破坏,部分淋巴细胞浸润,CaM、MLCK的mRNA 表达水平显著降低,蛋白表达水平显著降低。同时,与低频摩腹组比较,高频摩腹组家兔胃黏膜上皮细胞被破坏,部分淋巴细胞浸润,MLCK 的mRNA 和蛋白表达水平显著降低。经摩腹干预治疗后,低频摩腹组家兔反应较治疗前灵敏,毛发逐渐恢复光泽,体质量、饮食较治疗前好转,大便成形,高频摩腹组各项指标较治疗前均变差。表明低频率(101~150 次/分)摩腹能促进脾虚家兔消化功能恢复,具有补的良性效应;而高频率(201~250 次/分)无法促进胃肠消化功能恢复,甚至有一定的破坏性,具有泻的损益效应。本实验进一步证实了“缓摩为补,急摩为泻”的原理[16-18],同时也体现了手法在治疗过程中注重补泻原则的意义。本研究采用高频率的摩腹对脾虚家兔进行干预,结果显示,造模成功后的家兔处于脾虚状态,给予高频率摩腹干预后家兔胃肠消化功能未得到恢复,高频率摩腹起到了泻法的作用,甚至有一定的破坏性,验证了“补泻反则病益笃”的中医治疗原则。
另外,本研究结果还显示,与模型组比较,低频摩腹+抑制剂组、高频摩腹+抑制剂组家兔胃小弯组织CaM、MLCK 的mRNA 和蛋白表达水平显著降低。理论上分析认为,这2组家兔的胃肠道消化功能会比治疗前变差,甚至加重,但实际上低频摩腹+抑制剂组、高频摩腹+抑制剂组家兔反应较前灵敏,毛发逐渐恢复光泽,体质量、饮食较前好转,大便成形。ML-9 为MLCK 的特异性抑制剂,阻断CaM-MLCK 信号通路的表达后,摩腹仍能改善脾虚家兔的胃肠道功能,这提示摩腹除了通过CaM-MLCK 信号通路可能作用在其他信号通路或靶点上促使胃肠平滑肌收缩。目前已知调节胃肠运动的途径,还包括了KC、PAR-2[19]介导及c-kit/SCF 的信号通路,后续有待从以上信号通路研究摩腹在MLCK信号通路被抑制情况下仍能发挥调理胃肠、改善消化功能作用的机制,进一步深究摩腹的作用机制。
综上所述,摩腹治疗脾虚家兔可通过促进CaM-MLCK 信号通路上CaM、MLCK 的mRNA 和蛋白表达,引起胃肠平滑肌收缩,促进胃肠动力,进而改善脾虚状态。其中:低频率(101~150次/min)摩腹具有补的效应,可能与上调CaM、MLCK 的mRNA 和蛋白表达水平从而激活CaM-MLCK 信号通路有关;而高频率(201~ 250 次/ min)摩腹起到泻的效用,与下调CaM、MLCK 的mRNA 和蛋白表达水平从而抑制CaM-MLCK信号通路有关。
