元素及化合物知识考查视角梳理
2023-10-10边永平
边永平
(河北省丰宁满族自治县第一中学,河北 承德 068350)
在中学化学知识体系中,元素及化合物知识涵盖了元素周期表中的大部分主族及某些过渡元素.涉及化学基本概念和理论、化学计算以及化学实验等板块内容的考题均以元素及化合物知识为载体,进行基本知识和基本技能的考查.本文试对元素及化合物知识的考查视角进行梳理,供复习时参考.
1 结合化学史知识考查物质的存在、组成及性质
例1 (2021全国理综)北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧.挹其水熬之则成胆矾,烹胆矾则成铜.熬胆矾铁釜,久之亦化为铜”.下列有关叙述不正确的为( ).
A.胆矾为无水硫酸铜
B.湿法冶铜可以用胆矾作原料
C.“熬之则成胆矾”涉及到的生产工艺为浓缩结晶
D.“熬胆矾铁釜,久之亦化为铜”原理是铁置换出硫酸铜中的铜
解析胆矾是硫酸铜的结晶水合物,其化学式为CuSO4·5H2O,即A项错误;湿法炼铜原理即铁与硫酸铜溶液反应,铁置换出铜,即B项正确;“熬之则成胆矾”即指浓缩结晶的过程,即C项正确;用铁制容器盛装硫酸铜,会发生置换反应,生成铜,即D项正确.答案为A.
例2(2021河北)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”.“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢.下列说法错误的是( ).
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
解析钢是对含碳质量分数介于0.02%~2.11%的铁碳合金的统称,即A项正确;随着钢含碳量的增加,钢的强度和硬度增大,而塑性和韧性降低,即B项正确;生铁含碳量比熟铁高,而含碳量越高,熔点越低,即生铁的熔点比熟铁低,即C项错误;赤铁矿是冶炼铁的一种原料,主要成分为Fe2O3,即D项正确.答案为C.
2 考查物质的性质、变化与用途
例3A-D代表中学化学中常见的单质及化合物,其中A、B、C中均含有同一元素,各物质间在一定条件下存在如图1所示的转化关系,下列有关叙述正确的是( ).

图1 物质间的转化
A.若A为碳,D为水,则A和C反应生成1 molB时,将转移1 mol电子
B.若A为氯气,D为铁,则可以将B溶液直接蒸干得B固体
C.若A为碱性气体,D为氧气,则上述转化过程中只有两个反应属于氧化还原反应
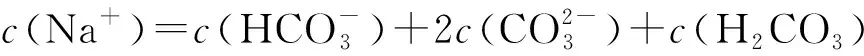
解析若D为H2O,A为碳,转化关系为:
A与C的反应为:
反应中生成2 mol CO转移2 mol电子,所以反应生成1 molB转移的电子数为NA,即A项正确;若D为Fe,A为Cl2,转化关系为:
A与C的反应为:

氯化铁水解生成氢氧化铁和氯化氢,氯化铁溶液蒸干时由于氯化氢的挥发,促进氯化铁的水解,最终得到的是氢氧化铁,不能得到FeCl3,即B项错误;若D为O2,A为碱性气体,即A为NH3,转化关系为:
A与C的反应为:
上述变化中有三个氧化还原反应,即C项错误;若D为HCl,A为Na2CO3,转化关系为:
A与C的反应为:

B溶液为NaHCO3,溶液中存在的物料守恒为:
即D项错误.答案为A.
3 考查化学实验
例4某同学欲探究铜和一氧化氮的反应,通过查阅资料得到以下信息:
①铜和一氧化氮反应可产生氮气和氧化铜;
(1)写出铜和稀硝酸反应生成一氮化氮的化学方程式:____.
(2)利用图2所示装置进行一氮化氮和铜反应的实验.实验开始前,为了排除空气的干扰,要向装置中通入一定量的氮气.

图2 NO与Cu反应的装置
①本实验中使用铜丝的好处为,E装置所起的作用是____.
②C装置中内盛放的试剂可能是____.
③D装置D内产生的现象为;写出F装置内发生反应的离子方程式:____.
(3)为了测定NaNO2和NaNO3混合溶液中NaNO2的浓度,做如下实验:在锥形瓶中放入25.00 mL混合溶液,再用0.100 0 mol·L-1酸性KMnO4溶液进行滴定,相关数据见表1.

表1 消耗 KMnO4溶液体积
①第一次实验数据出现异常,试分析产生异常的原因可能为( ).
a.锥形瓶洗净后没有进行干燥
b.没有用标准液润洗定管
c.因为没有一直观察锥形瓶中溶液颜色变化,判断滴定终点时溶液已变红
d.酸性 KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后又用待测液进行了润洗
②亚硝酸钠被酸性高锰酸钾溶液氧化的离子方程式为____.
③NaNO2的物质的量浓度为____.
解析(1)Cu和稀HNO3反应的化学方程式为:

(2)①上下移动铜丝,可以随时控制铜和硝酸的反应,所以使用铜丝的优点是可以随时控制反应的进行;因NO极易被酸性KMnO4溶液吸收,易产生倒吸现象,则装置E的作用为安全瓶;
②装置C的作用是干燥NO,应选择酸性或中性固体干燥剂,则盛放的药品可能是CaCl2或P2O5;

(3)①第一次实验数据相比后三次实验数据明显偏大.锥形瓶洗净后没有进行干燥,有少量水,对实验无影响,因为待测液中溶质的物质的量不变,对标准液的体积无影响,a项错误;
如果未用标准液润洗酸式滴定管,则会使装入的标准液的浓度偏小,这样会消耗更多标准液,造成标准液的体积偏大,b项正确;
因为没有一直观察锥形瓶中溶液颜色变化,判断滴定终点时溶液已变红,则滴加标准液过量,即标准液的体积偏大,c项正确;
酸性 KMnO4溶液中含有其他氧化性试剂,消耗的标准液体体积偏小,d项错误;
锥形瓶洗净后用待测液润洗,待测的溶质的物质的量偏大,导致滴定时消耗的标准液体积偏大,e项正确.
故选bce.
②离子方程式为:
③第一次实验数据明显偏大舍去,取后三次实验数据的平均值为:
则消耗KMnO4的物质的量是0.100 0 mol·L-1×0.02 L=0.002 mol,则根据离子方程式:
可知,NaNO2的物质的量是:
答案见解析过程.
4 考查化工生产与工艺流程
例5 工业上用铁泥(主要成分为Fe2O3、FeO和少量Fe)来生产纳米四氮化铁的工艺如图3所示.

图3 制备纳米Fe3O4的流程
下列叙述正确的是( ).
A.为加快步骤①的反应,所加稀盐酸的量越多越好
B.步骤②中发生的主要反应离子方程式为

C.步骤④中反应完成后剩余的H2O2无需除去
D.步骤⑥中,“分离”包含的操作有过滤、洗涤
解析增加稀盐酸的量不能使反应速率加快,应采取搅拌、适当升高温度的方法,即A项错误;滤液A的溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原Fe3+,即主要的离子反应为:

B正确;步骤④中,浊液C中的Fe(OH)2被H2O2氧化成浊液D,为了提高Fe3O4的产率,需要控制浊液D和滤液B中Fe2+的比例,为防止滤液B中Fe2+在步骤⑤中被H2O2氧化,步骤④中反应完成后需再加热一段时间除去剩余H2O2,则选项C错误;步骤⑤为浊液D与滤液B加热搅拌发生反应制得Fe3O4,步骤⑥中,使Fe3O4分离出来需经过的工艺有:过滤、洗涤、干燥,则选项D正确,答案为BD.
点拨化工生产和工艺流程试题多取材于生产生活中的化工流程问题,常以框图形式展示其生产工艺流程.解题时要关注题目的有效信息,结合附加提示条件,明确核心转化每一步反应的来龙去脉,即该步反应的原理,反应物、生成物、控制条件等.控制条件最为关键,它掌控反应进行的途径(方向)、反应速率和反应程度等.常见转化过程中反应类型主要有氧化还原反应、复分解反应等.设问方式常有氧化还原反应方程式的配平和计算,书写指定环节对应反应的离子方程式.产品的分离和提纯一般要根据产物的溶解性采取适宜的方法[1].
5 考查化学计算
例6 现有200 mL稀HNO3和稀H2SO4的混合溶液,平均分成两等份,向第一份加入Cu粉,发现最多溶解9.6 g;向第二份中加入Fe粉,产生气体的体积和加入Fe粉的质量关系如图4所示(已知HNO3还原的产物只有NO气体),下列描述正确的是 ( ).

图4 气体的量随铁粉质量增加的变化
A.原混200 mL混合溶液中含有0.2 mol HNO3

C.第二份溶液反应到最后,溶质只有Fe2(SO4)3
D.原混合液中c(H2SO4)=5 mol/L
解析依据稀HNO3和稀H2SO4分别与Cu、Fe反应情况可知图像中各线段的反应:





BC段加入的Fe和溶液中的H+反应,产生H2,最后溶液中溶质为FeSO4,故选项B正确,选项C错误;在第二份溶液中,根据最后溶液中的溶质只有FeSO4,依S元素守恒,存在以下等量关系:
n(H2SO4)=n(FeSO4)=n(Fe)=14/56=0.25 mol
即第二份混合溶液中含有0.25 mol H2SO4,故可求得原混合液中c(H2SO4)=2.5 mol/L,则选项D错误,即答案为AB[2].
