伊立替康联合紫杉醇治疗铂类耐药型进展期胃癌45例疗效观察
2023-10-09刘黎李娜李菲杨帆张匠骆雯田婕丽简朔冷娇刘雪梅
刘黎,李娜,李菲,杨帆,张匠,骆雯,田婕丽,简朔,冷娇,刘雪梅
遂宁市中心医院肿瘤中心一病区,四川遂宁629000
胃癌是起源于胃黏膜细胞的一种恶性肿瘤,多发于40~70岁男性人群;患者早期症状并不典型,确诊时多数已处于中晚期失去手术指征,只能采用化疗药物进行治疗[1]。目前,临床用于治疗进展期胃癌的化疗药物众多,如顺铂、卡铂、伊立替康等。但铂类药物治疗胃癌易使患者产生耐药性,从而导致治疗失败、增加肿瘤复发风险[2]。伊立替康为半合成水溶性喜树碱类衍生物,可抑制肿瘤细胞DNA复制和RNA合成,促进肿瘤细胞凋亡。既往研究将伊立替康与紫杉醇联合应用于复发及耐药型上皮性卵巢癌、胰腺癌等恶性肿瘤的治疗,显示疗效良好[3-4],但二者联合在铂类耐药型进展期胃癌的应用研究较少。本文采用前瞻性随机对照方法观察伊立替康联合紫杉醇在铂类耐药型进展期胃癌患者的应用效果,以期为临床用药方案的优化提供指导。
1 资料与方法
1.1 临床资料 选取2020年2月—2022年2月本院收治胃癌患者94例,男55例,女39例,年龄56~68岁。病理分型:腺癌55例,印戒细胞癌16例,腺鳞癌23例;肿瘤发生部位:胃窦44例,胃体20例,贲门30例;转移脏器:腹膜25例,腹腔盆腔淋巴结27例,肝脏29例,其他13例。纳入标准:①符合《内科学(第9版)》中胃癌的诊断标准[5],且经病理学检查确诊;②临床分期为Ⅳ期且无手术指征;③既往接受以顺铂或卡铂为基础的联合化疗且缓解期<6个月;④认知功能正常,可配合本研究;⑤预计生存期>3个月。排除标准:①存在化疗禁忌;②合并其他系统原发性恶性肿瘤;③合并精神类疾病;④既往接受过其他非铂类抗肿瘤治疗;⑤合并心肝肺肾严重病变;⑥合并严重感染性疾病、合并凝血功能障碍。剔除及脱落标准:①治疗期间病死者;②违反既定治疗方案者;③正在参与其他临床实验者;④未完成研究中指标评估者;⑤治疗期间发生严重毒副反应,被迫中断治疗者;⑥主动退出本研究患者。94例采用随机数字表法分为对照组和观察组各47例;两组性别、年龄、病理分型、肿瘤发生部位、转移脏器等资料比较差异无统计学意义(P均>0.05)。本研究经医院医学伦理委员会批准后实施(伦理批号:KYLLKS20230090),患者或家属对治疗方案知情同意。
1.2 治疗方法 对照组采用伊立替康联合氟尿嘧啶化疗。具体方案为:静脉滴注盐酸伊立替康注射液(江苏恒瑞医药股份有限公司,国药准字H20040711,规格:100 mg)180 mg/m2+亚叶酸钙注射液(江苏恒瑞医药股份有限公司,国药准字H20000584,规格:0.1 g)400 mg/m2+氟尿嘧啶注射液(上海旭东海普药业有限公司,国药准字H31020593,规格:0.25 g)400 mg/m2;每个化疗周期第1天用,3周为1个周期,共治疗3个周期。观察组采用伊立替康联合紫杉醇化疗。具体方案为:静脉滴注伊立替康注射液165 mg/m2+紫杉醇注射液(哈药集团生物工程有限公司,国药准字H20059962,规格:30 mg)135 mg/m2;每个化疗周期第1天用,3周为1个周期,共治疗3个周期。两组患者化疗期间给予常规对症治疗及止吐处理。
1.3 血清肿瘤标志物检测 治疗前、治疗3个周期结束时抽取患者清晨空腹状态下外周肘静脉血10 mL,静置1 h后离心,转速3 000 r/min,离心半径10 cm。离心10 min后分离血清,采用化学发光法检测血清糖类抗原724(CA724)、糖类抗原125(CA125)、糖类抗原199(CA199)水平。试剂盒由上海酶联生物科技有限公司提供,操作过程严格按照试剂盒说明书进行。
1.4 近期临床疗效判定 治疗3个周期后进行近期疗效判定,根据实体瘤疗效评定标准[6]分为完全缓解、部分缓解、疾病稳定和疾病进展。完全缓解:病灶完全消失、临床症状消失且持续时间≥4周;部分缓解:肿瘤最大径与垂直径乘积减少>50%且持续时间≥4周;疾病稳定:肿瘤最大径与垂直径乘积增大<25%或减小<50%,无新病灶;疾病进展:肿瘤最大径与垂直径乘积增加>25%,或出现新的肿瘤病灶。总缓解率=(完全缓解+部分缓解)/总例数×100%。
1.5 不良反应及预后情况观察 根据世界卫生组织制定的化疗药物不良反应分级标准[7]进行评价,将血液系统和消化系统的不良反应按照严重程度分为0~Ⅳ度,比较两组化疗期间不良反应严重程度。治疗结束后对患者进行为期1年的跟踪随访,以肿瘤复发或病死作为随访终点事件,比较两组随访期间肿瘤复发率和生存率。
1.6 统计学方法 采用SPSS25.0统计软件处理数据。计量资料均接受正态性检验,呈正态分布以表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验。计数资料以例数或百分比表示,组间比较采用χ2检验;等级资料采用秩和检验。P<0.05为差异有统计学意义。
2 结果
治疗及随访期间,对照组1例病死、1例主动退出研究,观察组2例病死,最终对照组和观察组各有45例患者纳入本研究。
2.1 两组治疗前后血清肿瘤标志物变化 与治疗前比较,两组治疗3个周期后血清CA724、CA125、CA199水平均降低(P均<0.05);治疗3个周期比较,两组血清CA724、CA125、CA199水平差异无统计学意义(P均>0.05)。见表1。
表1 两组治疗前后肿瘤标志物水平比较()
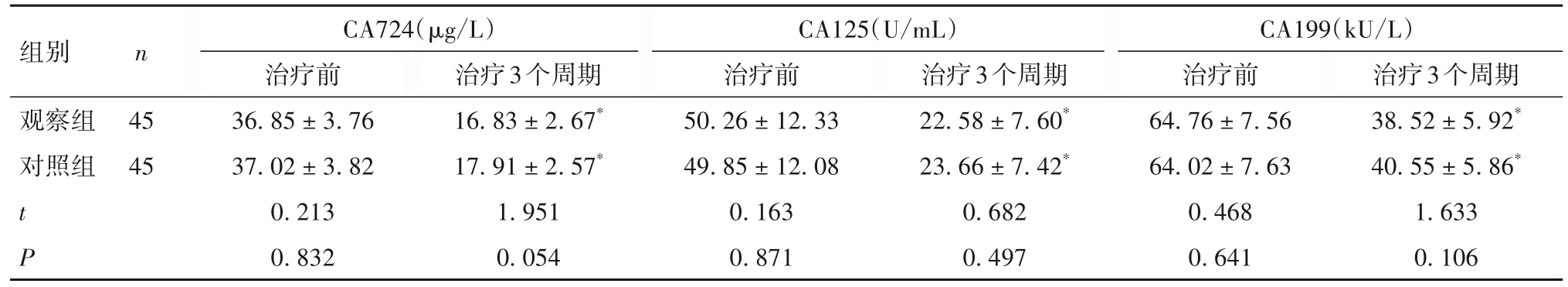
表1 两组治疗前后肿瘤标志物水平比较()
注:与同组治疗前比较,*P<0.05。
组别 n观察组 45对照组 45治疗3个周期38.52 ± 5.92*40.55 ± 5.86*1.633 0.106 CA724(µg/L)治疗前36.85 ± 3.76 37.02 ± 3.82 0.213 0.832治疗3个周期16.83 ± 2.67*17.91 ± 2.57*1.951 0.054 CA125(U/mL)治疗前50.26 ± 12.33 49.85 ± 12.08 0.163 0.871治疗3个周期22.58 ± 7.60*23.66 ± 7.42*0.682 0.497 t P CA199(kU/L)治疗前64.76 ± 7.56 64.02 ± 7.63 0.468 0.641
2.2 两组临床近期疗效 治疗3个周期,两组疾病总缓解率比较差异无统计学意义(P>0.05)。见表2。
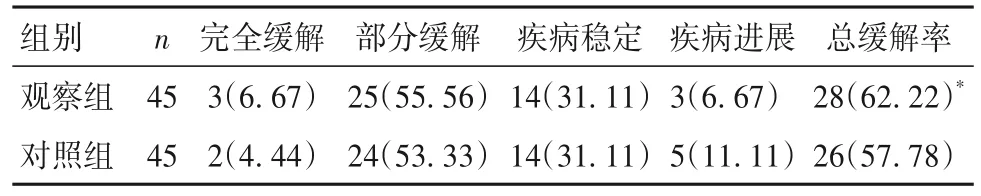
表2 两组临床近期疗效比较[例(%)]
2.3 消化系统和血液系统不良反应分级 化疗期间,观察组白细胞减少、血小板减少及血红蛋白减少程度较对照组减轻,差异有统计学意义(P均<0.05);两组恶心呕吐、腹泻程度比较,差异无统计学意义(P均>0.05)。见表3、表4。

表3 两组血液系统不良反应分级比较[例(%)]
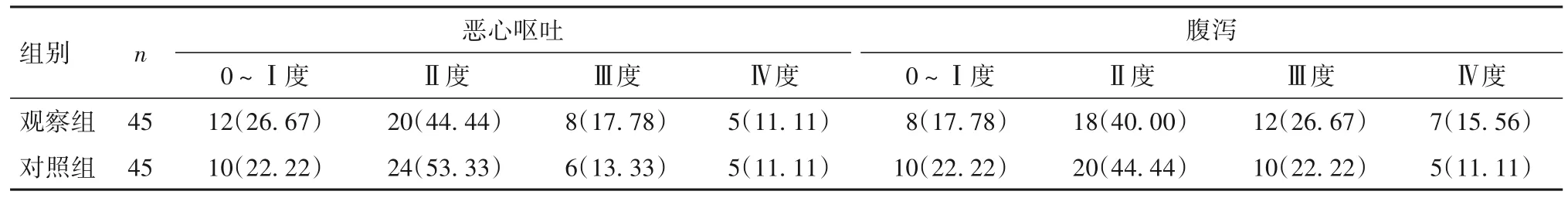
表4 两组消化系统不良反应分级比较[例(%)]
2.4 预后情况 随访1年,观察组复发2例(复发率4.44%)、死亡2例(生存率95.56%);对照组复发4例(复发率8.98%)、死亡8例(生存率82.22%)。观察组生存率高于对照组(P<0.05),两组疾病复发率差异无统计学意义(P>0.05)。
3 讨论
胃癌早期症状隐匿,多数患者确诊时已属晚期。尽管给予奥沙利铂、顺铂等药物治疗后多数患者缓解率较高,但部分患者由于对铂类药物产生耐药性,治疗效果并不理想[8]。因此,对于铂类耐药的进展期胃癌患者而言,寻找非铂类药物的联合治疗方案显得尤为重要。目前,临床推荐将伊立替康联合氟尿嘧啶、亚叶酸治疗铂类耐药型进展期胃癌,但该方案常诱发血小板降低、白细胞减少等毒性反应,影响患者血液系统功能[9-10]。国外研究指出,伊立替康联合紫杉醇治疗晚期胃癌有良好疗效,同时对患者血液系统影响轻微[11-12]。但国内关于伊立替康联合紫杉醇治疗晚期胃癌的研究较少,其临床疗效及不良反应发生情况尚无明确定论。
紫杉醇属于抗微管类抗肿瘤药。微管是真核细胞的重要组成成分,主要由微管蛋白二聚体形成,正常情况下微管和微管蛋白二聚体之间存在动态平衡[13]。紫杉醇可打破微管和微管蛋白二聚体之间的动态平衡,促进微管蛋白聚合并防止其解聚;这些作用会导致肿瘤细胞在进行有丝分裂时无法合成纺锤体和纺锤丝,最终阻断肿瘤细胞分化促使其凋亡,发挥抗肿瘤作用[14-15]。伊立替康是一种无活性的前体药物,经血液进入人体后可特异性的作用于拓扑异构酶Ⅰ,使DNA单链断裂,双链结构解旋,进而发挥细胞毒性作用,抑制肿瘤细胞增殖[16-17]。血清CA724是一种非特异性肿瘤标志物,可用于消化道恶性肿瘤的诊断中。血清CA125是一种不均一的黏蛋白样糖蛋白,在多种恶性肿瘤中均有较高的阳性表达。血清CA199是消化道系统较为敏感的肿瘤标志物,常用于胃癌、肝癌、结肠癌等恶性肿瘤的疗效监测中。临床研究证实,血清CA724、CA125、CA199在正常机体中表达水平极低,但随着胃癌患者临床分期和病情严重程度的增加,以上标志物血清水平不断升高[18-19]。本研究结果表明,治疗3个周期与治疗前比较,两组患者血清CA724、CA125、CA199水平均降低;治疗3个周期两组患者血清CA724、CA125、CA199水平以及疾病总缓解率比较差异无统计学意义。表明伊立替康联合紫杉醇治疗铂类耐药型进展期胃癌可获得与传统化疗方案同等的近期临床疗效。
本研究观察了伊立替康联合氟尿嘧啶、亚叶酸治疗与伊立替康联合紫杉醇治疗患者消化系统、血液系统不良反应发生情况,发现伊立替康联合紫杉醇可明显减轻铂类耐药型进展期胃癌患者血液不良反应。氟尿嘧啶在治疗期间会侵犯血细胞生成系统,引发骨髓抑制,进而引起白细胞减少、血小板降低等一系列血液毒性反应。亚叶酸能增强氟尿嘧啶的抗肿瘤疗效,但也会加剧氟尿嘧啶的毒性作用,可导致患者血液毒性反应分级增加。而紫杉醇对血液系统的影响主要表现在中性粒细胞减少,但在正常剂量范围内多数患者停药后可很快恢复正常。有研究者观察伊立替康联合替吉奥与紫杉醇联合替吉奥治疗晚期胃癌的安全性,发现上述两种联合用药方案引起的血液系统毒性反应多为Ⅰ~Ⅱ度[20]。张慧君等[21]将伊立替康、紫杉醇应用于中晚期宫颈癌的治疗中,发现该方案不仅临床有效率高,还兼具患者不良反应少、远期生存率高等优点。本研究对两组随访1年发现,伊立替康联合紫杉醇可显著提高铂类耐药型进展期胃癌患者生存率,推测可能与伊立替康联合紫杉醇治疗可减轻患者血液系统不良反应从而提高患者化疗耐受性有关。
综上所述,伊立替康联合紫杉醇治疗铂类耐药型进展期胃癌可获得与传统化疗方案同等的疗效,并可减轻血液毒性反应、提高患者生存率。但是,本研究纳入病例数较少且随访时间短,该方案治疗铂类耐药型进展期胃癌的确切疗效及血液系统病不良反应程度还需要后续研究进一步观察。
