miR-2116-3p和miR-342-3p对肝细胞癌诊断及预后价值的研究
2023-10-08白子誉郦尓启任长蓉孙启天高英梅张井松
白子誉, 郦尓启, 刘 辉, 任长蓉, 郑 彬, 孙启天, 高英梅, 张井松, 李 剑
(1.承德医学院附属医院, 河北 承德 067000 2.河北省迁安市人民医院神经内科, 河北 迁安 063000)
肝癌是世界上最常见的恶性肿瘤之一[1],全球肝癌的年新发病率占全部癌症的4.6%,死亡率高达8.3%,其主要亚型为肝细胞癌(HCC)[2]。HCC预后差,生存率低,5年生存率仅为18%,主要原因是HCC在早期症状不明显,发现时已经处于中晚期,并且常规化疗和放疗对HCC治疗效果欠佳[3]。因此,早期快速诊断HCC的生物标志物对于HCC早期治疗,减少病死率非常重要。microRNA (miRNA) 广泛存在于各种细胞中,是真核生物中一类长约20~25苷酸的内个核源性非编码小分子RNA,通过结合靶 mRNA 的 3' UTR 中的互补序列,在转录后调节基因表达,参与调控疾病的发生发展。研究表明miR-342-3p在多种癌组织中表达,发挥抑癌作用。但miR-342-3p在HCC癌组织中表达情况及对HCC的诊断价值研究较少。miR-2116-3P是另一个在结肠癌和乳腺癌中起到抑癌作用的miRNA分子,其在HCC癌组织的表达情况未见报道。本研究通过对早期HCC癌组织miR-342-3p和miR-2116-3p的检测,探讨miR-342-3p和miR-2116-3p对早期HCC的诊断价值。
1 资料与方法
1.1一般资料:选取2020年11月至2022年11月在承德医学院附属医院肝胆外科收治的57例HCC患者。其中男39例,女18例,年龄48~84岁,平均(61.65±7.43)岁。全部病例均经病理诊断为HCC,按TNM进行分期(美国肿瘤联合委员会(AJCC))。患者术前均未进行任何放化疗治疗。已排除:①具有其他脏器功能不全患者;②合并其他癌症患者;③具有精神类疾病。取手术后切除的癌组织及相应的癌旁组织(距离肿瘤边缘>2cm)作为对照,组织标本置于液氮中保存。
1.2方 法
1.2.1RNA的提取:按照miRcute miRNA提取分离试剂盒(购自北京天根科技有限公司)说明书进行操作。取300mg组织,剪成小块,置于研钵内,加入液氮研磨成粉末。加入1mL裂解液,静止5min,12000rpm离心10min,取上清后加入氯仿。12000rpm离心15min后取上清,吸入到新的离心管后,加入1/3体积无水乙醇,转入吸附柱中,进行分离纯化,用20LDEPC水洗脱得到RNA(含有miRNA)。
1.2.2实时荧光定量聚合酶链反应(qRT-PCR)检测miR-342-3p和miR-2116-3p的表达水平:对miR-342-3p和miR-2116-3p进行扩增,反应体系均为20μL,反应条件为95℃预变性15min,70℃变性15s,60℃退火,进行40个循环,以内源性u6作为参照。miR-2116-3P、miR-342-3P以及u6的引物序列均购自广州锐博生物科技有限公司,产品编号分别为MOPS0000823-1-100、MQPS0001090-1-100、MQPS0000000-2-100。PCR扩增仪购自美国MJ Research公司。
1.2.3随访:拨打电话或者医院病例信息方式对患者进行2年随访,记录患者治疗后发生转移或复发的时间。
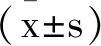
2 结 果
2.1miR-342-3p、miRNA-2116-3p在肝癌组织和癌旁组织中的表达:比较两种miRNAs在肝癌组织和癌旁组织中的表达情况:miR-2116-3P表达在肝癌组织中明显低于对照组,miR-342-3P在肝癌组织中表达水平也明显低于对照组,差异具有显著性(P<0.05)。见表1、图1。
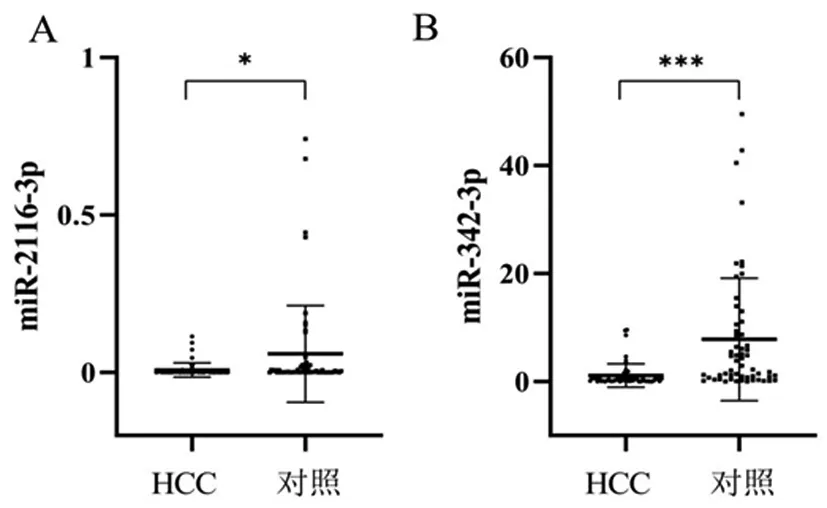
图1 A:miR-2116-3p在肝癌组织(HCC)和癌旁组织(对照)中的表达情况;B:miR-342-3p在肝癌组织(HCC)和癌旁组织(对照)中的表达情况

表1 miR-2116-3p和miR-342-3p在肝癌组织(HCC)和癌旁组织(对照)中的表达情况(2-ΔΔCT)
2.2组织中miR-2116-3p和miR-342-3p对早期HCC的诊断价值:为了进一步分析miRNAs的诊断效能,我们建立了ROC曲线。研究结果显示两种miRNAs能够很好的从对照组中鉴别HCC。miR-2116-3p和miR-342-3p鉴别HCC的ROC曲线下面积(Area under the curve,AUC)分别为0.694(95%CI0.597~0.791,P=0.049)和0.781(95%CI0.696~0.867,P=0.044),计算cutoff'值分别为0.85(灵敏性73.7%,特异性75.4%)和0.0003(灵敏性80.7%,特异性55.4%)两组联合从对照组中鉴别HCC的ROC曲线下面积为0.793(95%CI 0.711~0.879,P=0.042),见图2。
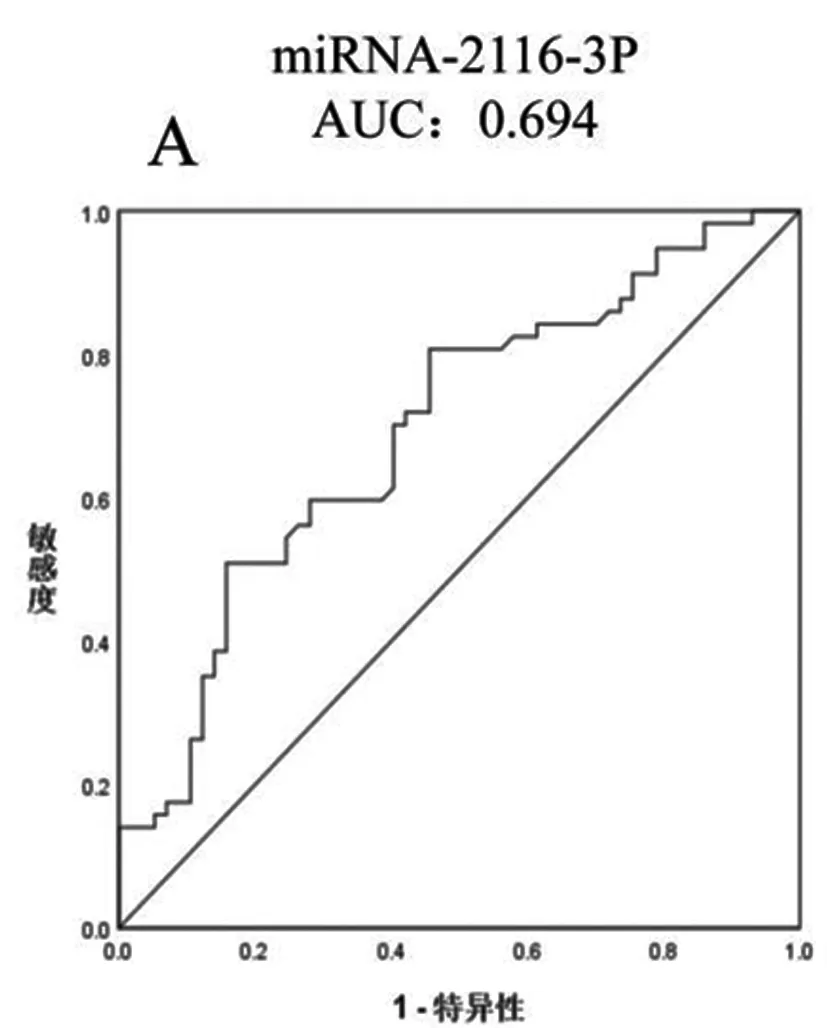
图2 组织中miR-2116-3p、miR-342-3p对HCC鉴别的ROC曲线
57例研究对象,45例病人AFP≤400,根据miR-2116-3P及miR-342-3P cutoff值对45例患者进行判断,在这45例患者中,有29(64%)例是miR-2116-3P阳性(>cutoff值),有38(84%)例患者是miR-342-3P阳性(>cutoff值)。有42(93%)例患者是miR-2116-3P阳性或miR-342-3P阳性。见表2。

表2 miR-2116-3P及miR-342-3P对AFP<400ng/mL早期HCC患者的诊断
2.3组织中及miR-2116-3p含量与患者临床病理参数的关系:以miR-2116-3p在肝癌组织中相对表达水平的中位数作为分组依据,将57例肝癌患者分为两组:低表达组(n=29)及高表达组(n=28)。比较不同组别患者临床及病理资料。比较结果显示两组比较患者的年龄、性别、AFP高表达(>400ng/mL)及低表达(≤400ng/mL)人数、肝硬化人数、乙型肝炎病毒携带人数无显著相关(P>0.05),miR-2116-3p高表达组与低表达组比较,肿瘤大小、TNM分期及CLIP评分有显著差异(P=0.045、P=0.042和P=0.006)。提示miR-2116-3p与肿瘤大小、TNM分期及患者CLIP评分显著相关。见表3。
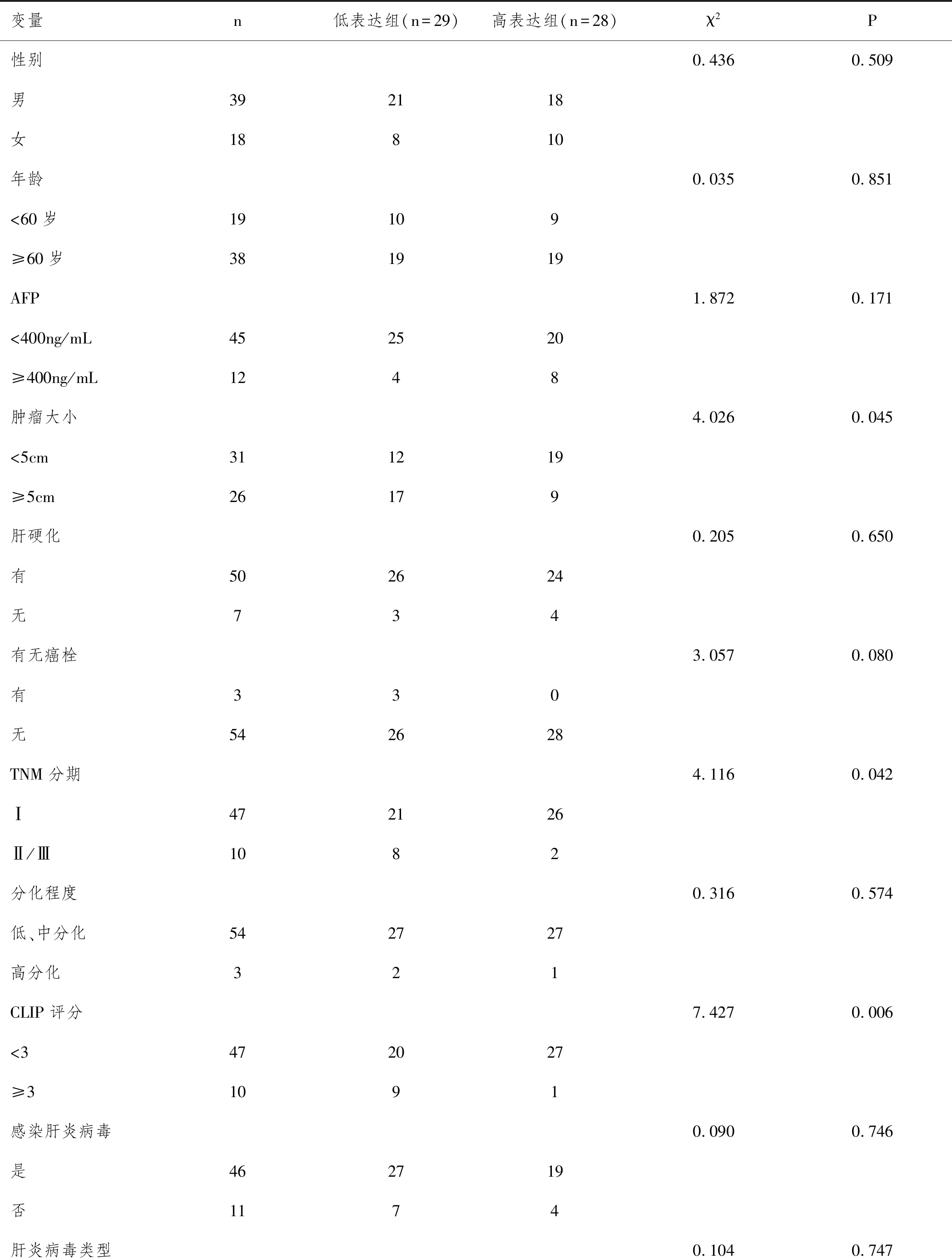
表3 HCC组中miR-2116-3p表达与患者临床病理参数的关系
2.4组织中及miR-342-3p含量与患者临床病理参数的关系:以miR-342-3p在肝癌组织中相对表达水平的中位数作为分组依据,将57例肝癌患者分为两组:低表达组及高表达组。比较不同组别患者临床及病理资料。比较结果显示两组比较患者的年龄、性别、AFP高表达(>400ng/mL)及低表达(≤400ng/mL)人数、肝硬化人数、乙型肝炎病毒携带人数无显著相关(P>0.05),miR-342-3p高表达组与低表达组比较,肿瘤大小、TNM分期及CLIP评分有显著差异(P<0.001、P=0.042和P=0.042)。提示miR-342-3p与肿瘤大小、TNM分期及患者CLIP评分显著相关。见表4。
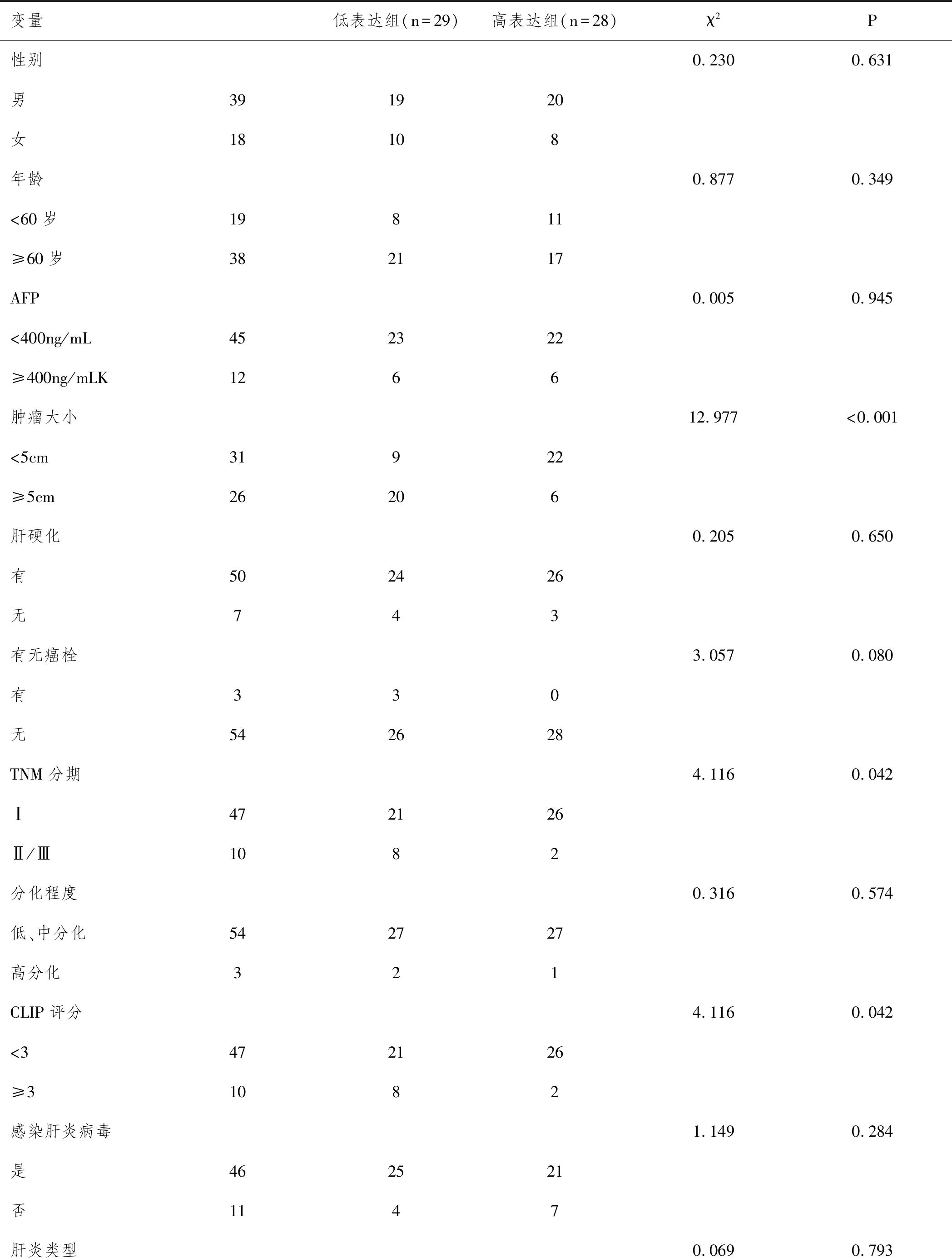
表4 HCC组中miR-342-3p表达与患者临床病理参数的关系
2.5组织中miR-2116-3P、miR-342-3p的Kaplan-Meier生存分析:57例HCC患者术后随访,失访8人,2年内不良预后发生11人,预后良好38人,不良预后发生率为23%。不良预后分析函数显示miR-2116-3p低表达组不良预后发生率高于miR-2116-3p高表达组(P=0.021)。miR-342-3p低表达组不良预后发生情况同miR-32-3p高表达组比较无显著差异(P>0.05),见图3。
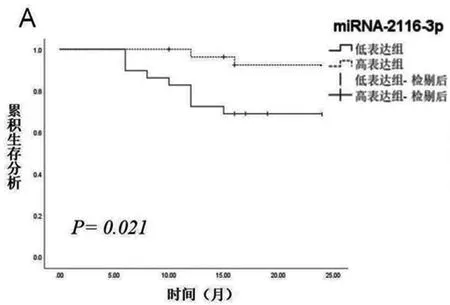
图3 miR-2116-3p(A)和miR-342-3p(B)与HCC患者不良预后的关系
2.6Cox回归分析:单因素Cox回归分析结果显示:有无癌栓、CLIP评分、miR-2116-3p均是影响肝癌患者不良预后发生的危险因素,见表5。多因素Cox回归分析结果显示有无癌栓和miR-2116-3p可以作为预测HCC患者不良预后的独立危险因素,见表6。
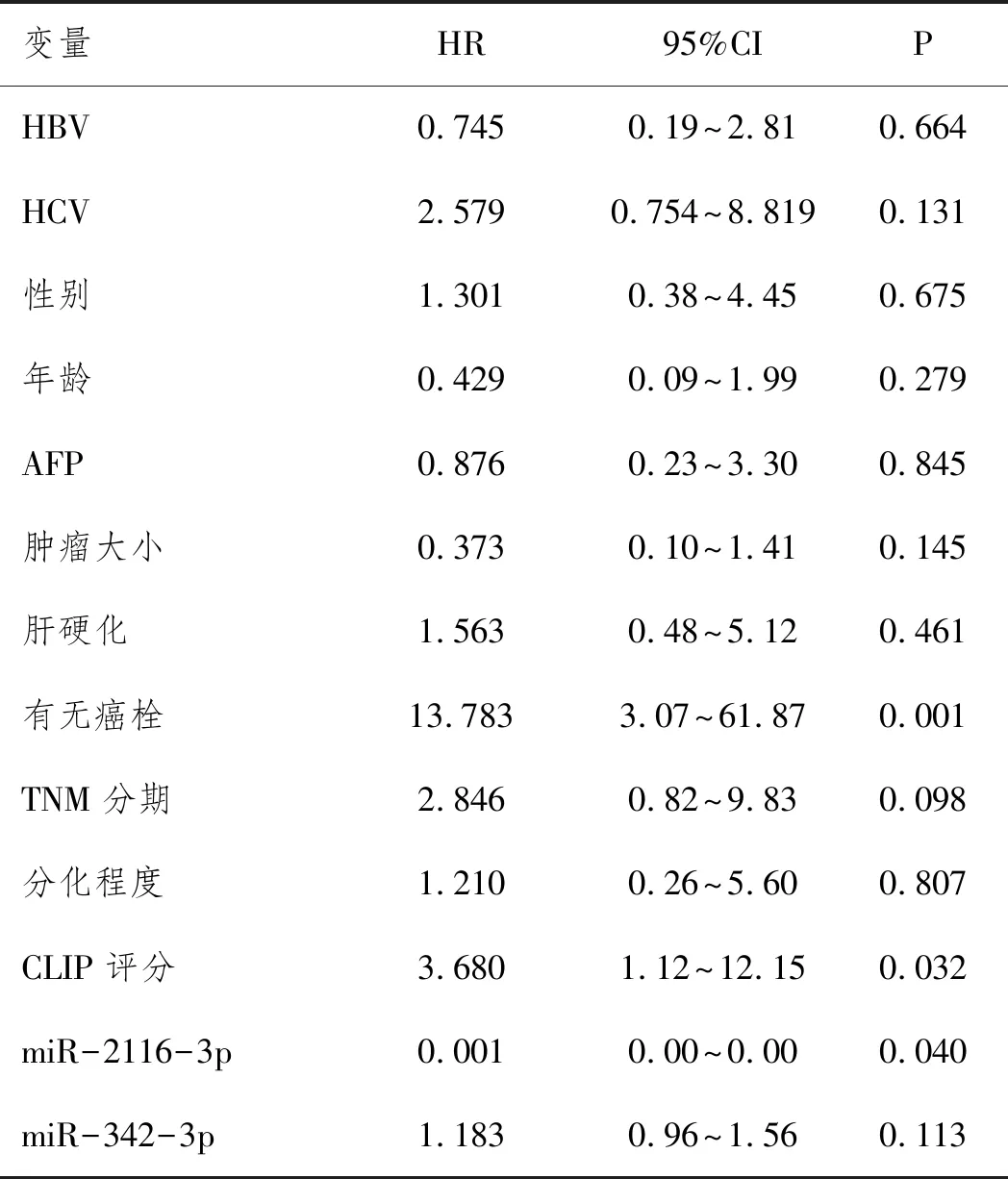
表5 单因素分析HCC患者不良预后影响因素
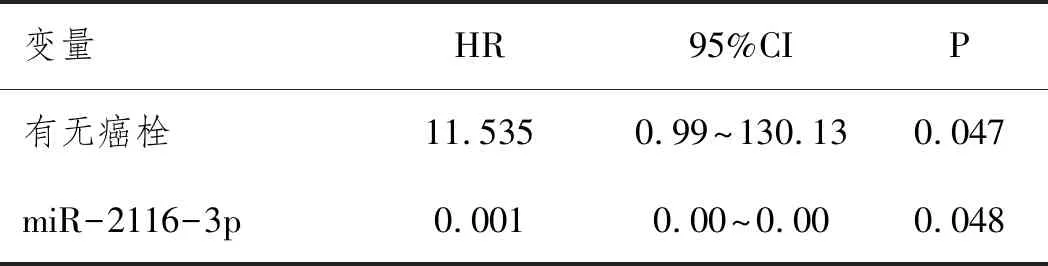
表6 多因素分析HCC患者不良预后影响因素
3 讨 论
原发性肝癌作为人群中常见的癌症类型,其恶性程度及病死率较高。导致肝癌的危险因素较多,包括乙肝病毒、丙肝病毒、脂肪肝疾病、酒精相关肝硬化、吸烟、肥胖、糖尿病、铁过量和各种饮食暴露[4]。值得注意的是,乙型肝炎病毒感染是我国HCC发病的主要原因,由肝炎进展为肝硬化乃至HCC的过程涉及多种分子机制参与其中[5]。
miR在正常个体生长发育、维持体内平衡状态,以及各项生理活动中起到不可缺少的作用。除此之外,miR还可以调控癌基因和抑癌基因的活性,进而对细胞癌变的发生和发展产生直接的作用[6]。研究表明,多种恶性肿瘤中miR出现异常表达。例如miR-122、miR-21、miR-222、miR-223和miR-199均与HCC的发生和发展有关[7]。与正常肝组织相比,miR表达水平的变化在癌前发育不良结节中频繁出现,并贯穿HBV相关肝癌的整个发展过程,表明miR的表达变化发生在HBV感染-肝硬化-HCC过程[8]。为了寻找HCC的生物标志物,以提高诊断效率和个性化治疗,此前大多数研究人员专注于全蛋白和多肽[9]。然而,与基于qPCR的分析相比,蛋白质检测方法由于其灵敏度相对较低且检测过程过于复杂,因此在临床应用中更加困难。研究还发现广泛存在于各种细胞、组织中,血清或血浆中的miR具有高度的稳定性和组织特异性[10],具有生物诊断标志物特性。
本研究的目的是评价miR-2116-3p和miR-342-3p对HCC的诊断及预后价值。我们对具有不同临床特征的HCC患者的肿瘤组织和癌旁组织中的miR表达量进行了比较,结果显示和癌旁对照组织相比,HCC组中miR-2116-3p和miR-342-3p均显著降低,并且具有显著性差异。进一步应用ROC曲线证明miR-2116-3p和miR-342-3p对HCC具有诊断价值。在本研究中AFP<400ng/mL患者45例,应用miR-2116-3p和miR-342-3p可以提高AFP<400ng/mL患者诊断率。联合miR-2116-3p和miR-342-3p可以对45例AFP<400ng/mL患者进行诊断。miR-2116-3p和miR-342-3p是传统指标AFP的有利补充。本研究中miR-342-3p表达量在癌组织中显著下降和其他癌组织研究结果相一致,提示miR-342-3p具有抑癌作用。对miR-2116-3p和miR-342-3p与患者临床及病理资料进行分析,显示miR-2116-3p和miR-342-3p均分别和肿瘤大小、TNM分期及CLIP评分相关。
miR-342-3p参与众多信号通路调节,可能和HCC的发生发展相关,Zhao等[11]的研究发现miR-342-3p与NF-κB途径相关,通过qRT-PCR发现NF-κB途径下游基因被miR-342-3p下调,被miR-342-3p-in上调,证实了miR-342靶向NF-κB途径。Liu等[12]研究发现miR-342-3p在体外和体内抑制IGF-1R介导的PI3K/AKT/GLUT1信号通路,通过抑制糖酵解来抑制肝癌的发生发展。Ronja-Melinda Komoll等[13]的研究中,证实了单羧酸转运蛋白1(MCT1)是HCC中miR-342-3p的真正靶标,肝癌患者肿瘤中的miR-342-3p下调,与MCT1表达呈负相关。结果提示miR-342-3p在调控肝癌中发挥作用。
本研究中miR-2116-3p在HCC组织中表达量显著降低。尽管该miR与癌症相关报道较少,但其预测的靶基因涉及癌症。预测得分最高的四个预测靶点是ZDHHC11、MTCH2、DIRC2和PEA15[14]。近一半的非小细胞肺癌和膀胱癌患者的ZDHHC1基因拷贝数发生改变。MTCH2是一种与非恶性组织相比在肿瘤组织中表现出高度限制水平的基因表达变异的基因。Bodmer等[14]研将DIRC2鉴定为家族性肾细胞癌相关基因。PEA15的表达水平用于星形胶质细胞肿瘤的恶性程度分级[15]。这些事实表明,miR-2116-3p可能在肿瘤的发生发展中具有重要作用。
综上所述,本研究结果表明,miR-342-3p和miR-2116-3P在肝癌组织相对表达量显著低于健康组织,且其异常表达与肝癌患者肿瘤大小、TNM分期及CLIP评分相关。应用Kaplan-Meier及Cox分析显示miR-2116-3p是HCC预后不良的独立风险因素,而miR-342-3p无显著预后价值。
miR-2116-3p和miR-342-3p作为新的诊断标准物,其诊断效能及预后评估价值需要大规模样本进行进一步验证,本实验研究病例较少,随访时间短,对统计结果造成了一定影响。另外miR-2116-3p和miR-342-3p参与HCC发生发展的机制有待进一步研究。
