槲皮素调控SOCS3/STAT3信号通路对甲状腺乳头状癌细胞生物学行为的影响
2023-10-08董保华孟佳佳徐娜娜
韩 克, 董保华, 孟佳佳, 徐娜娜
(1.山东省济南市第五人民医院普外二科, 山东 济南 250000 2.中国石油大学医院/华东, 山东 青岛 266580)
甲状腺癌较常见的癌症,而甲状腺乳头状癌(PTC)在其中占据比例最大,约占所有甲状腺癌的85%-90%。虽然PTC是一种恶性程度较低、相对温和的癌症,但其发病率逐年增加[1]。因此研究PTC进展的作用机制及潜在治疗药物对于改善PTC预后具有重要意义。槲皮素(Que)是一种多酚类黄酮,可从植物性食物和多种中药中获得。值得关注的是,Que可抑制甲状腺癌细胞生长,并诱导细胞凋亡,是一种有前途治疗甲状腺癌的候选药物,但其机制尚不明确。细胞因子信号转导抑制分子3(SOCS3)是SOCS家族最活跃的成员之一。SOCS3作为JAK2/STAT3信号通路的负调控因子,在肿瘤的侵袭转移过程中发挥重要作用[2]。有研究显示,Que可通过调节SOCS3/STAT3信号通路发挥抗关节炎作用[3]。但Que能否通过SOCS3/STAT3信号通路发挥抗肿瘤的作用尚未报道,本研究旨在探讨Que调控SOCS3/STAT3信号通路对PTC细胞生物学行为的影响。
1 材料与方法
1.1细胞来源:人乳头状甲状腺癌细胞TPC-1购自国家鉴定细胞培养物保藏中心(中国上海),细胞培养在含10%胎牛血清和1%青霉素和链霉素的新鲜RPMI 1640培养基中。
1.2主要材料、仪器:上海莼试生物技术有限公司提供Que;广州锐博生物技术有限公司提供SOCS5干扰RNA(SOCS3 shRNA)及阴性对照(shRNA NC);上海生工生物有限公司提供qRT-PCR所用引物;AccuRef Scientific公司提供CCK-8;Invitrogen公司提供TRIzol试剂、RIPA缓冲液;TaKaRa公司提供prime script RT试剂盒;Abcam公司提供SOCS3、p-STAT3、STAT3、磷酸化非受体酪氨酸激酶Janus激酶2(p-JAK2)、JAK2一抗、细胞凋亡检测试剂盒;Millipore提供PVDF膜。Thermo Fisher Scientific提供ABI7300系统;美谷分子仪器有限公司提供SpectraMAX Plus384酶标仪。
1.3细胞分组及处理:取融合度达到80%的TPC-1细胞进行设置分组:对照组、Que低(Que-L)、中(Que-M)、高浓度(Que-H)组、Que-H+shRNA NC组、Que-H+SOCS3 shRNA组。其中Que-L、Que-M、Que-H组经前期预实验及文献参考[4]分别以25μmoL/L Que、50μmoL/L Que、100μmoL/L Que进行处理TPC-1细胞;Que-H+shRNA NC组、Que-H+SOCS3 shRNA组分别利用Lipofectamine2000转染试剂盒将shRNA NC、SOCS3 shRNA分别转染至TPC-1细胞,48h后以100 μmoL/L Que处理TPC-1细胞,其中对照组不经任何处理。
1.4CCK-8法检测细胞增殖:将TPC-1细胞种植在96孔板(2×103个/每孔),每组包括六个重复,在细胞培养箱中孵育48h后,加入CCK-8试剂,检测细胞在450nm的吸光度,计算增殖率变化。
1.5流式细胞术检测细胞凋亡:取生长状态较好的TPC-1细胞,用预冷的PBS洗涤,然后与碘化丙锭(PI)和异硫氰酸荧光素(FITC)标记的膜联蛋白V在冰上孵育15min,使用FloMax软件通过流式细胞术分析细胞凋亡率。
1.6Transwell实验检测细胞迁移、侵袭:将TPC-1细胞以1×104个细胞/每孔的密度在24孔板中培养。将细胞用不含血清培养基稀释,并接种到Transwell上室(其中迁移实验中Transwell上室不含Matrigel基质胶;侵袭实验需预先涂Matrigel基质胶),将含有20% FBS的RPMI 1640加入到Transwell下室中作为化学引诱剂。48h后,细胞侵入过滤器的下表面,并用乙醇固定30min,用0.1%结晶紫对细胞染色10min,并使用X71倒置显微镜在随机选择的五个视野中计算迁移与侵袭细胞数。
1.7qRT-PCR检测SOCS3、STAT3 mRNA表达水平:使用RNA TRIzol试剂提取细胞中的RNA,并使用prime script RT试剂盒按照说明进行逆转录,使用TB Green Premix Ex Taq Ⅱ进行扩增。mRNA的相对表达水平用2-△△Ct法计算,并以β-actin为标准。SOCS3上游引物5'-3':GTCACCCACAGCAAGTTTCC,下游引物5'-3':TCCAGTAGAATCCGCTCTCC;STAT3上游引物5'-3':CATATGCGGCCAGCAAAGAA,下游引物5'-3'ATACCTGCTCTGAAGAAACT;β-actin上游引物5'-3':CAGCCATGTACGTTGCTATCCA,下游引物5'-3':TCACCGGAGTCCATCACGAT。
1.8Western blot检测细胞中SOCS3、p-STAT3、STAT3、p-JAK、JAK蛋白表达水平:在冰上用含有蛋白酶抑制剂的RIPA缓冲液裂解细胞,通过使用BCA蛋白质定量试剂盒进行蛋白质的定量,将等量的蛋白质进行SDS/PAGE分离并转移到PVDF膜上,封闭膜后,分别依次与SOCS3、p-STAT3、STAT3、p-JAK2、JAK2一抗孵育,依次加入合适的二抗再次孵育,然后用ECL检测试剂检测可视化蛋白,以β-actin用作内部对照,通过ImageJ软件分析条带强度,定量蛋白表达。
2 结 果
2.1Que对各组TPC-1细胞增殖变化的影响:与对照组相比,Que-L组、Que-M组、Que-H组TPC-1细胞增殖率显著下降(P<0.05);与Que-H+shRNA NC组相比,Que-H+SOCS3 shRNA组细胞增殖率显著增加(P<0.05),见表1。
表1 各组细胞中增殖率变化的比较
2.2Que对各组TPC-1细胞凋亡变化的影响:与对照组相比,Que-L组、Que-M组、Que-H组TPC-1细胞凋亡率显著升高(P<0.05);与Que-H+shRNA NC组相比,Que-H+SOCS3 shRNA组细胞凋亡率显著下降(P<0.05),见图1、表2。
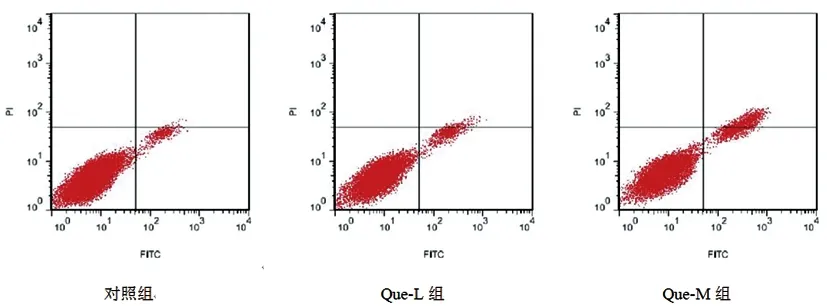
图1 观察TPC-1细胞凋亡变化
表2 各组细胞中凋亡率变化的比较
2.3Que对各组TPC-1细胞侵袭、迁移变化的影响:与对照组相比,Que-L组、Que-M组、Que-H组TPC-1细胞侵袭、迁移数显著下降(P<0.05);与Que-H+shRNA NC组相比,Que-H+SOCS3 shRNA组细胞侵袭、迁移数显著增加(P<0.05),见图2、3,表3。
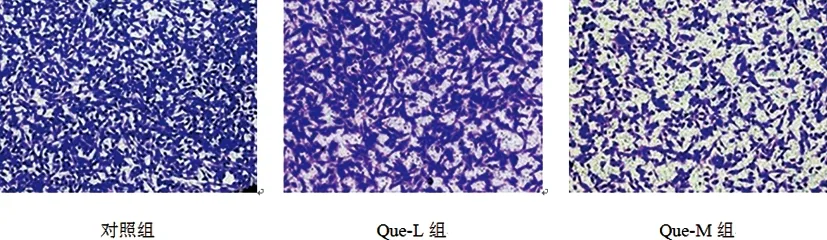
图2 观察TPC-1细胞侵袭变化(×100)

图3 观察TPC-1细胞迁移变化(×100)
表3 各组TPC-1细胞中侵袭迁移变化的比较
2.4Que对各组TPC-1细胞SOCS3、STAT3 mRNA表达水平的影响:与对照组相比,Que-L组、Que-M组、Que-H组TPC-1细胞SOCS3 mRNA表达显著增加,STAT3 mRNA表达显著下降(P<0.05);与Que-H+shRNA NC组相比,Que-H+SOCS3 shRNA组SOCS3 mRNA表达显著下降,STAT3 mRNA表达显著增加(P<0.05),见表4。
表4 各组TPC-1细胞中SOCS3 STAT3 mRNA表达水平的比较
2.5Que对各组TPC-1细胞SOCS3、p-STAT3、STAT3、p-JAK、JAK蛋白表达水平的影响:与对照组相比,Que-L组、Que-M组、Que-H组TPC-1细胞SOCS3蛋白表达显著增加,p-STAT3/STAT3、p-JAK2/JAK2表达显著下降(P<0.05);与Que-H+shRNA NC组相比,Que-H+SOCS3 shRNA组SOCS3蛋白表达显著下降,p-STAT3/STAT3、p-JAK2/JAK2表达显著增加(P<0.05),见图4、表5。
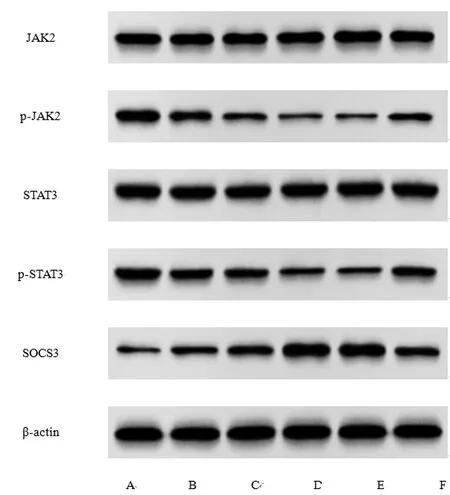
图4 TPC-1细胞中SOCS3、p-STAT3、STAT3、p-JAK2、JAK2蛋白表达(Western blot图)
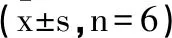
表5 各组TPC-1细胞中SOCS3 p-STAT3/STAT3 p-JAK2/JAK2表达的比较
3 讨 论
目前手术切除是PTC的主要治疗方法,辅以放射性碘治疗、促甲状腺激素抑制治疗、局部放疗和靶向药物治疗,但对于晚期PTC患者或失去手术机会的患者,选择潜在有用的药物势在必行,因此研究其发病机理对开发临床有效药物至关重要。
Que在国际纯粹与应用化学联合会上也被称为2-(3,4-二羟基苯基)-3,5,7-三羟基色烯-4-酮或3,3,4,5,7-五羟基黄酮,是常见的黄酮类化合物,在日常食物中普遍存在,包括坚果、种子、各种植物、蔬菜、水果、茶和红酒,已有文献证明Que具有抗真菌、抗氧化、细胞毒性、保肝和抗癌活性,Que对肿瘤细胞有特定的影响,而对正常和非转化细胞没有影响,因此近年来其抗肿瘤特性受到大家的关注[5]。本研究结果显示,不同浓度的Que显著抑制了TPC-1细胞的增殖、侵袭及迁移,诱导了TPC-1细胞的凋亡,与其在直肠癌[5]中的作用一致,均呈现剂量依赖性,提示Que对TPC-1具有抗肿瘤特性。说明在目前的浓度范围内Que的抗癌作用随剂量的升高而增强,但Que浓度大于100μmoL/L后是否还具有这样的量效关系则不清楚,可能随剂量的升高而下降,也可能随剂量的升高而不变,都需要进一步研究证实。
JAK2和STAT3是细胞因子刺激的信号介质,当JAK2被细胞因子受体磷酸化,磷酸化的JAK2激活转录因子STAT3并促进核转位,从而调节与增殖、分化和上皮-间质转化相关靶基因,其异常激活与多种肿瘤的进展有关。但JAK2/STAT3信号通路的活性受到SOCS家族的抑制,尤其SOCS3对JAK2具有较高的亲和力,是JAK2/STAT3信号通路最关键的负调节因子。本研究结果显示,不同浓度的Que处理TPC-1细胞后,STAT3 mRNA、p-STAT3/STAT3、p-JAK2/JAK2表达显著下降,SOCS3 mRNA及蛋白表达显著增加,提示Que可抑制TPC-1细胞的恶性行为,可能与上调SOCS,抑制STAT3表达有关,与Yu等[6]结果相吻合。既往研究显示,SOCS3表达的升高及STAT3表达的降低可抑制肿瘤细胞增殖、迁移、侵袭并诱导凋亡[3,7]。推测Que可能通过激活SOCS3/STAT3信号通路发挥抗PTC功能。为进一步验证该推测,以SOCS3 shRNA进行回复验证,结果发现SOCS3 shRNA逆转了Que对TPC-1细胞的恶性行为的抑制作用,表明Que通过上调SOCS3表达并抑制JAK2和STAT3磷酸化来激活SOCS3/STAT3信号通路进而抑制PTC细胞系TPC-1细胞的恶性生物学行为。研究发现Que可抑制JAK2/STAT3信号激活,通过提高Bcl-2 mRNA水平促进卵巢癌细胞凋亡[8]。STAT3过表达可增加直肠癌细胞活性和侵袭能力,Que能通过逆转STAT3水平加速细胞凋亡[9]。故本研究推测Que通过激活SOCS3/STAT3信号通路促进Bcl-2 mRNA表达,进而诱导TPC-1细胞凋亡,抑制增殖、迁移和侵袭。
综上所述,Que可抑制TPC-1细胞增殖、侵袭及迁移,诱导其凋亡,可能通过激活SOCS3/STAT3信号通路实现,但由于细胞单一,作用机制复杂,仍需进一步探索,为Que治疗PTC提供有利依据。
