2018—2022年鲫造血器官坏死病病原检测能力验证结果分析
2023-10-08王娜余卫忠张旻景宏丽王彩霞冯春燕李清吴绍强
王娜,余卫忠,张旻,景宏丽,王彩霞 ,冯春燕,李清,吴绍强*
(1.中国检验检疫科学研究院 北京 100176;2.全国水产技术推广总站 北京 100125)
鲫造血器官坏死病(Crucian carp haematopoietic necrosis,CHN)是由鲤疱疹病毒2型(Cyprinid herpesvirus 2,CyHV-2),也称为金鱼造血器官坏死病毒(Goldfish haematopoietic necrosis virus,GFHNV),引起的鲫(Carassiusauratus)、金鱼等鱼类死亡的一种病毒性传染病,在全球多个国家和地区均有流行,给金鱼、鲫养殖产业造成了严重的经济损失[1-2],自2009年以来,在中国江苏省部分地区养殖的异育银鲫(Carassiusauratusgibelio)中检测到CyHV-2病毒,随后该病毒在国内鲫主要养殖区域暴发流行[3-4]。CyHV-2属于疱疹病毒目(Herpesvirales)、异样疱疹病毒科(Alloherpesviridae)、鲤科疱疹病毒属(Cyprinivirus),是具有囊膜的双链DNA病毒[5]。由于幼鱼和成鱼均可感染,发病急、死亡率高,农业农村部于2022年在《一、二、三类动物疫病病种名录》中将其列为二类水生动物疫病[6]。
目前,针对CyHV-2感染尚无有效的防治药物。因此,加强监测成为控制和预防鲫造血器官坏死病的重要手段。虽然已有很多CyHV-2的检测方法[3],但在实际应用中主要还是基于分子的检测技术,血清学诊断并没有得到广泛的应用。目前国内权威的CyHV-2检测方法是GB/T 36194—2018《金鱼造血器官坏死病毒检测方法》[7]中推荐的方法,分别使用特异性引物PCR扩增CyHV-2 DNA聚合酶(pol)基因片段(362 bp)和解旋酶(hel)基因片段(366 bp),当检测样品能同时扩增出2段基因且测序结果正确时,才可判定样品中CyHV-2核酸阳性。
针对某种疾病或病原的能力验证结果,是衡量相关实验室检测能力的重要指标[8],也是评价全系统对该疫病防控能力的重要参数[9-10]。为加强水生动物防疫系统实验室鲫造血器官坏死病病原检测能力,提高疫病监测的准确性,2018—2022年,全国水产技术推广总站分别组织5次水生动物防疫系统实验室“鲫造血器官坏死病病原检测能力验证”项目,并委托中国检验检疫科学研究院承担相关测试评价工作。通过此次考核和比对,能力测试的结果可以客观反映参加实验室的鲫造血器官坏死病病原检测能力,同时帮助和促进参加实验室发现管理和技术问题,并加以纠正,提高检测能力水平,保证各实验室检测结果的准确性和可靠性。
1 材料与方法
1.1 材料
1.1.1 能力验证样品的制备
经检测未感染CyHV-2的健康草鱼(CtenopharyngodonIdella)采自北京,取脾脏、肾脏和肝脏组织研磨均匀,按照质量体积比1∶10(m/v),用1×PBS缓冲液悬浮待用。
病毒样颗粒溶液CyHV-2-pol包含GB/T 36194-2018《金鱼造血器官坏死病毒检测方法》[7]中的pol基因片段(GenBank No:AFJ20509),长度为1 536 bp;病毒样颗粒溶液CyHV-2-hel包含标准中的hel基因片段(GenBank No:AFJ20501),长度1 707 bp。2种病毒样颗粒溶液由中国检验检疫科学研究院动物检验与检疫研究所制备保存。
按照组织匀浆液:CyHV-2-pol溶液:CyHV-2-hel溶液=3∶1∶1(v/v/v)的体积比,将各溶液混匀。混合液作为阳性检测样品,每管800 μL分装,-80 ℃保存。单独的草鱼组织匀浆液作为阴性检测样品,同样分装保存。
1.1.2 能力验证样品的均匀性和稳定性
1.1.2.1 均匀性
为保证所有参加实验室检测的样品成分一致,所有样品(包括阳性样品和阴性样品)各一次性准备250管,每管样品800 μL分装。按照CNAS-GL003:2018《能力验证样品均匀性和稳定性评价指南》[11]测试均匀性。阴性样品和阳性样品各随机抽取11份进行检测。使用GB/T 36194-2018《金鱼造血器官坏死病毒检测方法》[7]中推荐的PCR方法扩增目的基因,并委托上海生工生物进行测序。若全部样品的PCR扩增产物与目的基因大小一致,则样品均一性良好。若PCR扩增产物与目的基因大小不符,或有DNA污染,或目的基因条带不明显甚至无DNA条带,则样品不能使用,需重新制备和检验。
1.1.2.2 稳定性
为保证各参加实验室收到的样品性质未发生改变,分别设置3组阳性样品和阴性样品,每组5份,模拟保存温度和运输温度放置于-20、4和37 ℃下测试样品的稳定性。分别在第0 d、第2 d、第5 d、第9 d和第14 d,将3种温度保存的样品各取1份,于-80 ℃保存。依据标准进行PCR扩增和测序,检测在不同保存条件下样品的稳定性。
1.1.3 样品的包装及发放
1.1.3.1 样品的包装
样品为盲样,拟给每个参加实验室发放4份检测样品,其中至少包含1份阳性样品或1份阴性样品。阴性样品(N)、阳性样品(P)可有10种不同的组合方式,随机决定参加者采用哪一种组合,由发样单位记录并保密,从而保证能力验证项目的测试效果,防止实验室间互相比对结果。给参加实验室一个随机代码,再随机决定发送哪种组合的样品。4个检测样品标签为实验室的代码和样品编号(例如:代码为C10的参加实验室,样品标签为C10-1、C10-2、C10-3、C10-4)。
2.1.3.2样品的发放
样品避光保存于1.5 mL管中,管壁上防水标签包含测试样品名称、编号及实验室代码,样品管放置于包装盒内。包装盒上防水标签包含项目名称、测试样品名称、数量、编号、保存温度、发送单位及接收单位名称(图1)。根据样品稳定性检测结果,将包装盒放置于充满干冰和冰袋的厚泡沫塑料盒内,密封后放置于硬壳纸箱中,再次密封后通过特快专递发放至各参加实验室。同时在样品的寄送包装中附有样品接收确认单、能力测试作业指导书和能力测试结果报告单等纸质材料。

图1 送检样品包装Fig.1 The packaging of testing samples

图2 CyHV-2阳性样品均一性A:目的基因362 bp;B:目的基因366 bpM:DL2000 DNA Marker;1~22:11份阳性样品DNA,每个样品2次重复;N:空白对照(ddH2O);P:阳性对照。Fig.2 Homogeneity of CyHV-2 positive samplesA:Target gene 362 bp;B:Target gene 366 bpM:DL2000 DNA Marker;1-22:DNA in 11 positive sample,each sample with two replicates;N:Blank control (ddH2O);P:Positive control.
1.2 方法
1.2.1 推荐的检测方法
使用GB/T 36194-2018《金鱼造血器官坏死病毒检测方法》[7]中推荐的PCR方法进行检测。先提取样品总DNA,再使用PCR方法检测病毒的DNA。根据扩增得到的片段大小及测定序列比对结果来判断。样品DNA的抽提试剂和PCR反应试剂可根据参加实验室情况自行选择,或采用商品化试剂盒进行试验。
1.2.2 检测样品结果判定方法
本项目为定性检测类项目,检测结果仅用阳性和阴性表示,没有定量标准。
根据标准,同时满足以下2条即可判定为GFHNV阳性[7]。一是利用CyHV引物PCR检测结果为阳性,且通过分析测序结果确定是GFHNV。二是利用CyHV-2引物PCR检测结果为阳性,且测序结果正确。
1.2.3 能力验证结果判定原则
参加实验室的定性检测结果必须与发放样品预设结果完全一致,方可判定为结果“满意”,并且检测流程和检测结果判定方法必须符合GB/T 36194—2018《金鱼造血器官坏死病毒检测方法》[7]的规定。
1.2.4 验证结论
如果参加单位报送结果为“满意”,则表明该实验室已具备鲫造血器官坏死病病原的检测能力;如果报送结果为“不满意”,则需分析原因,进行相应的整改。
2 结果与分析
2.1 样品的均匀性与稳定性
2.1.1 均匀性检测结果
随机选取11份阳性样品和阴性样品进行检测。结果显示,阳性样品均可扩增出362 bp条带和366 bp条带,PCR产物测序序列与参考序列同源性达100%,阴性样品均与预期结果一致。说明阳性样品和阴性样品均一性良好,满足能力验证要求。
2.1.2 稳定性检测结果
样品保存于-20、4和37 ℃ 14 d后,检测结果仍全部为阳性,序列比对结果显示与参考序列的同源性都达到100%,表明样品稳定性良好。在37 ℃保存第14 d时PCR扩增条带会变浅。考虑到使用特快专递,一般2~5 d可运抵参加能力验证的实验室,因此本项目制备的能力验证样品经长途运输后仍满足参加实验的检测需求。按照GB/T 36194—2018《金鱼造血器官坏死病毒检测方法》[7],CyHV-2的PCR检测为定性检测,不需要定量,因此样品的均匀性和稳定性检测结果也只统计了定性结果,未统计定量和误差分析。
2.2 参加实验室情况
2018—2022年“鲫造血器官坏死病病原检测能力验证”项目分别有67、71、74、106和93家实验室参加,包括推广(疫控)机构实验室、科研机构实验室、高校实验室、海关系统实验室、企业实验室和其他单位实验室(表1)。其中农业农村部各级水产技术推广站,以及某些研究CyHV-2的高校、科研院所和企业,主要负责检测监测国内CyHV-2的流行情况;海关系统各级技术中心和实验室,负责出入境水生动物的CyHV-2检测。地域分布上,各参加实验室分布于全国各省市,沿海省市和长江流域水产养殖业比较发达地区占比较高。
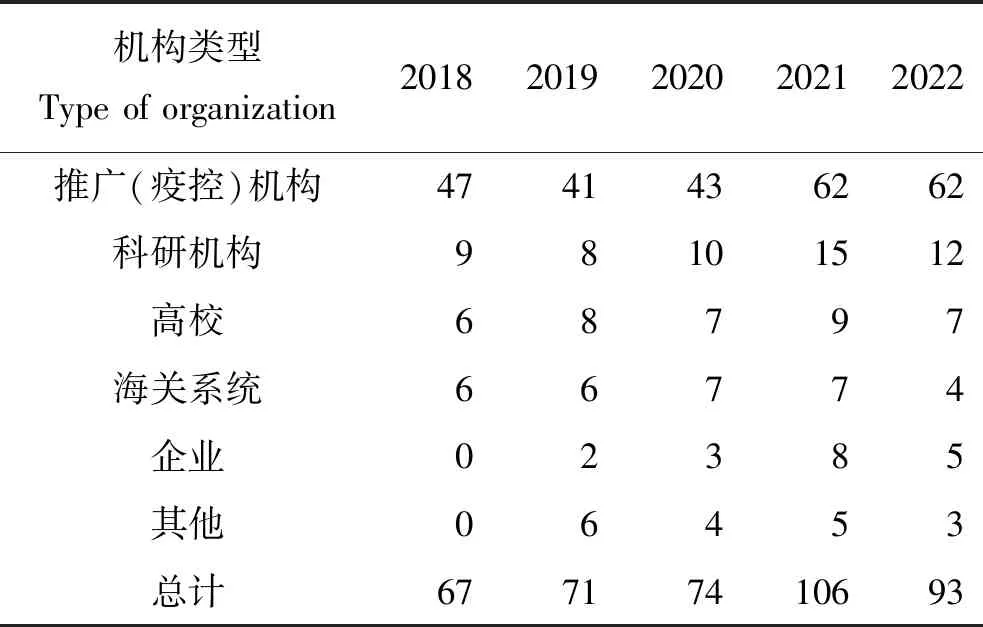
表1 参加能力验证活动的实验室Tab.1 The laboratories particpated in proficiency testing 个
2.3 参加实验室检测结果统计及评价结果
2018年,有67家单位参加能力验证测试,其中58家单位测试结果满意,占86.57%;9家单位测试结果不满意,占13.43%。2019年,有71家单位参加能力验证测试,其中59家单位测试结果满意,占83.10%;12家单位测试结果不满意,占16.90%。2020年,有74家单位参加能力验证测试,其中64家单位测试结果满意,占86.50%;10家单位测试结果不满意,占13.50%。2021年,有106家单位参加能力验证测试,其中93家单位测试结果满意,占87.74%;13家单位测试结果不满意,占12.26%。2022年,有92家单位参加能力验证测试,其中79家单位测试结果满意,占85.86%;13家单位测试结果不满意,占14.14%(表2)。纵观5次能力验证项目,2021年参测实验室数量最多(图3),满意率除2019年稍低外,其余4年均超过85.00%(图4)。
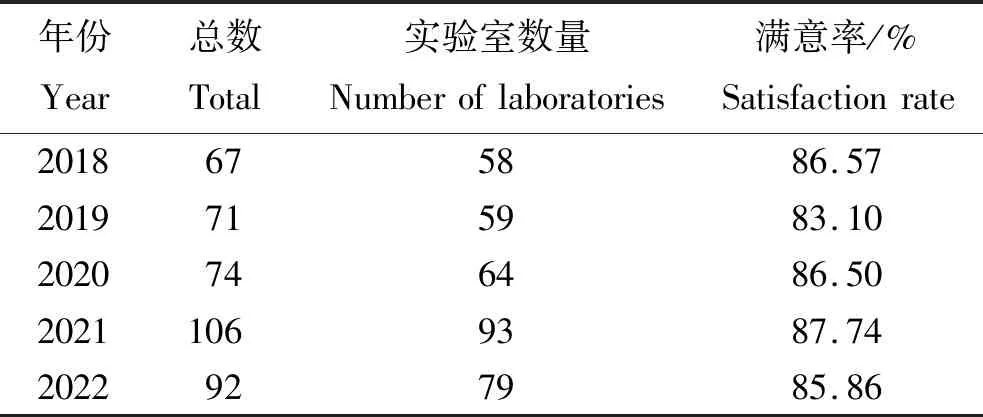
表2 2018—2022年能力验证满意结果对比表Tab.2 The proficiency testing satisfaction results of laboratories in 2018—2022

图3 2018—2022年参测实验室数量Fig.3 The number of laboratories tested in proficiency testing in 2018—2022

图4 2018—2022年参测实验室满意率Fig.4 The satisfaction rate of laboratories tested in proficiency testing in 2018—2022
3 讨论
近年来,随着鲫养殖规模的逐渐扩大,鲫造血器官坏死病已成为严重威胁中国鲫和金鱼养殖业健康发展的主要疾病之一。因此,加强鲫造血器官坏死病的监测和防控是当前的首要工作。开展鲫造血器官坏死病病原检测能力验证工作,提升该病的检测能力,为鲫造血器官坏死病的监测预警提供了有力支撑。本能力验证具有持续时间久、参加实验室数量多、地域分布广泛等特点。2018—2022年,共有411家(次)实验室参加,测试结果满意率依次为86.57%、83.10%、86.50%、87.74%和85.86%。表明大部分实验室具备了鲫造血器官坏死病病原检测能力和质量管理水平[12],可以承担该病原的检测和监测工作,为有关部门提供技术支持工作。
病原检测的能力验证样品,一般采用活病原、病原总核酸或核酸片段来制备[13]。由于用活病毒做能力测试有病原泄漏和扩散的风险,中国也明令禁止随意转运。为尽量模拟实际情况,本项目将健康草鱼(Ctenopharyngodonidella)组织匀浆液与包含病毒DNA的病毒样颗粒溶液混合,作为检测能力验证样品。病毒样颗粒溶液中包含CyHV-2的pol和hel目的基因片段,因此可以使用PCR方法进行检测;同时病毒样颗粒具有病毒结构特点,除满足安全稳定的条件外,无生物安全风险。因实际检测工作中是提取感染组织的DNA进行检测,该项目不仅可以验证各参加实验室的PCR检测能力,还可以验证其从组织中提取核酸的能力。
本单位承担的“鲫造血器官坏死病病原检测”能力测试项目均按照组织核酸提取、PCR、测序的技术方法判定结果,每个实验室4份测试样品。结果报告单中要求每个参测实验室注明所使用的仪器设备、参考物质的种类及来源、采标情况、核酸制备方法、检测结果及测试中出现的问题等,同时需附完整实验记录。上述信息的提供用以考察和评定参测实验室的检测能力和水平。在检测过程中重点关注以下问题。
3.1 标准的正确运用
依据所采用标准中的结果判定条件,PCR阳性条带,需经测序及序列比对,若比对结果确认为CyHV-2,才能判定为样品阳性。有的参加单位PCR仅检测一个基因或PCR检测结果正确,未对所扩增条带进行测序或者仅对其中一个基因或一个样品检测结果进行测序或序列比对后判定样品核酸阴性或阳性,不符合标准中的结果判定条件。建议参加单位严格按照检测标准中规定的流程和结果判定条件进行检测。核酸制备方法在标准中规定的是常规方法,目前商品化试剂盒应用比较普遍,便捷且提取质量较好,建议检测实验室在选择使用商品化核酸提取试剂盒时应设立常规方法对比监控核酸提取质量,防止假阴性的错误判定。5次能力验证中不满意结果存在7个假阴性结果。
3.2 体系质量控制
此次能力测试活动中结果不满意实验室存在阴性测试样品出现阳性的结果。假阳性结果的出现,主要由以下几方面因素造成:一是硬件环境方面,部分检测实验室空间布局和区域划分存在缺陷,为防止从PCR反应间污染的扩散,最好将PCR实验室分区或者分成多个房间,严格从洁净区(前区)到污染区(后区)的单向流程[14];二是软件操作方面,操作过程不规范、人员技术等方面存在不足,防污染意识淡薄,因此极容易出现假阳性结果的情况;三是测试过程中部分参测单位在结果报告单的模糊分析,暴露了对CyHV-2检测流程不够熟悉等问题。建议承担检测任务的实验室加强该方面培训,将检测误差风险降到最低。此次测试结果不满意的实验室中,57次不满意结果中有13次是假阳性和假阴性导致,占22.80%。导致假阳性的主要原因是在试验过程中未严格按照操作规程进行,忽视细节,导致样品污染。为避免产生假阳性,应在以下检测步骤中特别注意:DNA提取过程中避免交叉污染,尤其注意更换移液器吸头和避免手指沾染样品液体;PCR反应体系加样时,注意更换移液器吸头,按照空白对照、阴性对照、待检样品、阳性对照的顺序加样;电泳点样时,避免样品量过多溢出点样孔,或手抖使样品流入其他点样孔[15]。
3.3 参考物质的规范
参考物质作为整个检测质量体系运行情况的监控与指示起到非常重要的作用,其使用和保存均应有规范的记录并应统一或者定期对其有效性进行监控[11,16]。有的单位PCR检测未设置阳性对照,有的单位结果报告中电泳图未作标记。不满意结果中有10次是因上述原因导致的。
3.4 样品接收时间
因能力测试项目参加单位较多,能力测试样品分批次使用快递发出,据统计,接收样品时间期限从2 d到5 d不等,样品的性质未受到气温等外界因素的影响。稳定性试验结果显示37 ℃放置9 d时仍能扩增出目的条带。
3.5 实验室间检测能力的差异
实验室检测能力,除了测试预期结果满意外,其他的细节,比如实验记录、沟通交流、问题处理等方面也可以全面反映出一个实验室的综合能力。通过此次能力测试活动,在参测实验室中确实存在能力参差不齐的情况。
能力测试项目开展过程中,随样品寄送了测试项目的“作业指导书”,对参测单位的代码、样品的保存方式、状态、采用标准、结果提交时间等信息做了详尽的说明。但部分实验室对作业指导书重视度不够,并未认真阅读和理解,从而影响检测结果的判定。某些单位未按照作业指导书要求提交完整的实验记录,建议参加单位认真阅读“作业指导书”,严格按照指导书的要求撰写结果报告单和实验记录。
4 结语
2018—2022年先后开展的5次鲫造血器官坏死病病原检测能力验证项目,检测样品为CyHV-2-pol、CyHV-2-hel病毒样颗粒溶液与草鱼组织匀浆液制备的盲样,检测标准为GB/T 36194—2018《金鱼造血器官坏死病毒检测方法》。经统计,2018年有67家单位参加能力验证测试,满意率86.57%;2019年有71家单位参加能力验证测试,满意率83.10%;2020年有74家单位参加能力验证测试,满意率86.50%;2021年有106家单位参加能力验证测试,满意率87.74%;2022年有92家单位参加能力验证测试,满意率85.86%。除2019年满意率稍低外,其余4年均超过85.00%。通过这5次能力验证活动,客观反映了国内实验室CyHV-2核酸检测技术水平较高,因技术问题导致检测结果错误的占不满意结果的22.80%,今后还需在实验室管理和试验操作细节上严格控制[17]。因此,通过此项能力验证,表明大部分实验室具备了鲫造血器官坏死病病原检测能力和质量管理水平,可以承担该病原的检测和监测工作,同时各参加实验室有必要将实验室管理和技术人员能力测试考察工作长期化,以期不断提升和维持各实验室的检测能力水平,为中国水生动物疫病监测和防控提供技术支持。
