基于线粒体D-loop序列的不同群体刀鲚遗传多样性研究
2023-10-08贾一帆张赛赛王伟赵啸孙瑶
贾一帆,张赛赛,王伟,赵啸,孙瑶
(1.大连海洋大学 辽宁省北方鱼类应用生物学与增养殖重点实验室,辽宁 大连 116023;2.大连市海洋发展事务服务中心,辽宁 大连 116113;3.大连海关,辽宁 大连 116001)
刀鲚(Coilianasus)属鲱形目(Clupeiformes),鳀科(Engraulididae)、鲚属(Coilia),俗称刀鱼,是中国的一种重要经济鱼类[1]。刀鲚为近岸溯河性小型鱼类,一般栖息于海洋和近岸,常在江河口附近的近海海域生活。在中国、日本、朝鲜沿海和与之相通的河流、附属湖泊均有分布,在中国主要分布于渤海、黄海以及东海区域[2-3]。刀鲚肉质鲜美,与鲥(Tenualosareevesii)、暗纹东方鲀(Takifuguobscurus)合称“长江三鲜”,深受人们喜爱。历史上长江刀鲚产量极高,捕获量达到当时长江鱼类天然捕捞量的35%~50%,曾在1973年达到最高值,此后在总体趋势上逐年递减;长期以来由于环境恶化、捕捞过度等因素,如今长江刀鲚已形不成渔汛,长江刀鲚洄游距离也大幅缩短[4],保护长江刀鲚资源迫在眉睫,同时对中国其他地区的刀鲚资源进行调查、研究与保护也刻不容缓。
线粒体存在于大多数真核生物的细胞内,线粒体基因组(Mitochondrial DNA,mtDNA)是存在于细胞核外线粒体中的遗传物质,mtDNA为闭合环状结构,在结构与功能上都与核DNA不同[5-6],mtDNA结构较为简单,分子量小,多拷贝,易分离,且具高度专一性、独特性,具有独立复制的能力;在同一个体内为单倍体,突变率高、重组率低,除少数个例以外具有严格的母系遗传,便于群体遗传学的研究[7-10]。mtDNA中分为有编码区及非编码区,线粒体DNA控制区(Control region,CR,也称为 D-loop 区)即为非编码区,属mtDNA中的高变区,进化速率相对较快,碱基替换率比mtDNA其他区域高5~10 倍,序列多态性丰富,是广泛应用于种内多样性研究的分子标记方法[11-12]。现今线粒体D-loop分子标记技术常用于鱼类的遗传多样性及系统分类学的研究。张燕萍等[13]以线粒体DNA D-loop全序列为分子标记,研究了刀鲚与短颌鲚(Coiliabrachygnathus)的遗传多样性,结果表明刀鲚与短颌鲚之间尚未达到种或亚种的分化。白云等[14]通过分析线粒体DNA D-loop及相邻区段对5种鲤[乌克兰鳞鲤(Cyprinuscarpio)、德国镜鲤(CyprinuscarpioL mirror)、框鳞镜鲤(Cyprinuscarpiovar.specularis)、红镜鲤(Cyprinuscarpiored var.mirror)和州河鲤(Cyprinuscarpioheamatopterus)]进行了遗传多样性分析。管嘉俊等[15]通过线粒体DNA D-loop区域的分析比较对尼罗罗非鱼(Oreochromisniloticus)的遗传分化进行了研究。李潮[16]通过对线粒体D-loop区的研究,探讨了珠江赤眼鳟(Squaliobarbuscurriculus)的遗传多样性与遗传分化。付秀兰等[17]利用线粒体D-loop序列的分析对瓯江口日本鳗鲡(Anguillajaponica)幼苗进行了遗传鉴定。目前通过线粒体D-loop区段对鱼类遗传多样性方面做的研究还有很多,如带鱼(TrichiuruslepturusLinnaeus)[18]、小黄鱼(Pseudosciaenapolyactis)[19]、棘头梅童鱼(Collichthyslucidus)[20]、大鳞副泥鳅(Paramisgurnusdabryanus)[21]等。刀鲚线粒体基因组包含13个蛋白质编码基因、22个tRNA基因、2个rRNA基因和2个非编码区(控制区和OL)[22]。对不同地理群体的刀鲚D-loop进行序列分析,建立生物系统发育树可探究不同地理群体间的相互联系。本研究对线粒体D-loop区域进行分析,运用最大简约法(Maximum parsimony,MP)和距离矩阵邻接法(Neighbor joining,NJ)探究东北地区辽河、大洋河和鸭绿江以及南方地区太湖共4个不同地理群体刀鲚的系统发育关系,完善中国刀鲚遗传多样性研究资料,为中国刀鲚资源的管理和保护提供科学依据。
1 材料与方法
1.1 样品的采集
本实验用样品采集自4个不同的地理群体,分别为北方地区的辽河、大洋河和鸭绿江群体,以及南方地区的太湖群体。由于野生刀鲚资源稀少,共采集34尾刀鲚,各地理群体采集数量及采集信息如表1所示。所有样本均采集自天然水域,并依据臀鳍鳍条数小于90和耳石形态鉴定刀鲚种类[23]。采集到的样品均为成体,-20 ℃冷冻保存并运送到实验室。

表1 4个刀鲚群体样本的基本信息Tab.1 Basic information of Coilia nasus of the four populations
1.2 基因组DNA的提取、PCR扩增及测序
选用天根生化科技(北京)有限公司的海洋动物基因组DNA提取试剂盒(DP324)提取刀鲚肌肉组织全基因组DNA,提取得到的基因组DNA经1%琼脂糖凝胶电泳检测后保存在-20 ℃冰箱中备用。
在GenBank中下载七丝鲚(Coiliagrayii,GenBank:KP317088.1)、凤鲚(Coiliamystus,GenBank:KF056322.1)和刀鲚(Coilianasus,GenBank:KJ710626.2)的mtDNA序列,扩增刀鲚线粒体D-loop序列第二高变区的上游引物为NDLF(5′- CTCAAGGCACCTGGTAAAT- 3′),下游引物为NDLR(5′- ACTTGTCTGGGTCGTAGGG - 3′)。引物均由生工生物工程(上海)股份有限公司合成,引物溶解稀释后-20 ℃保存备用。PCR反应体系均为20 μL,包括2×EasyTaq PCR SuperMix(全式金AS111)10 μL,上、下游引物(10 μmol/L)1μL,模板(10~100 ng/μL)1μL,双蒸水7 μL。PCR扩增反应条件下如下:94 ℃预变性3 min;94 ℃变性40 s,55 ℃退火50 s,72 ℃延伸1 min,共36个循环;72 ℃延伸10 min,4 ℃保存。
扩增后的PCR产物纯化后送至生工生物工程(上海)股份有限公司进行正反向双向测序,测序引物与扩增引物相同。
1.3 数据分析
通过使用BLAST序列比对工具将测序获得序列与NCBI数据库(http://www.ncbi.nlm.nih.gov/)中序列进行对比,PCR扩增片段确定为刀鲚线粒体DNA D-loop序列。使用DNAMAN和EditSeq工具将反向测序结果转成正向进行比对,并进行手工校对。使用MEGA 6.0、DNASP 4.10生物信息学软件分析检测4个群体刀鲚的D-loop区部分序列,获得4个群体有关的遗传信息:单倍型数(h)、单倍型多样性指数(Hd)、核苷酸多样性指数(π)以及平均核苷酸差异数(K)。再用分子变异分析方法(AMOVA)分析群体间遗传分化指数Fst并检测其显著性。
2 结果与分析
2.1 序列组成
在与NCBI数据库比对后确认PCR扩增得到序列为刀鲚mtDNA D-loop区域第二高变区序列。4个地区刀鲚D-loop序列已上传至Genbank,DYH 1~10登陆号分别为:MT360271-MT360280;TH 1~9登陆号分别为:MT360281-MT360289;YLJ 1~7登陆号分别为:MT360290-MT360296;LH 1~8登陆号分别为:MT360297- MT360304。将34条刀鲚D-loop序列经比对剪切后得到长度为489 bp的序列。4个刀鲚群体的碱基组成基本相似,T、C、A、G碱基的平均含量为别为31.90%、24.30%、26.60%和17.20%。A+T的含量(58.50%)明显高于G+C含量(41.50%)。
在34尾个体中获得12个单倍型(表2),其中Hap_6单倍型为4个群体共有,Hap_2和 Hap_4单倍型为辽河群体、大洋河群体和太湖群体3个群体共有,辽河群体特有的单倍型有2个(Hap_11、Hap_12),大洋河群体特有的单倍型有3个(Hap_1、Hap_3和Hap_5),鸭绿江群体特有的单倍型有4个(Hap_7、Hap_8、Hap_9、Hap_10),占总单倍型数的75.00%。
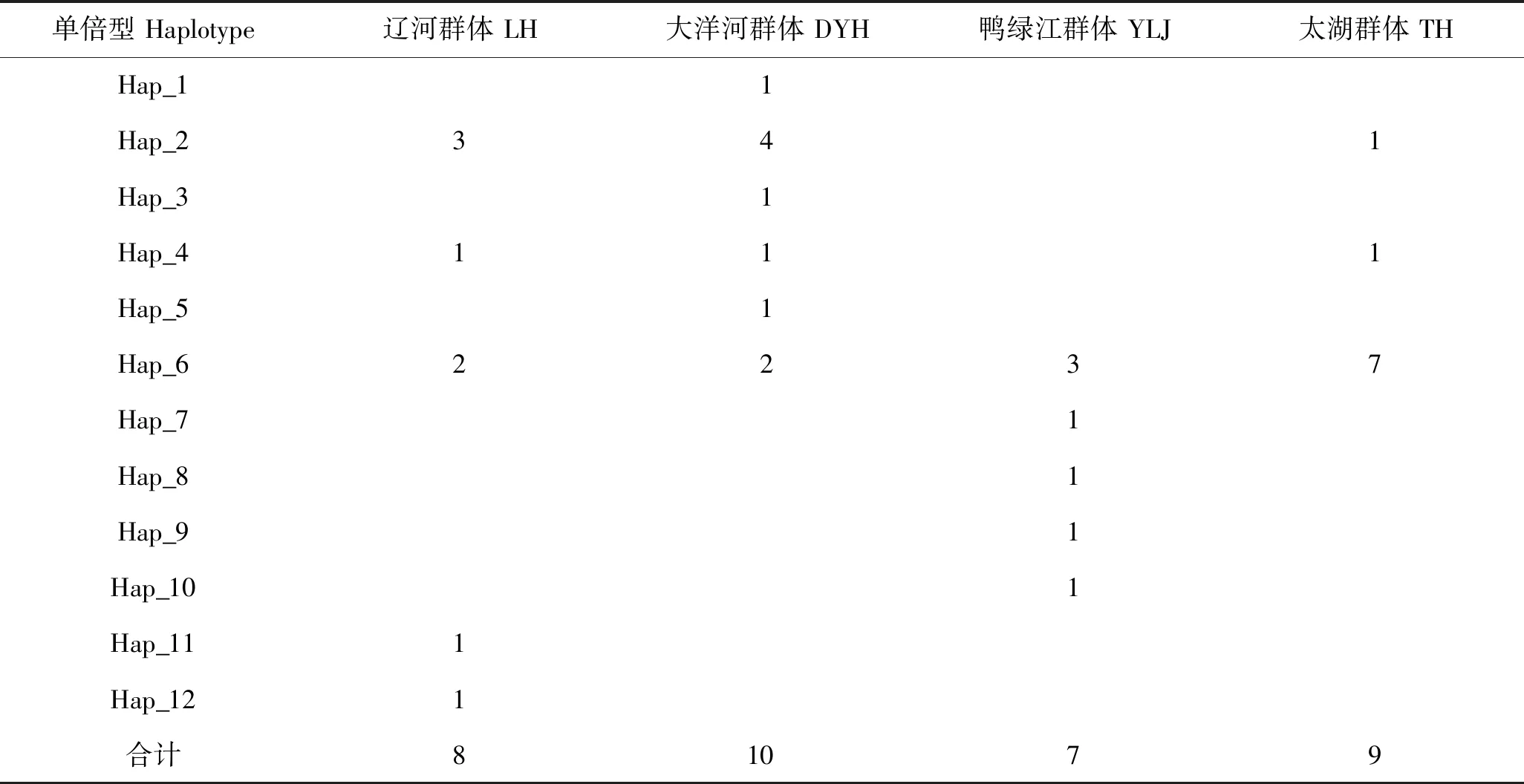
表2 刀鲚D-loop部分序列单倍型在各群体中的分布Tab.2 The distribution of haplotypes in the four Coilia nasus populations
2.2 遗传多样性
表3为刀鲚群体的遗传多样性信息,各群体核苷酸多样性指数(π)在0.000 91~0.003 51之间,4个不同地理群体间核苷酸多样性排序为鸭绿江群体(0.003 51)>大洋河群体(0.003 18)>辽河群体(0.002 63)>太湖群体(0.000 91)。4个群体刀鲚具有较丰富的单倍型多态性0.417 00~0.857 00,辽河和鸭绿江群体单倍型多态性均为0.857 00,其次为大洋河群体(0.844 00),最后为太湖群体(0.417 00)。Tajima′s检验结果显示4个不同地理群体均为负值(-1.761 79~-0.726 73)但未达到显著差异,其中鸭绿江群体D值为-1.761 79<0,P<0.05,显著偏离中性模式。
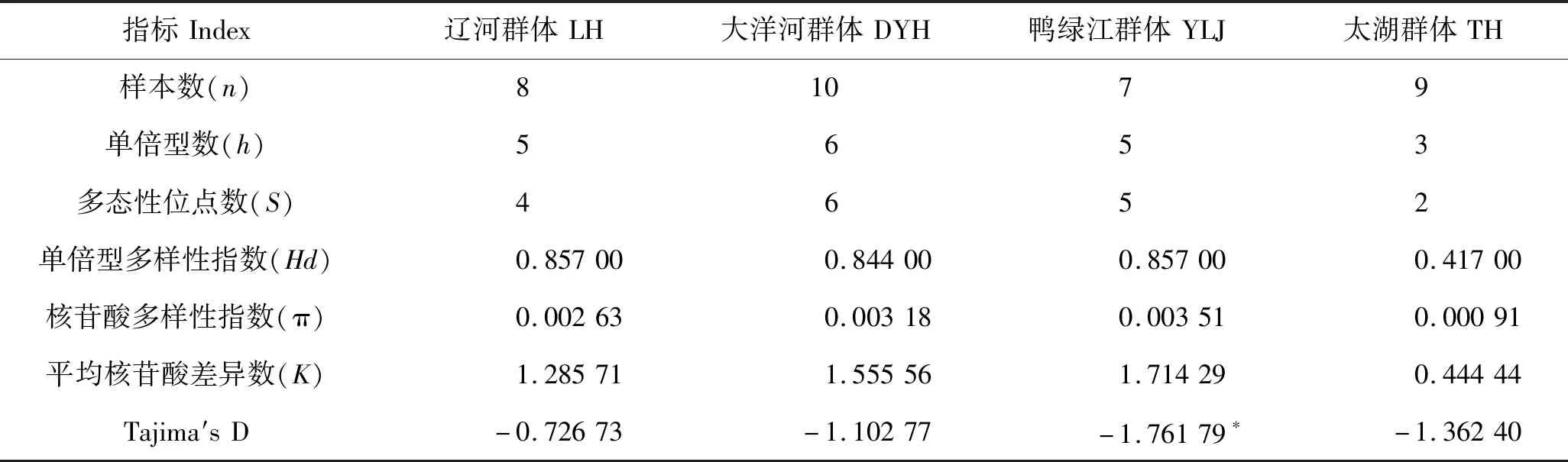
表3 4个群体刀鲚遗传多样性参数Tab.3 Intra-population genetic diversity in the four Coilia nasus populations
2.3 遗传结构
根据各群体刀鲚D-loop区域部分序列分析见表4,4个群体的平均遗传距离为0.001 77~0.003 23,其中太湖与辽河群体之间遗传距离最小0.001 77,大洋河和鸭绿江群体之间遗传距离最大0.003 23。表5各群体的分子变异分析(AMOVA)结果显示:Fst=0.005 43<0.050 00(P<0.05),即群体间变异占0.54%,群体内变异占99.46%,表明太湖刀鲚和北方地区刀鲚群体间分化较小。
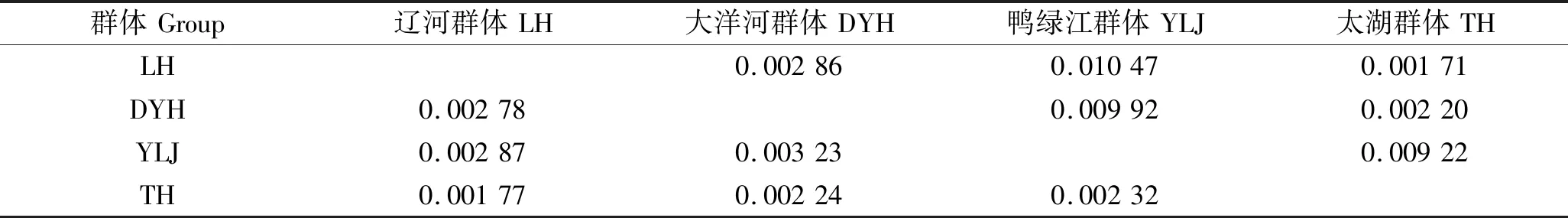
表4 刀鲚群体间遗传距离(左下方)与核苷酸多样性(右上方)Tab.4 Population pairwise genetic distance(lower-left) and nucleotide diversity (upper-right)
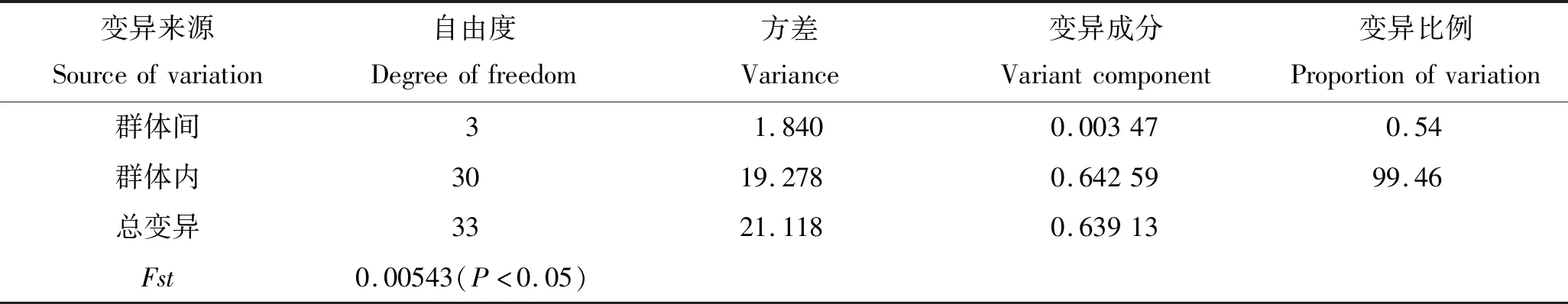
表5 刀鲚群体间遗传差异的分子变异分析Tab.5 Analysis of molecular variance among the populations of Coilia nasus
2.4 分子系统发育树的构建
选用鳀科中分化较早的日本鳀(Engraulisjaponicus)和秘鲁鳀(Engraulisringens)作为外群,Genbank登录号分别为AB040676和AY184229。基于Kimura双参数模型构建最大简约法(MP)和邻接法(NJ)单倍型分子系统进化树。系统进化树显示:图1和图2 结果基本一致,4个群体刀鲚不能明显区分开,每个群体都出现3~5个个体相邻近,4个群体均混在一起,通过刀鲚D-loop区域部分序列标记信息可知4个群体的刀鲚样本基本未发生分化。
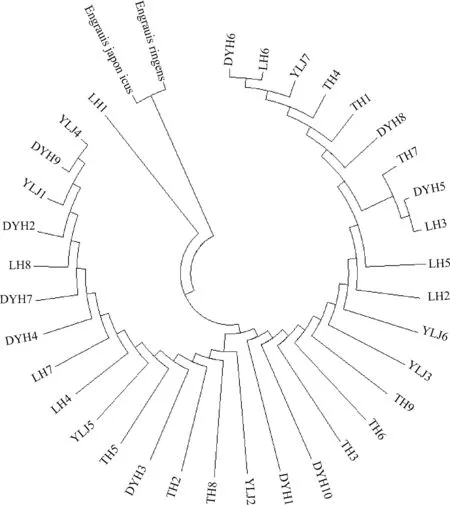
图1 刀鲚D-loop部分序列的MP分子系统树Fig.1 MP tree based on partly mtDNA D-loop sequences
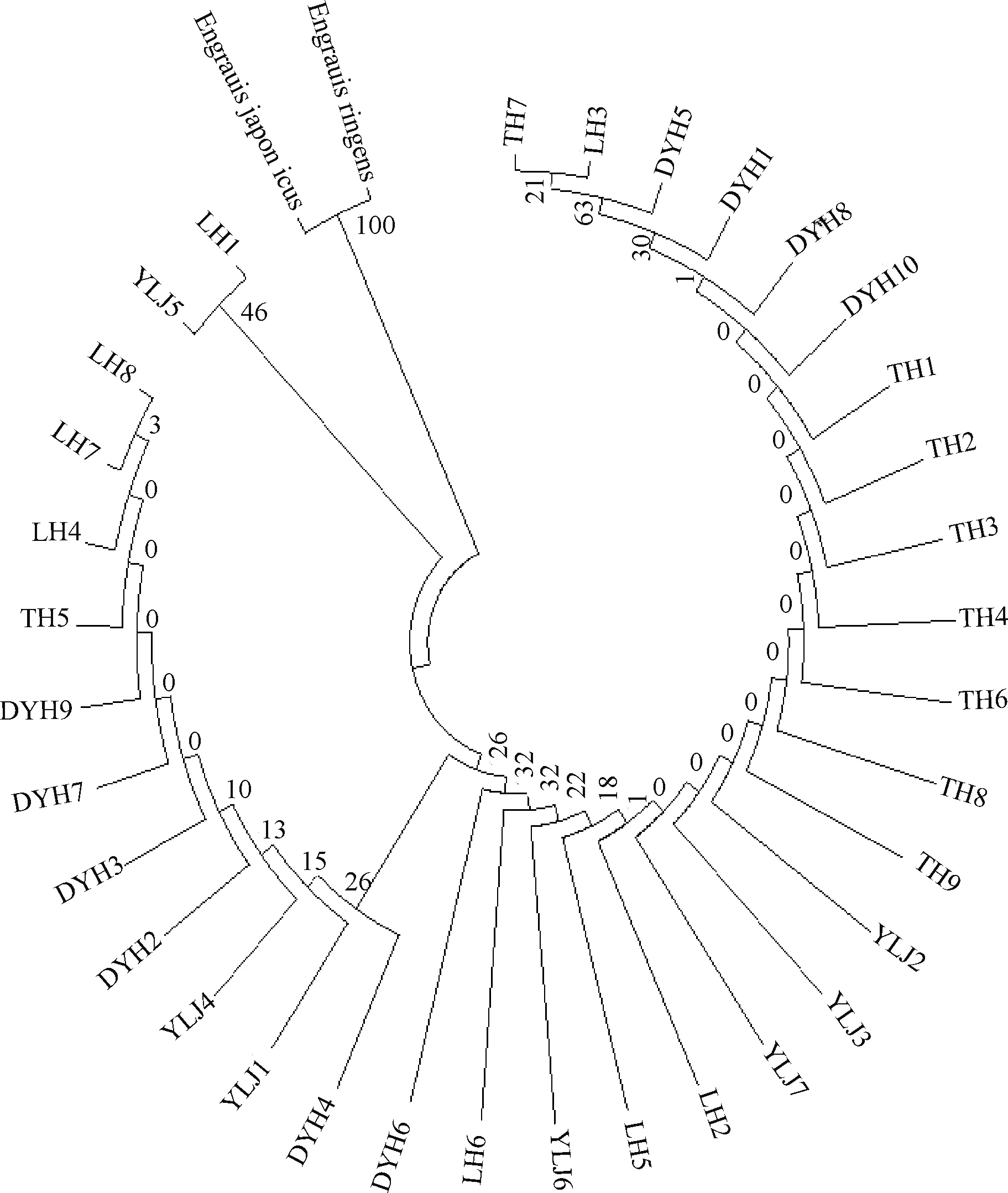
图2 刀鲚D-loop部分序列的NJ分子系统树Fig.2 NJ tree based on partly mtDNA D-loop sequences
3 讨论
3.1 不同地区刀鲚群体的序列组成与遗传多样性
遗传多样性是生物多样性的重要组成部分,是生物长期进化与选择的结果。遗传多样性的丰富度与物种的生存能力及进化潜力有密切的相关性[24]。由于环境污染、过度捕捞、栖息地破坏等原因,中国刀鲚资源遭到破坏,产量锐减。2017年刀鲚作为“濒危”级别列入《世界自然保护联盟濒危物种红色名录》。
本研究采用mtDNA D-loop分子标记法将南方地区的太湖刀鲚群体做为对照,与辽宁地区的辽河、大洋河和鸭绿江4个群体的刀鲚进行遗传多样性进行研究。本研究中4个群体共计34尾刀鲚的mtDNA D-loop序列经比对剪切后获得长度为489 bp的序列,且4个刀鲚群体的碱基组成基本相似,A+T的含量(58.50%)明显高于G+C含量(41.50%),显示出较强的碱基偏倚性,符合一般脊椎动物mtDNA D-loop区域碱基组成的特点[25]。在34尾个体中共检测获得12个单倍型(Hap_1~Hap_12,见表1)。其中Hap_6单倍型为4个群体共有,Hap_2和 Hap_4单倍型为辽河、大洋河和太湖3个群体共有,Hap_11、Hap_12为辽河群体特有单倍型,Hap_1、Hap_3和Hap_5为大洋河群体特有单倍型,Hap_7、Hap_8、Hap_9、Hap_10鸭绿江群体特有单倍型,表明4个群体之间有过基因交流,大洋河、辽河及太湖群体间也发生过基因交流。其中鸭绿江群体表现出相对丰富的单倍型数。推测刀鲚群体早期数量大、分布范围较为广泛,加之刀鲚具备海中交配、洄游产卵的生活史,为基因交流提供可能。在比较遗传多样性方面,单倍型多样性和核苷酸多样性可作为两个重要指标[26]。据Grant等[27]的研究,提出将0.5作为单倍体多样性的界限,0.005作为核苷酸多样性的界限,数值越大,群体间遗传多样性分化越大。在单倍型多态性方面,4个群体单倍型多样性介于0.417 00~0.857 00之间,辽宁地区的辽河和鸭绿江群体单倍型多态性均为0.857 00,大洋河群体单倍型多态性为0.844 00,均明显高于太湖群体单倍型多态性(0.417 00)。在核苷酸多样性指数方面,4个群体核苷酸多样性指数介于0.000 91~0.003 51之间,辽宁地区鸭绿江群体核苷酸多样性为0.003 51,大洋河群体核苷酸多样性为0.003 18,辽河群体核苷酸多样性为0.002 63,均明显高于太湖群体核苷酸多样性(0.000 91)。
3.2 不同地区刀鲚群体的遗传分化及种群动态
群体间的遗传分化指数是表示群体间的遗传分化程度的指标,Fst值较小,表示群体间分化程度相对较低,Fst值较大,表示群体间的分化程度相对较高[31]。范围为:Fst<0.05,群体间无遗传分化;0.05
根据构建的MP和NJ分子系统发生树可以看出各群体间未发生分化,来自不同群体的个体彼此相互交错分布,没有呈现显著的谱系结构,证实了AMOVA的分析结果,也反映了刀鲚群体间遗传分化水平较低这一结论。同时发现4个刀鲚群体分子系统发生树中出现DYH5、TH7和LH3三个体聚成一支,猜测辽宁地区3个刀鲚群体在可能存在基因交流。研究结果表明,相较于太湖群体,辽宁地区刀鲚群体遗传多样性整体较为丰富,其中鸭绿江刀鲚群体是辽宁地区3个群体中遗传多样性最丰富的;由于刀鲚的洄游生活史,太湖地区与辽宁地区刀鲚群体可能在海洋中存在基因交流,但尚未形成明显的遗传分化,仍保持在个体间的随机交配。
4 结论
结果显示辽宁地区刀鲚群体遗传多样性高于太湖群体,其中鸭绿江刀鲚群体尤为突出。本研究中辽宁地区的3个群体表现为高单倍体多样性,低核苷酸多样性;太湖群体表现为中单倍体多样性,低核苷酸多样性。辽宁地区3个群体这种高单倍型与低核苷酸多样性的现象可能是由于种群发生瓶颈效应以后进行快速增长,导致单倍型多样性快速增长,但核苷酸多样性尚未得到足够时间的积累所造成的[27]。从侧面说明辽宁沿海地区河流、海口的环境适宜刀鲚生长。这种模式与另一种在辽宁沿海地区分布的褐斑鲬(Platycephalussp.)[28]遗传多样性模式相同,也与对小黄黝鱼(Micropercopsswinhonis)[29]、黄斑篮子鱼(Siganusoramin)[30]的研究结果相似。在Tajima′s检测结果中,4个地区中只有鸭绿江群体(-1.761 79)P<0.05,偏离中性模式,表明鸭绿江群体刀鲚可能经历过群体扩张。太湖、辽河和大洋河群体Tajima’s D值分别为-1.362 40、-0.726 73和-1.102 77,均小于零,但并不显著,说明这三个地区刀鲚群体较稳定。
综上所述,在今后的渔业资源调查管理与保护过程中,还需要采用多种分子生物学标记技术相结合的方式对刀鲚资源进行监测,以强化对刀鲚资源的合理保护,构建刀鲚资源的可持续开发利用模式。
