投喂方式对斑点叉尾生长性能的影响
2023-10-07张文平刘洪岩张世勇钟立强王明华陈校辉
张文平,刘洪岩,张世勇*,钟立强,王明华,陈校辉,
(1.江苏海洋大学海洋科学与水产学院,江苏 连云港 222005;2.江苏省淡水水产研究所,江苏 南京 210017;3.江苏省农业种质资源保护与利用平台,江苏 南京 210014)
在环境胁迫或人工控制下,鱼类停止进食,解除胁迫或人工控制后,鱼类恢复摄食,其生长速度得到不同程度的提高,这种生长机制被称为补偿性生长[1]。各种鱼类的补偿生长能力有所不同[2],按照恢复程度的不同,将补偿性生长分为四类,分别为超补偿生长、完全补偿生长、不完全补偿生长和完全不补偿生长[3]。补偿生长的机制尚不明确,有3 种可能:(1)在饥饿后增强了摄食欲望,提高了饵料摄入量;(2)在饥饿后提高了饵料转化率;(3)以上2 种情况同时存在[4]。目前,主要通过测量体质量、体长、质量增加率和饵料转化率等指标,评估是否存在补偿生长和补偿生长程度[5-6]。
鱼类缺少外来营养物质的补充,代谢发生适应性变化,其通过对体内消化酶的调节,稳定和维持生命活动[7]。在失去外来营养物质的供给,肝脏的代谢反应,是维持机体生命活动能量的主要来源[8]。通过测定肝脏消化酶的变化,以了解机体在饥饿胁迫及复投喂后的代谢调节。在对黑鲷(Acanthopagrus schlegelii)20 d 的饥饿复投喂试验中发现,饥饿对脂肪酶的调节最为显著,饥饿时,脂肪酶活力被显著上调,在复投喂后,其恢复到试验前水平[9]。在对黄鳝的饥饿研究中发现,随着饥饿时间的延长,其蛋白酶、淀粉酶和脂肪酶均被显著下调[10]。
在饥饿胁迫下,鱼类体内的营养物质被氧化分解来提供能量。在这个过程中,活性氧的生成速率变高,超量的活性氧所产生的自由基,会造成细胞DNA、脂质与蛋白质等大分子损伤[11]。而体内抗氧化体系的调节,是体内各种分子抵抗自由基氧化的保证[12]。抗氧化体系主要由过氧化氢歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶等组成[13]。
目前,对多种水产生物均开展了饥饿和复投喂过程中机体生长、组织消化酶和抗氧化酶变化规律的研究,如对牙鲆(Paralichthys olivaceus)、黄鳝(Monopterus albus)、团头鲂(Megalobrama amblycephala)等研究[14-16],而未对斑点叉尾(Ictalurus punctatus)进行系统性研究。斑点叉尾,属鲇形目(Siluriformes),科(Ictaluridae),是世界上养殖最为广泛的鱼类之一[17]。自20 世纪80 年代引入我国后,先后突破了养殖、苗种繁育、流通、加工等技术难关,已成为斑点叉尾最重要的生产和消费国[18]。现对斑点叉尾开展饥饿和复投喂试验,并比较其生长性能、消化酶和抗氧化酶活性,以掌握在饥饿胁迫下以及解除胁迫后,斑点叉尾的补偿性生长性能和生理响应机制。
1 材料与方法
1.1 时间与地点
2022 年8 月24 日—10 月5 日。试验地点位于江苏省淡水水产研究所扬中基地。
1.2 试验设计
1.3 生长性能指标计算
式中:t2、t1——不同时间,周;
M2、M1——t2、t1时,斑点叉尾体质量,g;
ML——肝脏质量,g;
MB——肝脏对应鱼体质量,g;
F——一周投喂量,g。
1.4 抗氧化酶和消化酶活性测定
称取一定质量肝脏组织样本,按质量(g)∶体积(mL)=1∶9,加入无菌生理盐水,在冰水浴条件下进行机械匀浆,于4 ℃、2 500 r/min 离心10 min,收集上清液。按照试剂盒说明书,测定肝脏抗氧化酶、消化酶活性,抗氧化酶包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSHPX),消化酶包括蛋白酶(PTA)、脂肪酶(LPA)和淀粉酶(ALA)。试验用试剂盒均购自南京建成生物工程研究所。
1.5 数据分析
试验结果以“平均值±标准差”表示。使用Excel 2019 和Origin2021 软件进行数据处理,采用Origin2021 软件单因素方差分析模块,进行差异性比较,P<0.05 作为差异显著性判断标准。
2 结果与分析
2.1 CG 组与EG 组斑点叉尾生长性能
表1 CG 组与EG 组斑点叉尾的生长指标①
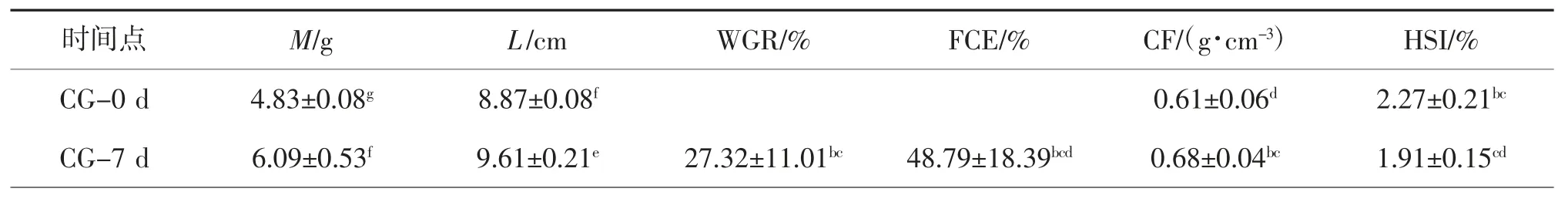
表1 CG 组与EG 组斑点叉尾的生长指标①
时间点M/gL/cmWGR/%FCE/%CF/(g·cm-3)HSI/%CG-0 d4.83±0.08g8.87±0.08f0.61±0.06d2.27±0.21bc CG-7 d6.09±0.53f9.61±0.21e27.32±11.01bc48.79±18.39bcd0.68±0.04bc1.91±0.15cd
续表
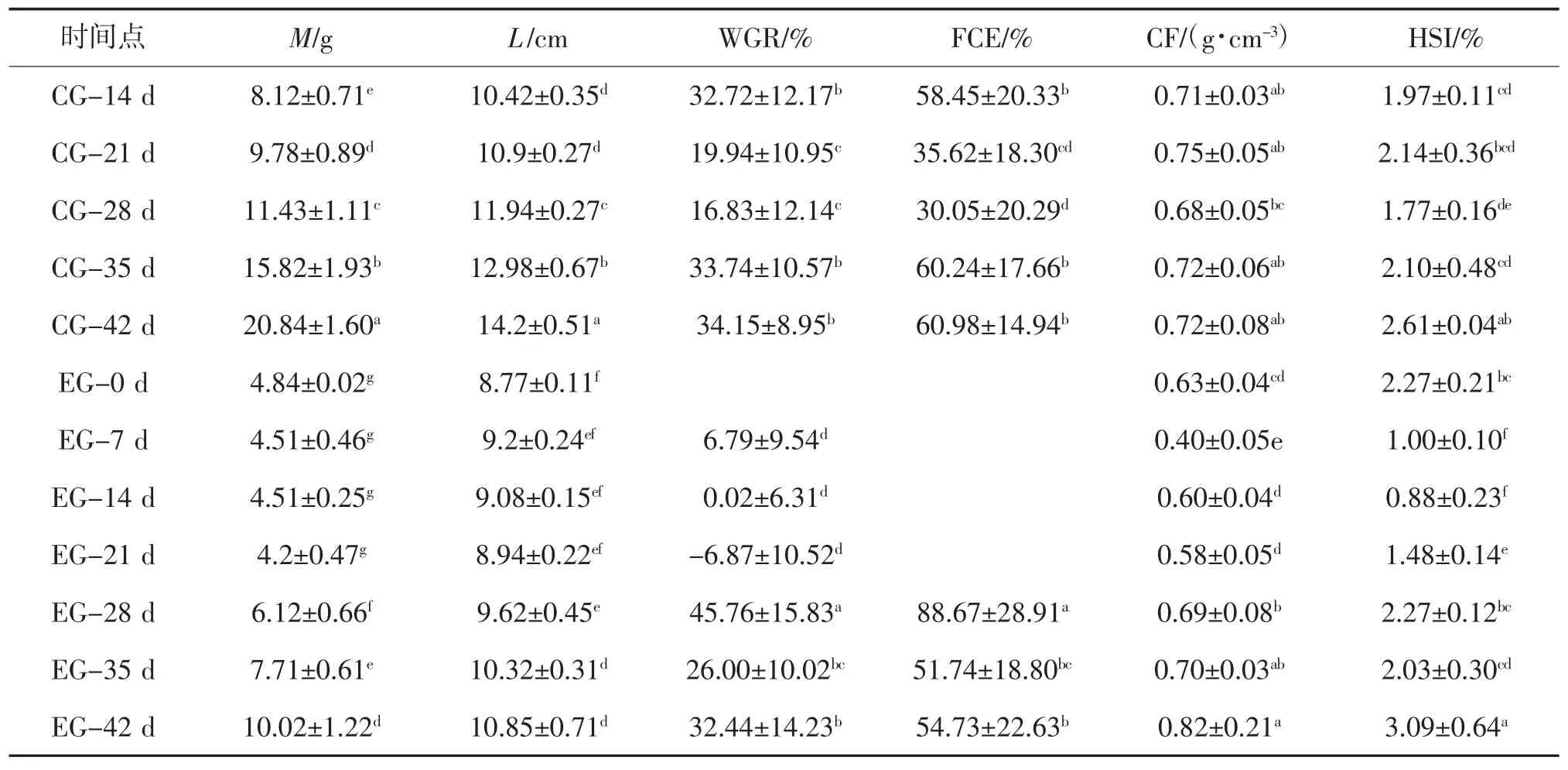
表1 CG 组与EG 组斑点叉尾的生长指标①
①同列数据肩标字母相同表示组间差异不显著(P>0.05);字母不同表示组间差异显著(P<0.05)。
时间点M/gL/cmWGR/%FCE/%CF/(g·cm-3)HSI/%CG-14 d8.12±0.71e10.42±0.35d32.72±12.17b58.45±20.33b0.71±0.03ab1.97±0.11cd CG-21 d9.78±0.89d10.9±0.27d19.94±10.95c35.62±18.30cd0.75±0.05ab2.14±0.36bcd CG-28 d11.43±1.11c11.94±0.27c16.83±12.14c30.05±20.29d0.68±0.05bc1.77±0.16de CG-35 d15.82±1.93b12.98±0.67b33.74±10.57b60.24±17.66b0.72±0.06ab2.10±0.48cd CG-42 d20.84±1.60a14.2±0.51a34.15±8.95b60.98±14.94b0.72±0.08ab2.61±0.04ab EG-0 d4.84±0.02g8.77±0.11f0.63±0.04cd2.27±0.21bc EG-7 d4.51±0.46g9.2±0.24ef6.79±9.54d0.40±0.05e1.00±0.10f EG-14 d4.51±0.25g9.08±0.15ef0.02±6.31d0.60±0.04d0.88±0.23f EG-21 d4.2±0.47g8.94±0.22ef-6.87±10.52d0.58±0.05d1.48±0.14e EG-28 d6.12±0.66f9.62±0.45e45.76±15.83a88.67±28.91a0.69±0.08b2.27±0.12bc EG-35 d7.71±0.61e10.32±0.31d26.00±10.02bc51.74±18.80bc0.70±0.03ab2.03±0.30cd EG-42 d10.02±1.22d10.85±0.71d32.44±14.23b54.73±22.63b0.82±0.21a3.09±0.64a
EG-28 d 的WGR 和FCE 均显著高于EG-7 d、EG-14 d、EG-21 d、EG-35 d、EG-42 d(P<0.05),见图1(a)(b)。EG-7 d、EG-14 d、EG-21 d 的CF 显著低于CG-7 d、CG-14 d、CG-21 d(P<0.05);恢复投喂后,EG-28 d、EG-35 d、EG-42 d 的CF 与CG-28 d、CG-35 d、CG-42 d 相比,无显著差异(P>0.05)。见图1(c)。EG-7 d、EG-14 d、EG-21 d 的HSI 显著低于CG-7 d、CG-14 d、CG-21 d,复投喂3 周后,EG-42 d 与CG-42 d 无显著差异(P>0.05)见图1(d)。
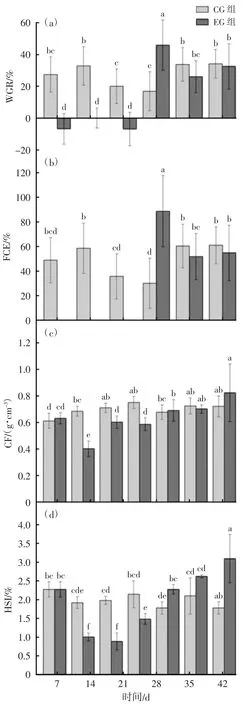
图1 CG 组与EG 组在不同投喂阶段WGR、FCE、CF 和HIS
2.2 CG 组与EG 组斑点叉尾肝脏组织抗氧化酶
随着试验时间的增加,CG-0 d、CG-7 d、CG-14 d、CG-21 d、CG-28 d、CG-35 d、CG-42 d 的CAT 活性逐渐升高,EG-21 d 时,CAT 活性出现下降,但与CG-21 d 相比,无显著差异(P>0.05),见图2(a);在EG-21 d 之后,CAT 活性持续上升,EG-42 d 显著低于CG-42 d(P<0.05)。SOD 活性在EG-14 d 时,显著高于CG-14 d(P<0.05),EG-21 d 时出现下降,在EG-28 d、EG-35 d、EG-42 d 持续上升,与对照组CG-28 d、CG-35 d、CG-42 d 相比,无显著差异(P>0.05),见图2(b)。EG-7 d 和EG-14 d 时,GSHPx 活性持续上升,显著高于CG-7 d 和CG-14 d(P<0.05),EG-21 d 时略有下降,但仍显著高于EG-21 d(P<0.05);之后在EG-28 d、EG-35 d、EG-42 d时,持续上升,仍显著高于CG-28 d、CG-35 d、CG-42 d(P<0.05),见图2(c)。
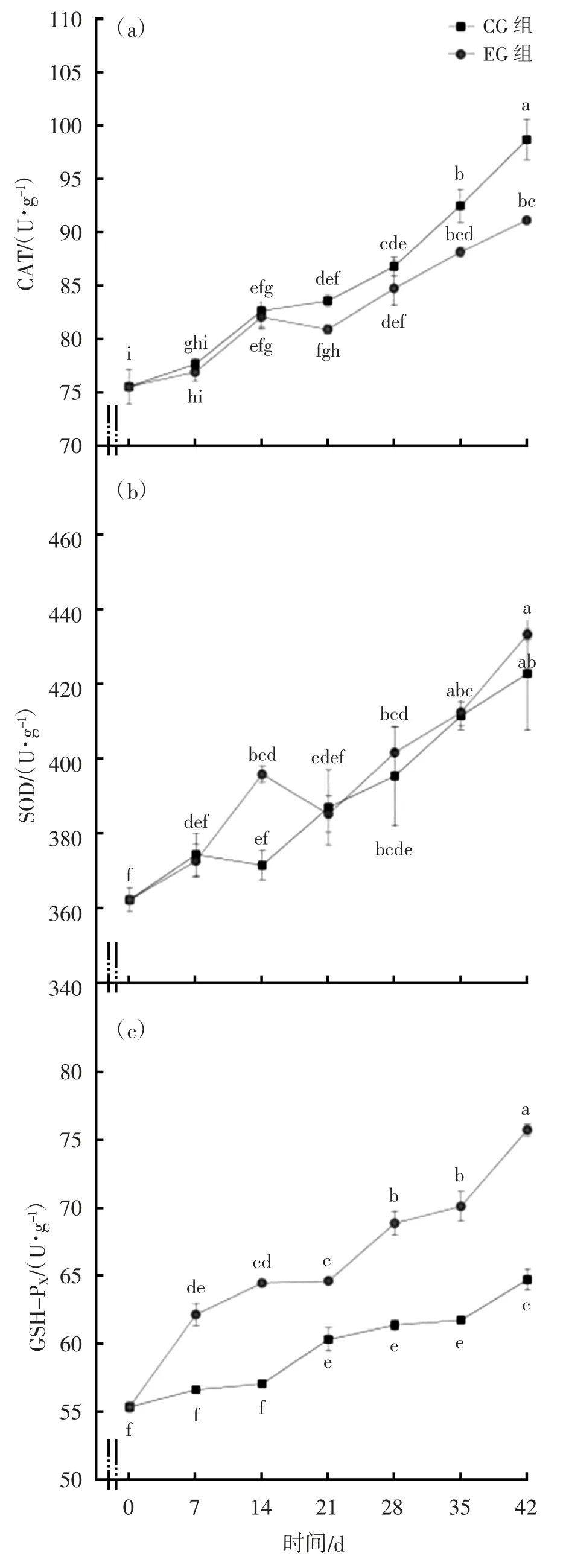
图2 CG 组与EG 组不同投喂阶段CAT、SOD 和GSH-PX 活性
2.3 CG 组与EG 组对斑点叉尾肝脏组织消化酶的影响
EG-7 d、EG-14 d、EG-21 d、EG-28 d、EG-35 d、EG-42 d 的PTA,均显著低于CG-7 d、CG-14 d、CG-21 d、CG-28 d、CG-35 d、CG-42 d(P<0.05);EG-7 d 时,PTA 出现明显的下降(P<0.05),至EG-28 d 时,仍保持相对较低的水平;在EG-35 d 之后开始上升,见图3(a)。EG 组的各时间点的LPA 活性在与对照组没有显著差异(P>0.05),见图3(b)。CG-0 d、CG-7 d、CG-14 d、CG-21 d、CG-28 d、CG-35 d、CG-42 d 的ALA 活性,一直处于相对平稳状态,没有显著差异(P>0.05);而EG-0 d、EG-7 d、EG-14 d、EG-21 d、EG-28 d、EG-35 d、EG-42 d 的ALA 活性一直处于上调状态,与CG-0 d、CG-7 d、CG-14 d、CG-21 d、CG-28 d、CG-35 d、CG-42 d 相比,均被显著上调(P<0.05),见图3(c)。
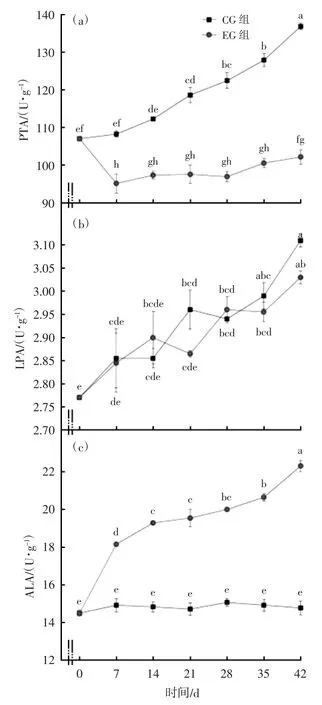
图3 CG 与EG 组在不同时间点PTA、LPA 和ALA
3 讨论
有研究表明,鱼类在受到饥饿胁迫时,会产生大量的活性氧,而抗氧化酶的调节是抵抗自由基氧化的保证[12]。因此常将抗氧化酶活力调节作为环境胁迫程度的指示剂[19]。诸多水产动物在饥饿胁迫下,抗氧化酶活性受到显著性调节,如叶尔羌高原鳅(Triplophysa Yarkandensis),在饥饿15~20 d,显著提高了CTA、SOD 和GSH-Px 的活性[20];日本蟳(Charybdis japonica)在饥饿4 d 时,SOD 活性被显著上调,CTA 活性在饥饿8 d 时被上调,在饥饿12 d 时被下调[21]。在本试验中,在3 种抗氧化酶中被调节最为明显的是GSH-Px,在饥饿和复投喂时,都显著高于对照组。与CAT 与SOD 不同的是,GSH-Px 不仅能清除过氧化氢,而且具备清除脂质过氧化物的能力,说明在早期饥饿状态下,即使在复投喂后,脂质过氧化物造成的影响尚未被消除。本试验中,斑点叉尾与其他鱼类相似的是,经过21 d 的饥饿,3 种抗氧化酶都出现过下降的趋势,但均不显著,并且在复投喂后出现上调;21 d 的饥饿,是斑点叉尾的饥饿极限,如果延长饥饿时间,3 种抗氧化酶活性会否会出现持续下降,需经过试验进一步验证。肝脏是蛋白质、脂肪、糖类3 大营养物质合成、代谢的主要场所,研究肝脏的代谢,是反映饥饿复投喂代谢调节的有效手段[22]。在饥饿情况下,肝脏的代谢反应是维持生命活动的主要能量来源[23-24]。而肝脏中的PTA、ALA 和LPA 在其中发挥重要作用。在对黑鱾(Girella mezina)的饥饿复投喂研究中,肝脏PTA 与LPA 活性被显著下调,ALA没有显著变化[25]。在本试验中,与黑鱾相似的是斑点叉尾肝脏的PTA,在饥饿第一周(EG-7 d),就被显著下调,之后的PTA 活性稍有上升,但在EG-21 d 后,一直维持在较低的水平。可能是由于前3 周(EG-21 d)的饥饿。缺少蛋白质的积累,即使在复投喂后,摄入的蛋白质被优先用于生长。而LPA活力在饥饿前14 d(EG-14 d)一直保持上升,甚至超过了CG-14 d,但在EG-21 d 时出现了下降。与黑鱾的饥饿后保持较低活力不同,说明在饥饿情况下,斑点叉尾会保持较高的脂肪代谢,以应对环境胁迫。在对银鲳幼鱼的饥饿研究中[26],认为ALA 被显著上调,是由于对能量的急迫需求。但在本试验中,即使在复投喂后,ALA 依然在被显著上调。这一现象说明,ALA 被上调,可能并非由能量需求引起。在对哺乳动物的研究中,发现在肝脏受损和胰腺炎等情况下,亦能引起肝脏ALA 的异常调节[27]。说明本试验中ALA 被上调,可能是由于饥饿导致肝脏组织受损所引起的。
