LINC01614对非小细胞肺癌A549细胞增殖、侵袭、细胞周期以及凋亡的影响
2023-10-07白钰明施琳贾永峰刘霞陈永霞云芬
白钰明 施琳 贾永峰 刘霞 陈永霞 云芬
肺癌是所有癌症中发病率和死亡率最高的疾病,严重威胁着人类的健康[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的85%,其组成主要为腺癌与鳞癌。尽管非小细胞肺癌的治疗手段得到了改进,但其预后仍不理想,5年总体生存率较低[2]。长链非编码RNA(long non-coding RNA,lncRNA)是一种长度大于200个碱基对(bp)的分子[3]。近年来,随着研究的深入,lncRNA通过调节肿瘤发生发展的途径,在肿瘤的增殖、侵袭及凋亡中发挥着重要作用[4]。研究表明LINC01614与肺癌的发生发展有一定的关系,但其生物学功能尚不明确[5]。本研究通过沉默非小细胞肺癌A549细胞的LINC01614基因,观察LINC01614对非小细胞肺癌细胞增殖、侵袭、细胞周期及凋亡的影响,以期为NSCLC的诊断与治疗提供新的靶向基因。
资料与方法
一、实验材料
1 细胞株 人非小细胞肺癌细胞株A549购自北纳生物科技有限公司;人支气管上皮细胞株BEAS-2B购自上海百茂生物医药科技有限公司。该研究已通过内蒙古医科大学附属医院伦理委员会批准[NO.WZ(2022034)]。
2 主要试剂 小干扰RNA LINC01614(si-LINC01614)、小干扰RNA Negataive Control(si-NC)购自苏州吉玛生物科技有限公司;胎牛血清、RPMI-1640培养基、青-链霉素、0.25%胰蛋白酶均购自美国Gibco有限公司;InRcute lncRNA qPCR试剂盒、InRcute lncRNA 第一链合成试剂盒、凋亡试剂盒(Annexin V-FITC/PI)、无酶水均购自北京天根生化科技有限公司;CCK试剂盒、TransZol Up、RNase A均购自北京全式金生物技术有限公司;细胞周期试剂盒、不含EDTA胰酶、2%结晶紫染色液均购自北京博奥森生物技术有限公司;4%多聚甲醛购自北京酷来搏科技有限公司;DPBS磷酸盐缓冲液购自北京兰洁柯科技有限公司;细胞培养基质胶购自美国Biozellen有限公司;LipofectamineTM 3000试剂购自美国invitrogen有限公司;PCR引物购自上海生工生物有限公司。
二、实验方法
1 LINC01614在非小细胞肺癌中的表达与临床病理特征及预后的相关分析 从TCGA(The Cancer Genome Atlas)数据库中选取49例正常样本及502例肿瘤样本RNA转录组数据进行LINC01614单基因分析,分析LINC01614在人非小细胞肺癌组织和正常组织中的表达差异。同时选取504例非小细胞肺癌临床数据,将LINC01614的表达与其临床病理特征(性别、年龄、肿瘤分期、肿瘤大小、生存期等)进行相关性分析,P<0.05即差异有统计学意义。
2 细胞培养与转染 BEAS-2B及A549细胞培养于含有1%青-链霉素、10%胎牛血清以及89%RPMI-1640的完全培养基中,置于37℃、含有5% CO2且具有一定湿度的细胞培养箱中。当细胞密度达80%~90%时,将A549细胞接种于六孔板中,接种数量以过夜后密度达50%~70%为宜,分别转染si-LINC01614、si-NC,转染完成后将细胞分为三组,即A549细胞组(对照组)、si-NC细胞组(阴性对照组)以及si-LINC01614细胞组(实验组)。si-RNA序列(见表1)。
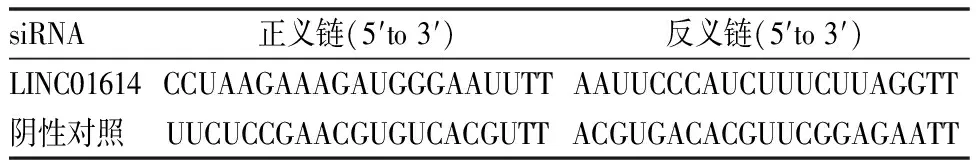
表1 siRNA名称及序列
3 qRT-PCR检测LINC01614在A549细胞与BEAS-2B的差异性表达以及检测A549细胞中LINC01614的转染效果 待细胞密度达到80%~90%,即可提取细胞中的RNA,具体操作步骤按TransZol Up试剂盒说明书进行。用核酸定量仪测定其纯度和浓度,根据InRcute lncRNA 第一链合成试剂盒操作说明进行反转录合成cDNA。按照InRcute lncRNA qPCR试剂盒说明书进行操作,以cDNA作为模板进行PCR特异性扩增,反应条件为预变性:95 ℃ 3 min;变性:95 ℃ 5 s,退火和延伸:60 ℃ 15 s,40个循环。反应结束后观察PCR溶解曲线及扩增曲线,记录每个孔的CT值,采用2-ΔΔCt表示LINC01614的相对表达量,ΔCt=CtLINC01614-CtGAPDH,ΔΔCt=ΔCt实验组-ΔCt对照组,引物序列(见表2)。

表2 引物序列
4 CCK实验检测LINC01614的表达对细胞增殖的影响 将细胞按照1×103个/孔的密度接种于96孔板内部中,每孔加入RPMI-1640完全培养基100μL,置于37℃恒温培养箱中培养12 h;于96孔板中每孔加入10μL的CCK试剂,37℃孵育3 h;用酶标仪测定450nm处吸光度(OD值),测定间隔为24 h,连续测量4次,实验分为三组[A549细胞组(对照组)、si-NC细胞组(阴性对照组)和si-LINC01614细胞组(实验组)],每组设置5个复孔,实验重复3次。
5 长时间动态活细胞成像仪(IncuCyte S3)监测LINC01614对细胞融合率的影响 转染12 h后,即可将细胞接种于96孔板中,每孔细胞密度控制在4×103个,待细胞贴壁后(约12 h)放入IncuCyte S3中,培养条件为37℃,5%CO2。设置拍照间隔时间为12 h,共拍摄48 h。拍摄完毕后根据系统记录分析软件所生成的数据绘制增殖曲线图,横坐标为时间,纵坐标为细胞融合百分比。
6 Transwell细胞侵袭实验 本实验使用Biozellen®3D细胞培养基质胶套装进行配胶。待胶凝后,在Transwell上室分别加入0.1 mL的无血清的RPMI-1640细胞悬液(A549细胞、si-NC细胞以及si-LINC01614细胞),细胞密度为4.5×103个/孔;在Transwell下室中加入0.8 mL的含有10%血清的RPMI-1640细胞培养液。将24孔Transwell细胞培养板于37℃,5% CO2培养箱中孵育35 h,之后用结晶紫染色。将Transwell上室放至载玻片上,移至显微镜下,随机5个视野观察迁移的细胞数。
7 流式细胞术检测细胞周期 转染完成后48~72 h,使用胰酶收集A549细胞、si-NC细胞以及si-LINC01614细胞,1000rpm离心4 min,PBS洗涤2遍。每个样品加入5 mL冰浴预冷的95%乙醇,混匀后4℃过夜(12~24 h)。1000rpm离心4 min,小心移除上清液。加入5 mL冰浴预冷的PBS,再次离心,为避免吸走细胞,可以残留40 μL左右的PBS。按照每个样品中加入4 μL的RNase A,15 μL碘化丙啶染色液,0.4 mL的染色缓冲液的配比,提前配制好适量染色液,注意配液及染色过程中全程避光。每管样品中加入0.419 mL配好的碘化丙啶混合液,充分重悬细胞,37℃避光水浴30 min。使用Beckman流式细胞仪检测并分析。
8 流式细胞术检测细胞凋亡 转染完成后48~72 h,333 g,4℃离心4 min,收集A549细胞、si-NC细胞以及si-LINC01614细胞。PBS清洗细胞2次,333 g,4℃离心4 min,收集细胞。用100 μL的1×Annexin V Binding Buffer重悬细胞,之后分别加入5 μL的Annexin V-FITC以及PI,混匀。23℃下避光反应15 min。于每个样品中加入400 μL 1×Annexin V Binding Buffer,避光保存,1 h内应进行流式细胞仪检测,上机时应轻弹管底,以保证细胞沉淀充分溶解。
三、统计学分析
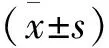
结 果
一、LINC01614的表达与预后以及临床特征相关性分析
1 LINC01614在非小细胞肺癌中的表达 对TCGA数据库中的502例肿瘤样本以及49例正常样本进行分析,结果显示,在正常和肿瘤样本中LINC01614的表达具有统计学意义(P<0.05),与正常样本相比,LINC01614在肿瘤样本中的表达显著增加(见图1);为了探究非小细胞肺癌组织中LINC01614与正常组织间lncRNA的表达差异,LINC01614单基因配对差异分析(癌旁正常组织和癌组织在同一患者中的基因配对表达情况)显示,在癌组织和癌旁组织中LINC01614的表达量具有显著性差异(P<0.001),在癌组织中,LINC01614的表达更为显著(见图2)。
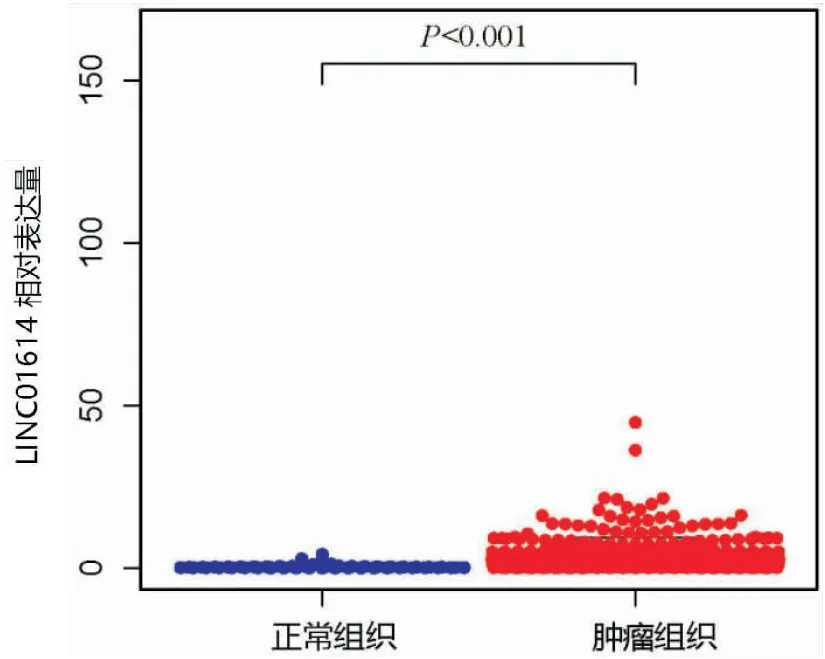
图1 TCGA数据库中LINC01614表达差异

图2 TCGA数据库中LINC01614单基因配对差异分析
2 LINC01614在TCGA数据库中的生存分析 使用TCGA数据库进行LINC01614单基因生存分析,运用R软件中的survminer包和survival包对LINC01614低表达组和高表达组进行生存分析,结果显示,与LINC01614低表达组相比,LINC01614高表达组的生存期未发生明显变化(P=0.050,P≥0.05)(见图3)。
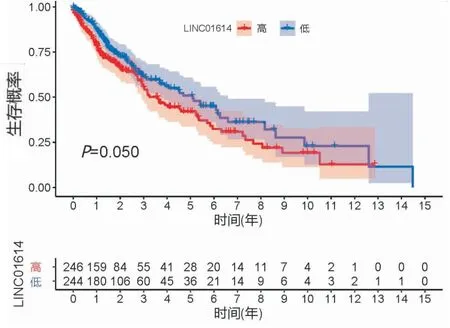
图3 TCGA数据库中LINC01614的生存分析
3 LINC01614的表达与临床特征的相关性分析 将临床病理资料与LINC01614做相关性分析。结果显示,LINC01614的表达与性别、年龄、肿瘤大小(tumor,T)以及淋巴结转移(lymph node,N)均无相关性(P均>0.05),差异无统计学意义;LINC01614的表达与远处转移(metastasis,M)、肿瘤分期(stage)相关(P<0.05);LINC01614的表达在发生远处转移的患者中显著升高;与肿瘤Ⅰ、Ⅱ、Ⅲ期患者相比,LINC01614的表达在Ⅳ期患者中显著上升(见图4)。

图4 LINC01614的表达与性别、年龄、肿瘤大小、淋巴结转移、远处转移以及分期的相关性分析
二、LINC01614在肺癌细胞以及人正常肺上皮细胞的表达
选取非小细胞肺癌A549细胞以及人正常肺上皮细胞BEAS-2B,进行qRT-PCR检测LINC01614的表达。结果显示,在两种细胞间LINC01614的表达有统计学意义(t=7.545,P=0.033),与BEAS-2B细胞相比,LINC01614在A549细胞上的表达显著上调(见图5)。
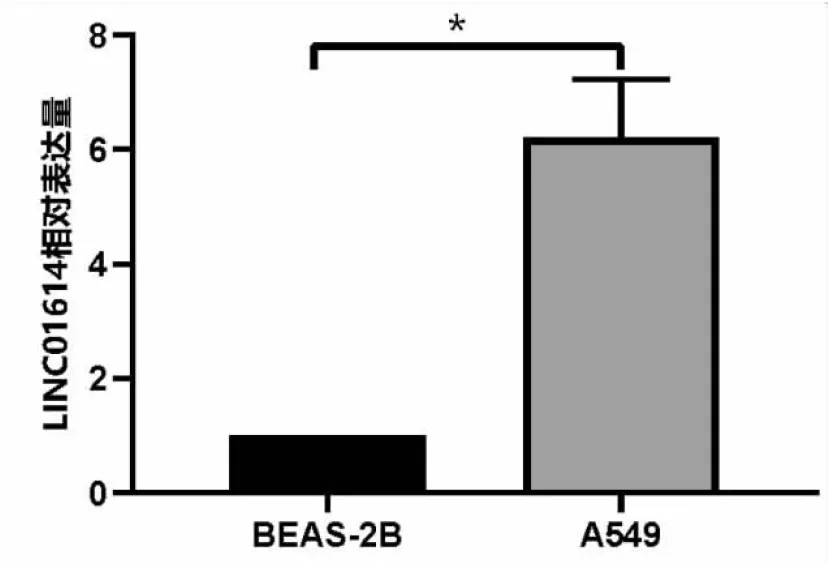
图5 BEAS-2B以及A549细胞中LINC01614的相对表达量,*P<0.05
三、qRT-PCR检测LINC01614 siRNA基因沉默效果
对A549细胞组,si-NC细胞组以及si-LINC01614细胞组进行qRT-PCR检测,结果显示,与A549细胞组以及si-NC细胞组相比,si-LINC01614细胞组中LINC01614的表达具有差异(t=17.759,P<0.001;t=0.436,P=0.020),LINC01614在si-LINC01614细胞组中的表达均显著低于其它两组,表明LINC01614已被成功沉默(见图6)。
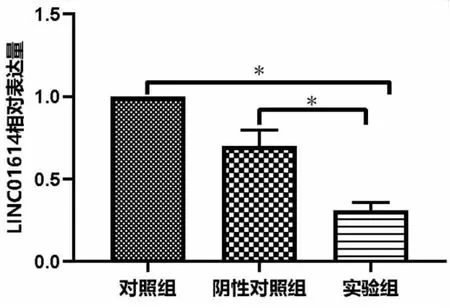
图6 qRT-PCR检测LINC01614的相对表达量,*P<0.05
四、沉默LINC01614对肺癌细胞增殖的影响
A549细胞组、si-NC细胞组以及si-LINC01614细胞组的CCK实验结果显示,与A549细胞对照组以及si-NC细胞组比较,si-LINC01614细胞组的细胞增殖能力被显著抑制(t=4.045,P=0.003;t=6.426,P=0.011);A549细胞组与si-NC细胞组相比,增殖能力无明显差异(t=0.421,P=0.194)(见图7)。

图7 A549细胞的CCK增殖实验,*P<0.05
五、IncuCyte S3对si-LINC01614、si-NC以及A549细胞组的生长监测
三组细胞接种于96孔板后,IncuCyte S3在12 h,24 h,36 h,48 h以及60 h的监测结果显示,si-LINC01614细胞组的细胞密度减小,si-LINC01614细胞组的细胞融合率显著低于A549细胞组以及si-NC细胞组(t=32.473,P<0.001;t=4.947,P<0.001),而si-NC细胞组与A549细胞组的增殖速度无明显差异(t=4.634,P=0.107)(见图8)。实验结果表明,si-RNA所介导的LINC01614基因沉默可抑制A549细胞生长,减弱肿瘤的增殖能力。
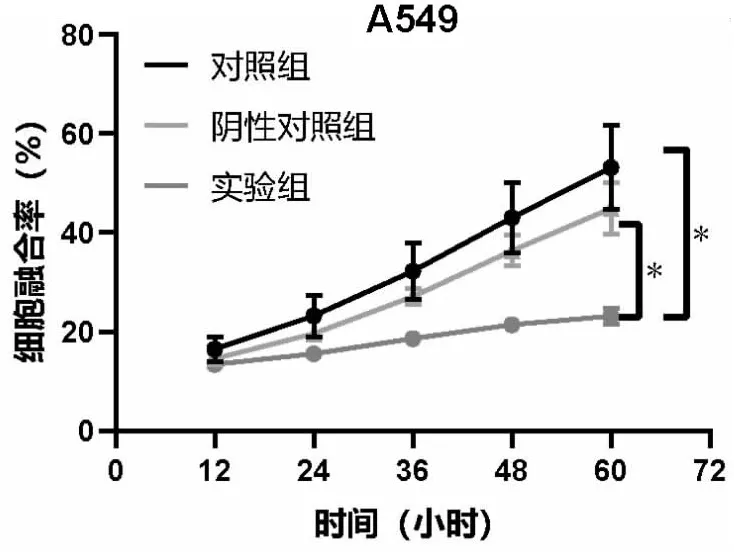
图8 A549细胞在IncuCyte中的增殖曲线,*P<0.05
六、沉默LINC01614对肺癌细胞侵袭能力的影响
分别将A549细胞组、si-NC细胞组以及si-LINC01614细胞组的肺癌细胞接种于Transwell上室中,37 h后计数穿过基质胶紧贴膜的细胞数。A549细胞组、si-NC细胞组以及si-LINC01614细胞组的穿膜细胞数分别为(431±25.23)个/HP、(386±32.69)个/HP、(209±5.37)个/HP;与A549细胞组以及si-NC细胞组相比,si-LINC01614细胞组的A549侵袭细胞数明显减少(t=4.568,P<0.001;t=7.357,P<0.001),A549细胞组与si-NC细胞组相比,侵袭的细胞数无明显差异(t=0.407,P=0.075)(见图9)。以上实验结果表示,沉默LINC01614基因使得肺癌A549细胞的侵袭能力减弱。
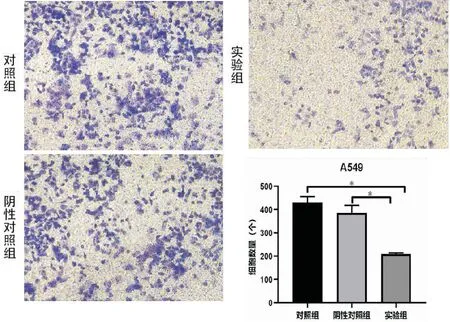
图9 转染si-LINC01614对A549细胞的侵袭能力影响(结晶紫染色,×20),染色细胞数越多表示细胞侵袭力越强,*P<0.05
七、沉默LINC01614对肺癌细胞周期的影响
流式细胞术细胞周期结果检测显示,A549细胞组、si-NC细胞组以及si-LINC01614细胞组的G0/G1期细胞比例分别为(60.79±2.43)%、(62.20±1.46)%、(68.95±5.88)%;三组细胞的S期的细胞比例分别为(17.80±0.97)%、(18.60±0.92)%、(6.76±0.77)%(见表3)。A549细胞组与si-NC细胞组相比,G0/G1期、S期的细胞比例均未发生明显差异(t=1.034,P=0.256;t=0.101,P=0.173);与A549细胞组及si-NC细胞组相比,si-LINC01614细胞组G0/G1期的细胞比例增多(t=2.785,P<0.001;t=0.843,P<0.001);si-LINC01614细胞组S期的细胞比例显著减少(t=1.829,P<0.001;t=1.120,P<0.001)(见图10)。以上实验结果表明,沉默LINC01614使得A549细胞的G0/G1期延长,S期缩短,细胞增殖受到抑制。
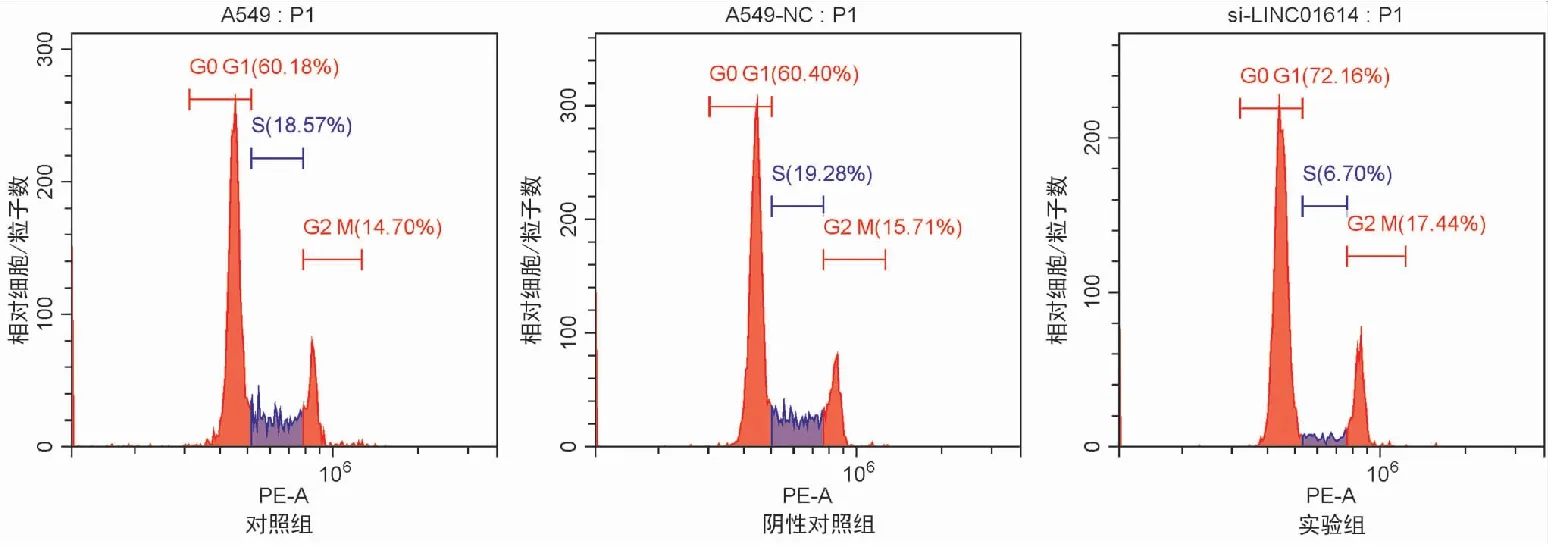
图10 转染si-LINC01614对A549细胞周期的影响
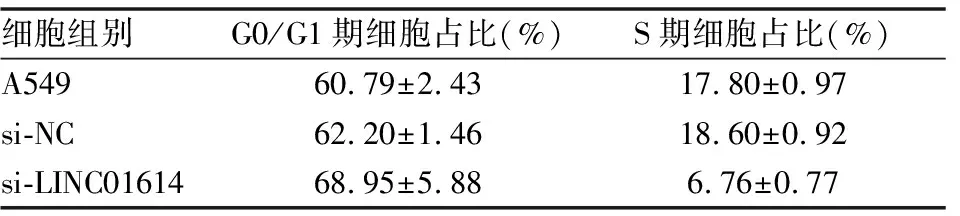
表3 A549、si-NC及si-LINC01614细胞组的G0/G1期、S期细胞占比
八、沉默LINC01614对肺癌细胞凋亡的影响
对si-NC细胞组和si-LINC01614细胞组的流式细胞术凋亡结果显示,si-NC细胞组的凋亡率为(16.08±0.76)%,si-LINC01614细胞组的凋亡率为(11.95±1.33)%,两组的细胞凋亡率有统计学意义(t=1.598,P<0.001),si-NC细胞组的凋亡率明显高于si-LINC01614细胞组(见图11)。实验结果表明,沉默LINC01614可能对A549细胞的凋亡产生抵抗作用。

图11 转染si-LINC01614对A549细胞凋亡的影响
讨 论
肺癌是世界上死亡率最高(21%)的肿瘤[1],但只有30%~40%的患者在肿瘤早期能够被确诊[6]。非小细胞肺癌约占肺癌患者总数的85%,而在大部分的非小细胞肺癌患者中,确诊时疾病已进展至晚期,化疗、靶向治疗以及免疫治疗是其主要治疗手段[7]。近年来免疫抑制剂的出现改变了非小细胞肺癌的治疗模式,通过有效的治疗靶点可增强机体的抗肿瘤活性,从而改善患者预后。
lncRNA是哺乳动物转录组的主要成分,是调控细胞中多种机制的核心分子[8]。到目前为止,大多数lncRNA被发现在调节细胞周期、增殖和凋亡等确保体内平衡的细胞机制中起着至关重要的作用。由于其在基因组中的位置和分布,lncRNA通过转录和转录后加工直接或间接地影响一系列蛋白质的转录,从而以一种“承上启下”的方式打开了“lncRNA-癌症模式”,即促进或抑制肿瘤发展。lncRNA在调节典型癌症特征方面的作用呈多样性,如持续增殖、凋亡抗性、基因组的不稳定性、抗药性、侵袭和转移[9]。近年来,在应用lncRNA作为潜在的治疗靶点方面进行了大量的研究,这为未来的癌症治疗带来了巨大的希望。
LINC01614是一种新发现的lncRNA,其在肿瘤上的研究尚处于起步阶段。研究发现[10],LINC01614通过miR-520a-3p/SNX3轴促进骨肉瘤进展,LINC01614基因的敲除能够显著抑制骨肉瘤细胞的增殖、侵袭和迁移。此外,LINC01614还可促进膀胱癌的发生发展,Wang Z等[11]发现LINC01614可通过miR-217/RUNX2/Wnt/β-Catenin轴促进膀胱癌的增殖、迁移和侵袭。LINC01614还可以作为预测乳腺癌预后的生物标志物[12]。LINC01614在肺癌中的研究也取得了一定进展,LINC01614可以通过抑制miR-217的表达来促进Foxp1的表达,从而促进肺癌的发展,但其对肺癌细胞周期以及侵袭力的影响尚未探究[5]。
为了研究LINC01614对非小细胞肺癌的增殖、侵袭、细胞周期及凋亡的影响,本课题首先通过生物信息学方法分析TCGA库中LINC01614在非小细胞肺癌中的表达,结果显示,非小细胞肺癌中LINC01614的表达量显著高于癌旁正常组织。Sun Y等[13]通过生物信息学手段研究出LINC01614在肺癌中存在差异性表达,与上述研究结果一致。然后采用qRT-PCR方法检测出在细胞水平上LINC01614的差异性表达,LINC01614在非小细胞肺癌A549细胞上的表达量显著高于人正常肺上皮细胞BEAS-2B,与非小细胞肺癌组织上预测的结果相一致,提示LINC01614表达增加可能与NSCLC的发生、发展相关。之后利用si-RNA介导的脂质体转染法去沉默LINC01614在非小细胞肺癌A549细胞上的表达,同时验证了转染效率。随后利用CCK增殖实验,同时辅以IncuCyte S3监测细胞的生长状态及融合情况,结果显示,沉默LINC01614可抑制A549细胞的增殖能力。然后采用Transwell细胞侵袭实验检测细胞的侵袭能力,结果显示,沉默LINC01614基因可以抑制A549细胞的侵袭能力。之后采用流式细胞术PI单染法检测细胞周期,结果显示沉默LINC01614可使A549细胞的G0/G1期延长,S期缩短,上述结果提示LINC01614的高表达与非小细胞肺癌的发生、发展及侵袭转移等恶性生物学行为有显著的相关性。最后利用Annexin V-FITC/PI双染法检测细胞凋亡,结果表示沉默LINC01614后,A549细胞的凋亡率下降,LINC01614可能增强了A549细胞抵抗凋亡的能力。目前研究表明[5],LINC01614对肺腺癌NCI-H1395和NCI1975细胞的凋亡起抑制作用。而本实验研究结果表明,沉默LINC01614后,对肺癌A549细胞的凋亡起抑制作用,究其原因,可能为所选择细胞系不同而造成的差异,也可能为转染效率的差异所导致;此外,在生物学中,增殖和凋亡一般被认为是两种对立的概念,然而随着研究的不断深入,研究者发现了通过Caspase3介导,可使凋亡的细胞刺激现有存活的肿瘤细胞,从而导致肿瘤的再增殖[14]。Yang J等[15]发现,LINC01614的敲除可以抑制H9c2心肌细胞的凋亡,对于LINC01614对非小细胞肺癌凋亡能力的影响,仍需进一步研究,以探求其具体机制。
综上所述,本研究在组织水平利用生物信息学方法研究出LINC01614在NSCLC上高表达,同时在细胞水平进行了验证。LINC01614对A549细胞的增殖、侵袭以及凋亡均起促进作用,沉默LINC01614后,A549细胞的G0/G1期延长,S期缩短,但其在调控非小细胞肺癌上的具体机制仍需进一步研究,LINC01614有望成为NSCLC潜在的诊断标志物和治疗靶点。
