NLRP3、PD-L1、FoxP3和HPV在宫颈病变免疫微环境调节中的表达特征
2023-09-28王丹任伟岑凤
王丹 任伟 岑凤
【摘要】 目的 探讨NLRP3、PD-L1、FoxP3和HPV在宫颈病变免疫微环境调节中的表达特征。方法 选取2019年11月—2021年10月德安县中医院145例患者作为研究对象,分为宫颈癌组76例,CIN(宫颈上皮内瘤变)组39例,子宫肌瘤手术后证实无宫颈病变组30例,分别取3组患者的宫颈癌组织、CIN组织、子宫肌瘤组织进行免疫组织化学检测。结果 NLRP3表达于细胞质中,其表达水平随宫颈病变程度的加重而降低;PD-L1为棕黄色颗粒,表达于宫颈癌细胞和肿瘤浸润淋巴细胞;FoxP3为黑色颗粒,位于细胞核,表达于宫颈癌间质中肿瘤浸润淋巴细胞,宫颈癌细胞无表达;NLRP3、PD-L1FoxP3、HPV在宫颈癌组织中表达与子宫肌瘤组、CIN组有显著差异(P<0.05)。结论 NLRP3、PD-L1、FoxP3、HPV在宫颈病变免疫微环境调节中随病变加重出现高表达,对癌症发生、发展有一定作用,可将其作为治疗靶点。
【關键词】 宫颈病变;免疫微环境调节;NLRP3;PD-L1;FoxP3;HPV
Expression characteristics of NLRP3,PD-L1,Foxp3 and HPV in immune microenvironment regulation of cervical lesions
Wang Dan,Ren Wei,Cen Feng.The Traditional Chinese Medicine Hospital of Dean County,Dean,Jiangxi 330400
【Abstract】 Objective To investigate the expression characteristics of NLRP3,PD-L1,Foxp3 and HPV in the immune microenvironment regulation of cervical lesions.Methods 145 patients in our hospital from November 2019 to October 2021 were selected as the research objects. They were divided into 76 cases of cervical cancer group, 39 cases of CIN (cervical intraepithelial neoplasia) group and 30 cases of no cervical lesions confirmed after hysteromyoma surgery. The cervical cancer tissues, CIN tissues and hysteromyoma tissues of the three groups were detected by immunohistochemistry.Results NLRP3 was expressed in the cytoplasm, and its expression level decreased with the aggravation of cervical lesions; PD-L1 is a brownish yellow granule, which is expressed in cervical cancer cells and tumor infiltrating lymphocytes; Foxp3 is a black granule, located in the nucleus and expressed in tumor infiltrating lymphocytes in the stroma of cervical cancer, but not in cervical cancer cells; The expressions of NLRP3, pd-l1foxp3 and HPV in cervical cancer were significantly different from those in hysteromyoma group and CIN group (P<0.05).Conclusion NLRP3, PD-L1, Foxp3 and HPV are highly expressed in the regulation of immune microenvironment of cervical lesions with the aggravation of lesions, which plays a certain role in the occurrence and development of cancer and can be used as therapeutic targets.
【Key Words】 Cervical lesions;Immune microenvironment;NLRP3;PD-L1;FoxP3;HPV
中图分类号:R711.74 文献标识码:A 文章编号:1672-1721(2023)14-0020-03
DOI:10.19435/j.1672-1721.2023.14.007
宫颈癌是常见的妇科恶性肿瘤疾病,且随着生活水平的提高,其发病越来越年轻化,严重影响患者身心健康及生活质量[1]。人乳头瘤病毒(HPV)持续感染是导致宫颈癌发生、发展的重要因素,其感染多发生在性生活活跃女性,<50岁女性中多有HPV感染史,大多2年内会清除,少部分持续感染,侵犯于未分化宫颈角质形成细胞及分化出逃避免疫应答清除分子[2]。临床上对HPV感染无特效药,多是针对宫颈疾病病变进行治疗。有相关研究指出,宫颈肿瘤的发生、病变及转移与宫颈内的肿瘤细胞微环境因素关系密切[3]。所以,开展对HPV感染的宫颈病变免疫逃逸因子研究,以及早发现宫颈病变,对阻断宫颈癌的发生、发展意义重大。本文通过免疫组织化学检测NLRP3、PD-L1、FoxP3、HPV在宫颈病变免疫微环境调节中的表达特征,旨在分析其与宫颈病变的关系,报道如下。
1 资料与方法
1.1 一般资料 选取德安县中医院2019年11月—2021年10月妇科收治的145例患者为研究对象,其中宫颈癌76例,CIN 39例,子宫肌瘤手术后证实无宫颈病变30例,本研究项目已经该院医学伦理委员会批准。纳入标准:经初诊及手术治疗、宫颈活检病理诊断确诊;无化疗史;临床资料完整;均自愿参加此次研究。排除标准:伴有心肝肾严重疾病者;急性炎症者;自身免疫系统疾病及造血系统疾病者;伴有动脉粥样硬化及其他肿瘤者;精神障碍者。宫颈癌组:年龄31~62岁,平均年龄(47.2±4.8)岁;根据国际妇产科联盟(FIGO)分期:Ⅰ期19例,Ⅱ期21例,Ⅲ期21例,Ⅳ期15例;组织分化程度:低分化26例,中分化31例,高分化19例。CIN组:年龄30~62岁,平均年龄(48.5±4.2)岁;CIN分级:Ⅰ级9例,Ⅱ级15例,Ⅲ15级。子宫肌瘤组:年龄31~63岁,平均年龄(47.8±4.7)岁。3组一般资料无明显差异(P>0.05)。
1.2 方法 取3组患者的组织进行免疫组织化学检测,包括NLRP3、PD-L1、FoxP3、HPV。进行连续切片,厚度为5 μm,脱蜡处理,经微波抗原,进行SP免疫组织化学,操作方法按照试剂的相关说明书进行。抗体于4 ℃冰箱孵育过夜,标记二抗工作液室温孵育30 min,经DAB显色,苏木精复染3~5 min,梯度酒精脱水,荧光倒置显微镜下观察染色结果。染色均设置阳性阴性对照,将已证实的阳性切片作为阳性参照,以PBS代替一抗为阴性对照。
1.3 观察指标 对细胞膜上、细胞质内阳性染色细胞的个数进行阳性判读,检测NLRP3、PD-L1、FoxP3、HPV的表达情况。择取切片细胞数量最多的5个高倍视野,每视野取数细胞100个,由2名经验丰富读片医师进行观察,综合分析染色强度及阳性细胞占比。染色强度标准:没有着色0分,淡黄/淡黑1分,棕黄/棕黑2分,棕褐色/黑色3分;阳性细胞占比标准:0%~24%计0分,25%~49%计1分,50%及以上计2分。阳性判定:染色强度评分×阳性细胞占比评分,0~1分为阴性,阳性为2~6分。
1.4 统计学方法 采用SPSS 24.0统计学软件处理数据,计量资料以x±s表示,行t检验,计数资料以百分比表示,行χ2检验,P<0.05为差异有统计学意义。
2 结果
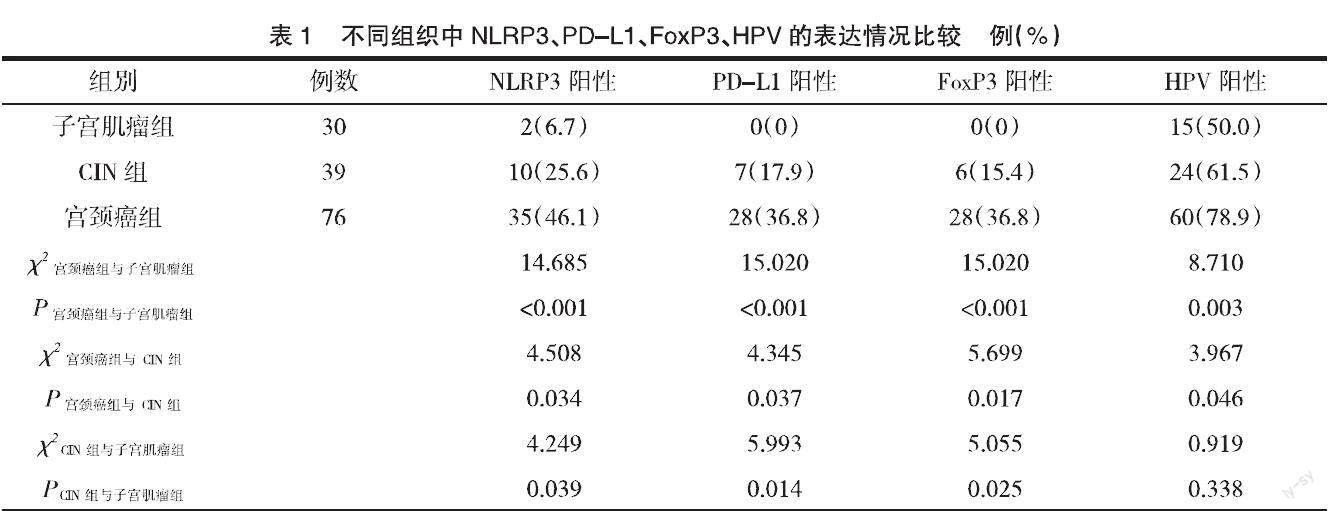
NLRP3表达于细胞质中,其表达水平随宫颈病变程度的加重而降低;PD-L1为棕黄色颗粒,表达于宫颈癌细胞和肿瘤浸润淋巴细胞;FoxP3为黑色颗粒,位于细胞核,表达于宫颈癌间质中肿瘤浸润淋巴细胞,宫颈癌细胞无表达;NLRP3、PD-L1FoxP3、HPV在宫颈癌组织中表达与子宫肌瘤组、CIN组有显著差异(P<0.05),见表1。
3 讨论
宮颈病变是高发女性疾病,其早期临床表现不明显,易被忽视,进展到一定程度后形成癌症,严重影响女性身心健康及生命安全。所以,对宫颈病变的检查防治非常重要。临床相关研究显示,生殖道HPV感染非常普遍,感染率达30%~40%;也有研究显示,宫颈癌患者中约有90%的感染HPV,HPV感染是宫颈癌发生的启动因子,临床普遍认为HPV持续感染和宫颈局部免疫微环境改变的叠加作用促进了宫颈癌的发生[4]。不同类型的HPV感染和宫颈癌病变及病情有较大的关系,有研究指出,高危HPV大多在2年内会被自然清除,少数会进展为宫颈癌,认为HPV持续感染引发宫颈癌与HPV抑制机体免疫应答有关[5]。当细胞因子、促炎因子、免疫细胞形成的肿瘤免疫微环境的免疫抑制作用高于免疫应答时,病毒就会无法清除,进而持续存在而诱发宫颈局部的免疫微环境出现失衡。所以,加强肿瘤微环境对话网络中决定性环节的研究,能为免疫治疗阻断宫颈癌的发生发展提供有效依据。
HPV感染后出现的疾病转归和机体免疫功能有关,尤其是和宫颈局部微环境免疫功能密切相关。免疫抑制细胞构成免疫抑制微环境,经免疫耐受和免疫逃逸机制促进宫颈病变的发展。尽管在宫颈癌阶段肿瘤细胞快速生长,但机体内部仍会产生抗肿瘤免疫反应,因肿瘤免疫抑制微环境控制无法发挥生物效用,所以免疫抑制微环境非常重要。宫颈微环境免疫监视功能及免疫逃逸对宫颈癌的发生、发展起着重要作用。免疫系统中,免疫监视是重要功能,能起到识别和抑制异常细胞的作用,宫颈微环境中的肿瘤抑制性免疫细胞因子能减弱机体免疫功能,降低清除受损DNA、异常细胞能力,使受损DNA持续复制、异常细胞增殖,引起癌症发生及发展[6]。NLRP3是模式识别受体一员,对机体先天免疫应答有重要作用,能识别病原分子模式、危险分子模式,促进产生分泌炎性介质,参与炎症反应应答,NLRP3还能调节caspase-1依赖的细胞凋亡,加重机体炎症反应。有研究显示,妇科疾病、宫内膜癌均与NLRP3均有密切关系[7]。程序性死亡配体-1(PD-L1)又称为B7-H1,是PD-1受体中的一员,属于细胞毒性T淋巴细胞相关蛋白4受体,是免疫反应中的协同分子,起到肿瘤微环境免疫耐受主导性作用;分为膜型和可溶型两种,广泛表达于免疫细胞核非造血细胞及浸润淋巴细胞中,如活化T细胞、活化B细胞、树突状细胞、巨噬细胞及活化的髓系细胞(单核细胞、NK细胞)。有多个临床研究显示,PD-L1在肺癌、食管癌、乳腺癌、卵巢癌、胃癌、胰腺癌中均有组成性表达,是肿瘤组织表达预后不良的因素[8]。在肺癌、食管癌、卵巢癌中表达于肿瘤细胞细胞膜中,在宫颈癌中则表达于细胞胞浆中。吴雪燕等研究显示,宫颈鳞状细胞癌的组织中,PD-L1有升高现象[9]。提示PD-L1在恶性肿瘤中异常高表达,与肿瘤浸润淋巴细胞的PD-1一起抑制周围淋巴细胞的活性,使肿瘤细胞避开了免疫系统监视及攻击。本文研究结果显示,宫颈癌组的PD-L1表达均比子宫肌瘤组和CIN组更高(P<0.05),与吴雪燕研究结果一致。说明异常分化细胞中的PD-L1表达随宫颈细胞的恶性转化进程而增多,其可能参与宫颈细胞的恶性分化。表明异常分化细胞过表达和宫颈病变进程及肿瘤细胞分化的程度有一定关系,推测异常分化宫颈细胞过表达PD-L1会赋予细胞免疫抑制效应,使肿瘤免疫微环境出现免疫抑制强于免疫应答的状态,进而促进宫颈病变进程。
Treg是调节机体免疫体系的细胞,于恶性肿瘤中高表达,对宫颈癌发生、发展作用较大。FoxP3叉头翼状螺旋转录因子是Treg的重要标志,参与Treg细胞的激活功能,是动态平衡调节免疫的因子,有一定的免疫抑制性,和其他细胞接触分泌出抑制性细胞因子,进而抑制免疫细胞活化[10]。FoxP3主要表达于肿瘤浸润淋巴细胞,整体蛋白构成为431个氨基酸,是CD4、CD25、Treg发生功能关键因子,是Treg可靠表面标志物,在肿瘤局部免疫微环境中有重要的作用。有多个临床研究显示,FoxP3在乳腺癌、肝癌、肺癌、结肠癌、膀胱癌、胰腺癌等中均在肿瘤细胞或Treg中表达,是肿瘤预后不良的重要因素。本文研究显示,宫颈癌组的FoxP3表达阳性率均比子宫肌瘤组和CIN组高,CIN组的FoxP3阳性表达率高于子宫肌瘤组(P<0.05)。结果说明,宫颈癌组织中的FoxP3表达出升高趋势。Treg抑制细胞活化,阻滞免疫系统的监视功能,使肿瘤抗原抗体无法发生免疫反应,创造肿瘤细胞免疫逃逸条件,加速肿瘤发展。FoxP3和PD-L1的异常分化细胞在宫颈免疫微环境中具有协同作用,提示存在FoxP3激活PD-L1信号通路,发挥免疫抑制的作用,可为宫颈病变的治疗及宫颈癌的预防提供新思路。
综述所述,NLRP3、PD-L1、FoxP3、HPV在宫颈病变免疫微环境调节中,随病变加重出现高表达,对癌症发生、发展有一定作用,可将其作为治疗靶点。
参考文献
[1] BRAY FREDDIE,FERLAY JACQUES,SOERJOMATARAM ISABELLE,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68:394-424.
[2] 苏雅婷,牛雯娟,段文杰,等.阴道微生物在宫颈癌中作用机制的研究进展[J].国际妇产科学杂志,2021,48(2):126-130.
[3] 舒俊俊,龚丹,杨云华.南昌地区女性阴道微生态环境及HPV阳性与宫颈病变的相关性研究[J].現代医院,2019,19(8):1188-1190.
[4] 王婷婷,冯晓娜,李娜.育龄女性生殖道感染对宫颈癌及宫颈上皮内瘤变的影响[J].黑龙江医药科学,2017,40(6):43-44.
[5] KATRIN CHRISTINE.Vaginal and Urine Self-sampling Compared to Cervical SamplingforHPV-testing with the Cobas 4800 HPV Test[J].Anticancer research,2017,37(8):4183-4187.
[6] 马茜,赵敏伊,魏星,等.免疫调节细胞FoxP3+Treg及免疫蛋白PD-L1在宫颈病变微环境中的表达[J].中国医学科学院学报,2017,39(1):128-132.
[7] 余杨,付艳丽,孙翔.不同宫颈病变高危型人乳头状瘤病毒载量对局部调节性T细胞表达的影响[J].实用医学杂志,2018,34(4):583-587.
[8] 刘畅,李坤,舒丽莎,等.B7-H4和Foxp3+Treg在宫颈病变组织中的表达及临床意义[J].重庆医学,2019,48(17):2960-2963.
[9] 吴雪燕,周遵伦,张梅.阴道微环境与人乳头瘤病毒感染及宫颈上皮内瘤变相关性的研究进展[J].贵州医药,2021,45(2):191-193.
[10] 徐晓琳,田春艳,耿云峰,等.核因子κB信号通路在宫颈癌、乳腺癌发生发展及治疗中作用的机制研究进展[J].山东医药,2019,59(18):99-103.
(收稿日期:2023-02-10)
