机械加载上调Piezo1 促进废用性骨质疏松小鼠的血管生成
2023-09-28孟尧王雪彤李心乐张平
孟尧,王雪彤,李心乐,张平,3,4
(1.天津医科大学基础医学院人体解剖与组织胚胎学系,天津 300070;2.天津医科大学基础医学研究中心,天津 300070;3.卫生部激素与发育重点实验室,天津市代谢性疾病重点实验室,天津 300134;4.天津市脊柱脊髓重点实验室,天津 300052)
废用性骨质疏松(DOP)多发生于长期卧床或失重状态下(如宇航员),造成严重的骨量丢失,骨代谢失衡,使骨脆性增加,现已成为一个重要的健康问题[1]。研究表明,骨组织中有一种特殊的高表达CD31 和内皮黏蛋白Emcn 的毛细血管(H 血管),它是骨重建与血管生成耦联的重要载体,而DOP 小鼠模型会导致H 血管数量减少[2]。因此,促进H 血管形成可能成为治疗废用性骨质疏松的关键因素。
机械加载是一种加载频率低、加载强度小、作用于膝关节等滑膜关节的温和机械刺激,能模拟人体主动运动的物理治疗手段[3]。前期研究发现机械加载可以促进血管形成、骨形成,用于骨质疏松[4-5]、骨关节炎[6]、股骨头坏死[7]、乳腺癌骨转移[8]的治疗。Piezo1 是一种在生物体内广泛分布的机械敏感离子通道蛋白[9],可以将细胞膜上感受到的机械信号转化为电化学信号[10]。研究表明Piezo1 在血管系统中发挥着不可或缺的作用,对促进血管重塑有重要意义[11]。前期工作发现机械加载可以通过促进成骨和成血管形成来治疗绝经后骨质疏松[4-5],但机械加载对废用性骨质疏松血管生成的调控作用与其作用媒介尚不清楚。本实验采用鼠尾悬吊方式建立废用性骨质疏松小鼠模型,探究Piezo1 是否可能作为机械加载调控靶点来改善骨微环境中的血管形成,为物理治疗废用性骨质疏松提供新的见解。
1 材料与方法
1.1 材料
1.1.1 实验动物 使用63 只SPF 级雌性C57BL/6小鼠(16 周龄,体重18~20 g,中国军事医学科学院动物中心)。实验小鼠根据随机数字表法分为3 组:假手术组(Sham 组,n=21)、废用性骨质疏松组(DOP组,n=21)和废用性骨质疏松机械加载组(DOPL 组,n=21)。在25°C 的室温且无病原体条件下,将小鼠置于12 h 的明暗循环中,自由摄取饲料和水。所有实验根据天津医科大学实验动物管理规定进行,并经天津医科大学伦理委员会批准。
1.1.2 主要仪器和试剂 ST2 细胞系购买自美国Lonza 公司。石蜡切片机(RM255)购买自德国Leica公司。光学显微镜BX53 购买自日本Olympus 公司。DMEM 培养基购自美国Gibco 公司。EGM-2 培养基购自美国Lonza 公司。抗体Piezo1 购自美国Cell Signaling Technology 公司。CD31 一抗购自中国proteintech 公司。Emcn、β-actin 一抗购自美国Sigma 公司。墨汁购自中国北京索莱宝公司。胎牛血清、青霉素、链霉素和胰蛋白酶购自美国Invitrogen公司。Piezo1 siRNA 基因干扰载体的构建和筛选自上海吉玛公司。
1.2 方法
1.2.1 鼠尾悬吊小鼠模型 如前所述进行尾部悬吊[12]。实验小鼠配备了定制的绑带,并悬挂在定制笼子中的高架滑轮系统中。调整小鼠的位置,保证头低位30°尾悬吊,后肢不接触地面,前肢与笼子的地板接触并保持可以用前肢在笼子里行走(图1A)。

图1 鼠尾悬吊和机械加载示意图Fig 1 Mice tail suspension and mechanical loading diagram
1.2.2 机械加载 在机械加载治疗过程中,用1.5%异氟烷对小鼠进行吸入式麻醉。小鼠侧卧于加载台上,使用自主研发的机械加载装置(内源性干细胞治疗仪,专利号:ZL201621010131.9)实施治疗[13]。每天对双侧膝关节分别进行侧向加载(图1B),加载力为1 N,加载频率为5 Hz,小鼠每侧膝关节加载时长为3 min,共6 min,持续治疗2 周。加载时,加载面与膝关节内外侧面相接触,调节合适的松紧度保证治疗效果并确保膝关节血运通畅,合格标准为在踝关节动脉可感受到节律性跳动。同时假手术组和废用性骨质疏松造模组小鼠被麻醉并定位在加载台上,而不接受机械加载治疗,实验结束后全部小鼠处死并取材。
1.3 组织学分析
1.3.1 组织处理 小鼠在造模2 周后进行人道主义处死。剥离小鼠后腿,剔除皮肤、软组织及韧带,分离股骨、胫骨组织。将骨组织标本浸没于10%中性福尔马林中固定2 d 后,在14%的EDTA 中脱钙2 周。将骨组织标本用石蜡包埋,进行冠状位切片,厚度为5 μm。
1.3.2 免疫组织化学染色 使用石蜡包埋的小鼠股骨标本(每组n=6),石蜡切片经过脱蜡和水化后加入适量内源性过氧化物酶阻断剂,室温孵育10 min。然后将切片与抗Piezo1 的一级抗体在4℃下孵育过夜,滴加适量反应增强液,室温孵育20 min后滴加适量强酶标山羊抗兔IgG 聚合物,室温孵育20 min。最后滴加适量的配置新鲜DAB 液(浓缩DAB液50 μL+DAB 底物液1 mL),室温孵育2~10 min,出现明显棕色即可。在正置显微镜下观察、拍照并测量,选取股骨远端生长板近端(距生长板近端约0.8 mm)1.6 mm2的长方形区域为目标区域,拍照定量分析Piezo1 的水平。
1.3.3 墨汁灌注 首先麻醉动物,将治疗2 周的动物(每组n=6)腹腔注射10%水合氯醛(每只小鼠3 mL/kg 的剂量注射)进行麻醉。然后将小鼠四肢固定用肝素生理盐水灌注心脏(每只小鼠生理盐水用量约为30 mL)。抽取墨汁灌注液并进行左心室灌注至动物皮肤黏膜全部变黑为止(每只小鼠灌注液用量约为50 mL)。灌注成功后,处死动物,将动物静置于4℃,24 h。进行石蜡切片处理,切片厚度为15 μm。使用中性树胶封片并在正置显微镜下进行观察、拍照,然后进行统计学分析。
1.4 细胞学实验
1.4.1 细胞分离培养 人道主义处死动物,分离小鼠(每组n=3)双侧髂骨、股骨、胫骨,剥离皮肤、肌肉及周围韧带,保留完整髂骨、股骨和胫骨,将其用灭菌1×PBS 溶液清洗后浸于含有2%胎牛血清的MEM-α溶液中。使用灭菌的剪刀剪开髂骨、股骨、胫骨的两端。暴露骨髓腔,采用5 mL 含有2%胎牛血清的MEM-α 溶液的注射器冲取骨髓,使用含有2 mL Ficoll 无菌离心管过筛细胞,室温下离心。离心后,弃上清液,进行细胞计数,再次离心,获得骨髓来源细胞。
1.4.2 内皮祖细胞的诱导实验 将得到的骨髓单个核细胞使用含有20%胎牛血清的EGM-2 培养基,重悬并种于6 孔板中,恒温培养箱孵育48 h 后换液,更换新的EGM-2 培养基。诱导时长大约10 d,在倒置显微镜下动态观察直至细胞形成典型的铺路石样形态。
1.4.3 细胞转染 Piezo1siRNA 基因干扰载体(正义链:5′-GUCUACAAGAACUUCGAGATT-3′,反义链:5′-UCUCGAAGUUCUUGAGACTT-3′)。NC 组为si RNANC 基因干扰载体(正义链:5′-UUCUCCGAACG UGUCACGUTT-3′,反义链:5′-ACGUGACACGUUCG GAGAATT-3′)。将处于对数生长期的内皮祖细胞和ST2 细胞接种在无菌6 孔板中,密度调整为1×105个/cm2。约24~36 h 后,当细胞密度达到60%~80%时,加入转染试剂和无双抗体培养基。4 h 后,更换完整的培养基进行下一步实验。为了验证Piezo1 的沉默效率,使用构建的Piezo1 siRNA 转染ST2 细胞,通过细胞免疫荧光和Western 印迹检测Piezo1 siRNA 的沉默效率。
1.4.4 细胞免疫荧光 首先使用预冷的80%乙醇溶液固定细胞浸泡30 min,再更换遇冷的无水乙醇浸泡30 min,1 mL/孔,然后用0.5% Triton X-100室温浸泡10 min 进行细胞穿透,PBS 清洗后,加入10%胎牛血清进行封闭,室温孵育1 h,PBS 清洗后将细胞置于Piezo1 一抗(1∶500)中孵育过夜(4℃),再使用荧光二抗(1∶500)室温孵育1 h,最后用DAPI 染色液染核后,在载玻片上滴加适量抗荧光淬灭剂进行封片,并在荧光显微镜下观察细胞。分别使用不同通道拍摄并Merge 图像。
1.5 Western 印迹分析 在RIPA 裂解缓冲液中提取股骨蛋白,采用一抗Piezo1(1∶1 000)和β-actin(1∶10 000)在4°C 过夜孵育。二抗室温(1∶10 000)孵育90 min 后,将增强型化学发光试剂盒中显影液和定影液1∶1 混合后反复冲洗目的条带,使用化学发光成像系统曝光并通过Image J 软件分析各组蛋白条带的灰度值。
1.6 统计学处理 使用IBM SPSS Statistics 25 统计软件进行数据分析,并采用Graphpad Prism7 软件进行统计图制作。符合正态分布的计量数据采用±s 表示。单因素方差分析(ANOVA)用于多组间的比较,最小显著差法(LSD-t 检验)用于两组比较。P<0.05 为差异有统计学意义。
2 结果
2.1 机械加载改善DOP 小鼠的骨量的检测 HE染色显示(图2),与Sham 组相比,DOP 组骨小梁的面积和总面积的比值显著降低(t=9.553,P<0.001)。而DOPL 组结果显示,与DOP 组相比,骨小梁的面积和总面积的比值增加(t=-9.365,P<0.001)。

图2 股骨远端的HE 染色形态学检查( 100×,Bar=200 μm)Fig 2 Morphological examination of distal femur by HE staining( 100×,Bar=200 μm)
2.2 机械加载对DOP 小鼠血管生成的影响 墨汁灌注实验结果显示(图3),与Sham 组相比,DOP 组骨组织血管面积显著下降(t=9.764,P<0.001);而与DOP 组相比,DOPL 组骨组织血管面积显著增加(t=10.001,P<0.001)。荧光双染实验结果显示(图4),与Sham 组相比,DOP 组CD31(t=6.377,P<0.001)与Emcn(t=6.258,P<0.001)的表达水平降低,同时,其共表达水平也降低(t=9.223,P<0.001);而与DOP 组相比,DOPL 组中CD31(t=6.619,P<0.001)和Emcn(t=4.624,P<0.01)的表达水平升高,并且其共表达水平也相应升高(t=4.453,P<0.01)。

图3 墨汁灌注实验检测机械加载对小鼠血管生成的影响( 200×,Bar=100 μm)Fig 3 The effect of mechanical loading on angiogenesis was detected by ink perfusion experiment in mice( 200×,Bar=100 μm)

图4 荧光双染实验检测机械加载对小鼠H 血管生成的影响( 100×,Bar=200 μm)Fig 4 The effect of mechanical loading on H vessels was detected by fluorescence double staining experiment in mice( 100×,Bar=200 μm)
2.3 机械加载对DOP 小鼠Piezo1 信号表达的促进作用 与Sham 组相比,DOP 组股骨远端Piezo1的表达水平下降(t=7.604,P<0.01);与DOP 组相比,DOPL 组Piezo1 的表达显著升高(t=6.557,P<0.01),如图5 所示。Western 印迹结果显示,与Sham 组相比,DOP 组Piezo1 蛋白表达水平降低(t=15.977,P<0.001);与DOP 组相比,DOPL 组Piezo1 蛋白的表达水平升高(t=4.803,P<0.01),如图6 所示。
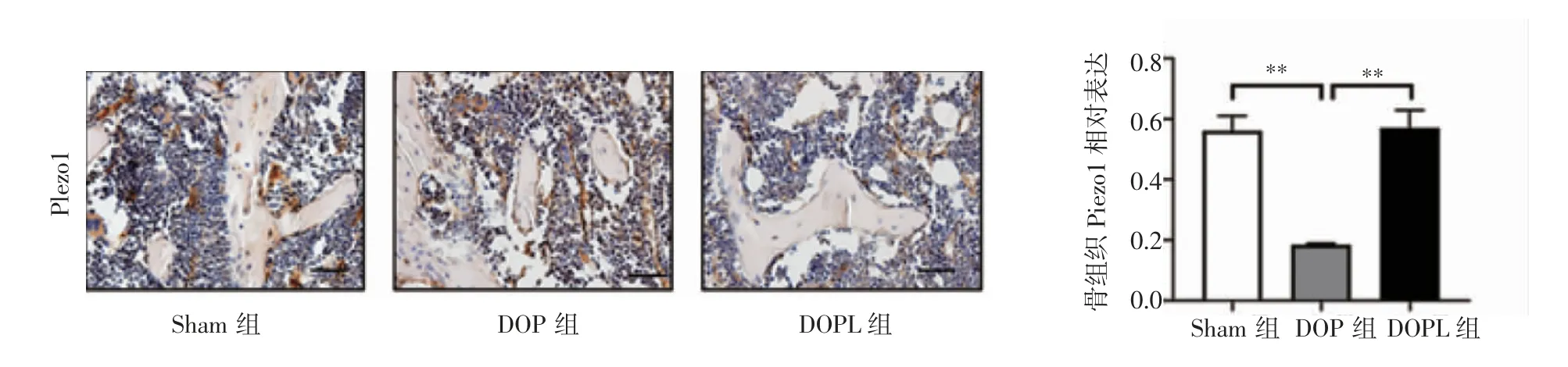
图5 免疫组织化学检测各组Piezo1 的表达( 400×,Bar=50 μm)Fig 5 The expression of Piezo1 in each group was detected by immunohistochemistry( 400×,Bar=50 μm)

图6 Western 印迹检测各组Piezo1 表达水平Fig 6 Western blotting was used to detect the expression of Piezo1 in each group
2.4 机械加载通过调控 Piezo1 影响H 血管的生成 免疫荧光结果表明,与未转染Piezo1 siRNA 组相比,Piezo1 siRNA 转染后可以显著降低细胞中Piezo1 表达(t=16.203,P<0.001,图7)。Western 印迹进一步验证了这一实验结果(t=14.617,P<0.001,图8)。免疫荧光染色检测CD31 和Emcn 的表达,结果显示,与未转染Piezo1 siRNA 组相比,Piezo1 siRNA转染后小鼠内皮祖细胞中CD31(t=-7.508、-4.809、-13.538,均P<0.01)和Emcn(t=4.999、11.319、9.421,均P<0.01)表达显著减少,并且CD31 和Emcn 的共表达降低(t=12.949、2.580、7.727,均P<0.05);而在转染Piezo1 siRNA 后,DOP 组与DOPL 组在CD31和Emcn 的表达及共表达方面无统计学差异,如图9 所示。

图7 免疫荧光检测各组Piezo1 沉默效率( 200×,Bar=100 μm)Fig 7 The silencing efficiency of Piezo1 in each group was measured by immunofluorescence( 200×,Bar=100 μm)

图8 Western 印迹检测Piezo1 沉默效率Fig 8 Westernblotting was used to detect the silencing efficiency of Piezo1

图9 荧光双染检测Piezo1 siRNA 对H 血管生成的影响( 100×,Bar=200 μm)Fig 9 The effect of Piezo1 siRNA on H vessels was detected by fluorescence double staining( 100×,Bar=200 μm)
3 讨论
DOP 是由于运动能力受限或功能障碍而引起骨量减少,骨破坏与骨形成失衡的一种继发性骨质疏松[14]。主要表现为骨痛、骨脆性增加、骨折风险提高,给患者、家庭以及社会造成巨大负担[15]。总之,骨质疏松迫切需要一种无创温和的治疗手段来预防和治疗该疾病的发生、发展。
研究表明,骨质疏松的治疗是一个综合康复的过程,全身振动的运动训练方式是一种非药物性抗骨质疏松有效的方法[16]。这种运动训练可以减少长时间卧床导致的骨丢失,达到增加骨密度的目的[17]。机械加载作为一种可模拟主动运动的被动物理康复治疗方式,能够促进成骨抑制破骨并减缓骨质疏松的骨质流失,影响骨髓间充质干细胞分化,调节血管生成,达到治疗绝经后骨质疏松的目的[4-5]。本实验聚焦于DOP 鼠尾悬吊小鼠模型,模拟空间微重力环境,探究机械加载对废用性骨质疏松小鼠血管形成的影响。笔者认为机械加载可能是通过周期循环的力学刺激和骨应力变化,引起骨髓腔内压改变、骨质内液体流动与分子转运,从而改善DOP 小鼠由于失重导致的骨质流失和血管减少。该实验证明了膝关节机械加载可能作为一种有效的物理康复治疗方式来缓解废用性骨质疏松。
Piezo1 作为一种机械敏感离子通道蛋白,能够感受相应力学信号,在骨疾病治疗中具有重要作用[18]。有研究表明在生物力学环境中,Piezo1 可以促进骨组织血管生成,达到促进骨折愈合的目的[19]。在此基础上,本实验探究机械加载刺激下Piezo1 蛋白的表达情况,通过免疫组织化学染色与Western 印迹实验证明了机械加载可以促进DOP 小鼠中Piezo1 表达。研究发现H 血管作为骨髓中一类特殊的血管,耦联了血管生成和骨形成,可能是治疗骨质疏松的重要靶点[20]。并且,笔者之前的研究发现机械加载可以促进绝经后骨质疏松小鼠中H 血管的表达,达到治疗骨质疏松的目的[4-5]。本研究机械加载可以促进DOP 小鼠骨量增加和血管生成,并通过内皮祖细胞免疫荧光实验发现机械刺激改善了DOP 小鼠中H 血管相关因子CD31 和Emcn 的表达,同时,促进DOP 小鼠中CD31 和Emcn 的共表达。为了验证Piezo1 对CD31 和Emcn 的影响,笔者沉默了内皮祖细胞中的Piezo1,通过免疫荧光实验观察到,沉默Piezo1 抑制了CD31 和Emcn 的表达和共表达,证明Piezo1 对H 血管的形成具有调控作用。并且,笔者发现沉默Piezo1 后,DOP 组与DOPL 组在CD31 和Emcn 的表达及共表达方面无统计学差异,该结果表明机械加载是通过Piezo1 为媒介来调控H 血管相关因子CD31 和Emcn 的表达。以上结果表明,机械加载可能通过促进骨组织中Piezo1 的表达,促进H 血管相关因子CD31 和Emcn 的表达以及血管形成,达到治疗DOP 的目的。
综上所述,本研究表明机械加载通过促进Piezo1 的表达,调控骨血管生成。但机械加载对骨血管微环境的调控机制尚不明确,还需进一步探究。本研究提示机械加载可以作为DOP 的一种新的治疗方法,为临床治疗DOP 提供理论依据。
