左西孟旦对脓毒症心肌损伤小鼠的保护作用及机制研究
2023-09-28柴鹏程韩海波胡振杰陈玉红
柴鹏程,韩海波,胡振杰,陈玉红
(1.河北医科大学临床学院,石家庄 050020;2.河北医科大学第四医院重症医学科,石家庄 050011)
脓毒症是指机体对感染反应失调引起的器官功能障碍的一种疾病,常可危及生命,是重症医学常见的急危重症,病死率高达30%[1]。脓毒症心肌损伤(septic myocardial injury,SMI)是导致脓毒症患者死亡的主要原因之一。根据研究调查结果显示,脓毒症患者会出现不同程度的心肌损伤,其中40%~50%的患者出现心肌抑制,7%左右的患者出现心力衰竭,未合并心脏损伤患者病死率约为20%,合并心脏损伤患者死亡率大于70%[2]。
SMI 的发病机制目前并未完全阐明,大量动物实验研究证实,炎症、氧化应激以及心肌细胞线粒体能量代谢障碍是SMI 进而影响心肌功能的主要原因[3]。左西孟旦(levosimendan,Levo)是一种钙离子增敏剂,具有良好的正性肌力和扩血管功能。此外,Levo 还显示出其他重要的非正性肌力作用,包括抗氧化、抗炎和抗凋亡作用。临床研究证实,Levo 可通过改善心力衰竭患者线粒体氧化平衡,达到心脏保护作用[4]。由此笔者提出假设,Levo 可能会通过影响SMI 小鼠的心肌细胞线粒体功能进而发挥心脏保护作用,本实验进一步研究Levo 对SMI 的作用机制,以期对其临床应用提供一定的理论依据。
1 材料与方法
1.1 动物分组及给药 清洁级雄性C57 小鼠,体重25~30 g,由北京维通利华公司提供。适应性饲养1 周,随机分为Control 组、SMI 组、SMI+Levo 组,每组6 只。自由进食和饮水1 周。SMI 组腹腔注射脂多糖(LPS)(10 mg/kg),SMI+Levo 组在给予LPS 后3 h 腹腔注射Levo(24 μg/kg),SMI 组在给予LPS 后3 h 腹腔注射同等剂量生理盐水,Control 组在0、3 h 腹腔注射同等剂量生理盐水。腹腔注射LPS 后,SMI 组与SMI+Levo 组小鼠均出现毛发竖立、精神萎靡等脓毒症表现,而Control 组无上述表现。所有实验均在河北医科大学第四医院动物实验中心完成,经过河北医科大学第四医院实验动物伦理委员会授予的项目许可(2020002)。
1.2 心脏超声测定 6 h 测定小鼠心脏功能,腹腔注射10%水合氯醛(350 mg/kg)麻醉,胸前区脱毛,使用VEVO2100 超声设备(VisualSonics 公司)获取经胸二维M 型超声心动图,反复测量3 次,选取3个连续心动周期,测量计算得出左室射血分数(left ventricular ejection fractions,LVEF)、缩短分数(left ventricular fractional shortening,LVFS)及心输出量(cardiac output,CO)。
1.3 血及组织标本的采集与处理 超声测量完毕后摘眼球取血处死小鼠,留取的血标本中加入抑肽酶20 μL、10%EDTA-Na 15 μL,4℃3 000 r/min,离心15 min,取上清液-80℃保存;快速留取小鼠心脏,生理盐水冲洗干净后放入4%甲醛固定液中保存,待HE 染色后于光镜下观察心肌组织形态学改变。留取部分左心室放入4%戊二醛固定,待电镜观察。
1.4 检查指标及方法
1.4.1 血浆肌钙蛋白Ⅰ(cTnI)、肌酸激酶(creatine kinase,CK)、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)水平测定 酶联免疫吸附法(enzyme linked immune sorbent assay,ELISA)测定血浆中cTnⅠ、CK、TNF-α、IL-1β 水平,药盒购自北京欣博盛生物科技有限公司,具体操作步骤按照说明书进行。
1.4.2 苏木精-伊红染色(hematoxylin-eosin staining,HE)观察心脏组织形态学改变 心肌组织在4%多聚甲醛中室温固定48 h,石蜡包埋,切片,HE 染色,在光学显微镜下观察(DM3000 LED,Wetzlar,德国)。根据Kishimoto 方法[5]对每组小鼠心肌病理变化进行评分,即每张切片选取5 个高倍视野,从炎性细胞浸润和心肌变性坏死两方面观察病变情况,计算每个视野中炎性浸润和坏死区域面积与整个视野的面积之比,无病变计0 分,<25%计1 分,25%~50%计2 分,50%~75%计3 分,>75%计4 分。
1.4.3 透射电子显微镜观察心脏组织线粒体改变 取出经4%戊二醛固定的心脏组织,经脱水、包埋、切片及染色后,在电镜下(HT7800/HT7700,东京,日本)观察,采集不同倍数下心肌组织中线粒体形态及自噬小体图像并留存。
1.5 统计学处理 采用SPSS21.0 统计软件包,数据均以±s 表示,多个样本均数间比较采用单因素方差(ANOVA)分析,P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠心脏功能指标变化 与Control 组相比,SMI 组小鼠心脏功能指标LVEF、LVFS 及CO 均明显降低(分别为65.96±8.16 vs.35.78±4.87,35.87±6.05 vs.16.80±2.58,18.19±2.84 vs.9.34±1.23,均P<0.05);与SMI 组相比,SMI+Levo 组LVEF、LVFS 及CO 差异有统计学意义,三者均明显升高(分别为35.78±4.87 vs.45.88±2.63,16.80±2.58 vs.24.01±3.4,9.34± 1.23 vs.14.80±3.41,均P<0.05),见图1。

图1 入组后6 h 各组小鼠LVEF、LVFS、CO 水平变化Fig 1 Changes in LVEF,LVFS,and CO levels of mice in each group 6 hours after grouping
2.2 小鼠心肌损伤指标变化 与Control 组相比,SMI 组小鼠心肌损伤指标cTnI、CK 均明显升高(1.25±0.36 vs.6.99±0.39,866.93±378.51 vs.5 427.22±875.23,均P<0.05);与SMI 组相比,SMI+Levo 组小鼠cTnI、CK 均明显降低(分别为6.99±0.39 vs.6.24±0.46,5 427.22±875.23 vs.3 587.67±460.90,均P<0.05),见图2。

图2 入组后6 h 各组小鼠血浆cTnI、CK 水平变化Fig 2 Changes in plasma cTnI and CK levels of mice in each group 6 hours after grouping
2.3 小鼠血浆炎症因子水平变化 与Control 组相比,SMI 组小鼠的血浆TNF-α(μg/L)、IL-1β(μg/L)水平均显著升高(58.33±10.98 vs.658.50±91.87,32.83±3.43 vs.114.83±5.98,均P<0.01);与SMI 组比较,SMI+Levo 组小鼠TNF-α、IL-1β 水平均明显降低(658.50±91.87 vs.431.00±18.17,114.83±5.98 vs.74.70±26.13,均P<0.01),见图3。
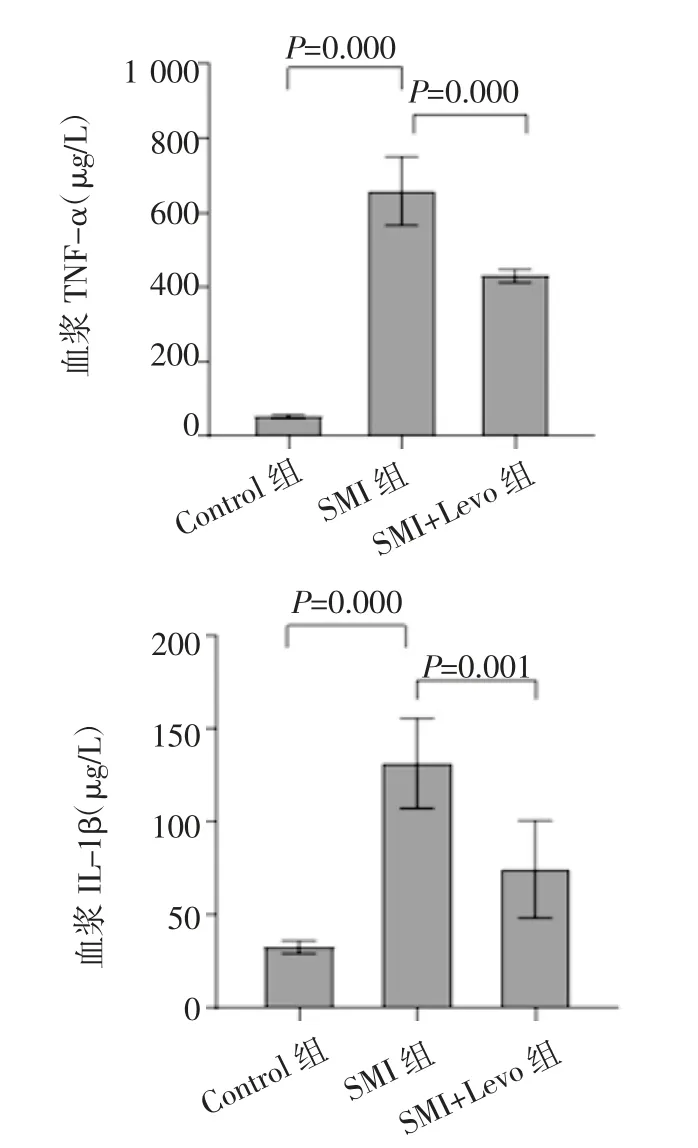
图3 入组后6 h 各组小鼠血浆TNF-α、IL-1β 水平Fig 3 Plasma TNF-α and IL-1β levels of mice in each group 6 hours after grouping
2.4 小鼠心肌组织形态学变化 Control 组小鼠心肌组织形态结构正常;SMI 组小鼠出现心肌纤维排列不规整,部分心肌纤维断裂,横纹模糊甚至消失,间质出血水肿,炎性细胞浸润等改变;与SMI 组相比,SMI+Levo 组小鼠心肌损伤有所好转,见图4。与Control 组相比,SMI 组小鼠心肌组织病理评分明显升高(P<0.05);SMI +Levo 组与SMI 组相比,病理学评分虽无统计学差异,但有下降趋势,见图5。

图5 入组后6 h 各组小鼠心肌病理变化评分Fig 5 Score of myocardial pathological changes of mice in each group 6 hours after grouping
2.5 小鼠心肌组织线粒体形态改变 Control 组小鼠心肌细胞线粒体形态规整;SMI 组小鼠心肌细胞线粒体排列紊乱、水肿、线粒体嵴减少,偶见空泡变性,排列不整齐,肌丝束分离,Z 线扭曲,间距缩短,自噬小体增多;SMI+Levo 组与SMI 组相比,心肌组织线粒体损伤有所好转,见图6。

图6 入组后6 h 各组小鼠心肌组织线粒体形态改变Fig 6 Morphological changes of mitochondria in myocardial tissue of mice in each group 6 hours after grouping
3 讨论
脓毒症是临床上最为常见的急危重症,近年来其发病率逐年升高,已成为重症患者死亡的主要原因。据研究调查显示,每年约有脓毒症患者3 000 万例,死亡人数高达600 多万[6]。SMI 是脓毒症最严重和致命的并发症之一。
SMI 的作用机制目前尚在研究当中,据已有的研究证实,SMI 的作用机制包括:(1)促炎/抗炎反应失调[7]。(2)细胞凋亡[8]。(3)氧化应激[9]。(4)线粒体功能障碍[10]等。但确切机制尚未完全阐明。
研究表明,脓毒症或脓毒症休克患者可以发生左心室收缩功能障碍[11]。LVEF、LVFS 及CO 是反映心脏收缩功能较好的指标。在脓毒症发展过程中,多种原因会导致微循环毛细血管通透性改变,使血管容量减少[12]。SMI 时,心脏超声显示LVEF、LVFS及CO 显著下降。本实验研究结果也证明,SMI 组LVEF、LVFS 及CO 明显低于Control 组,提示腹腔注射LPS后,脓毒症小鼠存在左室收缩功能障碍。SMI+Levo 组与LPS 组相比,LVEF、LVFS 及CO 的升高具有统计学意义,提示Levo 可显著改善小鼠左室收缩功能。
cTnI、CK 是观察心肌损伤的重要生物标志物。cTnI 大部分以结合蛋白的形式固定在肌原纤维上,当心肌细胞受到损害时,游离状态的cTnI 会首先进入到细胞外液的血液循环中,浓度越高,反映心肌损伤越严重[13]。CK 主要存在于心肌细胞线粒体和胞质中,参与细胞能量转运、肌肉收缩及ATP 的再生[14]。近年来认为心肌线粒体膜肿胀、通透性增加、线粒体释放相关凋亡蛋白等是导致脓毒症心力衰竭的主要机制[15],因此在SMI 小鼠中cTnI、CK 的水平明显升高。本实验结果进一步证实,在腹腔注射LPS 6 h 后,SMI 组小鼠cTnI、CK 水平明显升高,SMI+Levo 组相较于SMI 组,cTnI 与CK 水平明显下降。由此可见,Levo 可减轻SMI 小鼠的心肌损伤,机制可能为Levo 直接与cTnI 的氨基末端结合,增强cTnI 与钙离子复合物的构象稳定性和维持线粒体的稳定性[16-17]。
促炎/抗炎反应失调在脓毒症发展过程中也发挥了非常重要的作用。TNF-α 是首先被证实在脓毒症炎症瀑布中起重要作用的细胞因子[18]。TNF-α 与心肌细胞上的受体结合,影响心肌收缩时钙离子流动,出现心肌收缩功能障碍。IL-1β 在脓毒症感染模型中也常见升高,产生心肌抑制因子。此外,TNF-α与IL-1β 间存在正反馈,也可促进多种促炎细胞因子的产生[19]。本实验可见,SMI 组小鼠血浆TNF-α、IL-1β 水平显著升高,提示SMI 小鼠存在炎症反应失调。SMI+Levo 组与SMI 组相比,血浆TNF-α、IL-1β水平显著下降,证实Levo 有抗炎作用,可能通过抑制SMI 小鼠炎症级联反应进而减轻心肌损伤。从心肌组织形态学来看,SMI 组小鼠出现心肌纤维排列不规整,部分心肌纤维断裂,横纹模糊甚至消失,间质出血水肿,炎性细胞浸润等改变。SMI+Levo 组小鼠心肌组织病理评分有好转趋势,但无明显的统计学差异,可能与样本量较小有关。
脓毒症还可以引起线粒体损伤与功能障碍[20]。脓毒症会导致体液大量丢失,组织严重缺氧,刺激体内一氧化氮(NO)、活性氧簇(reactive oxygen species,ROS)过量生成,导致线粒体氧化应激水平升高,ATP 生成减少[21],线粒体能量代谢障碍,功能异常。此外,LPS 也可诱导NO 合酶生成,使NO 过量产生。脓毒症患者外周血中的白细胞在抗炎过程中损伤线粒体内膜,线粒体氧化应激与内膜损伤互为正反馈,加速线粒体损伤[22]。在TNF-α 等细胞因子和氧化应激的共同作用下,线粒体内外钙离子稳态失衡,大量钙离子流入线粒体内,形成“钙超载”。钙超载使线粒体通透性转换孔(permeability transition pore,PTP)呈高通透、持续开放状态,线粒体肿胀、结构破坏[23],加速线粒体氧化应激和能量代谢障碍[24]。此外,脓毒症导致线粒体损伤的机制还包括:(1)线粒体呼吸链及内膜损伤[25]。(2)线粒体DNA 损伤与突变[26]。(3)线粒体解耦联[27]。(4)线粒体分裂、融合及生物发生异常[28]。(5)线粒体自噬[29]等。本实验通过电镜观察心肌细胞线粒体形态发现:SMI 组小鼠线粒体排列紊乱,大量线粒体嵴减少、空泡变性,这是线粒体损伤的标志。SMI+Levo 组线粒体损伤明显减轻,证明Levo 可改善SMI 小鼠心肌细胞的线粒体损伤进而达到保护心脏功能的目的。
综上所述,SMI 的病理发展过程是损害心肌细胞与线粒体结构,进而影响心脏收缩功能。之前研究证实Levo 对心力衰竭患者的心功能有着明显的保护作用[30]。本结果再次证实,Levo 可以有效改善SMI小鼠的心功能,可能与通过抑制炎症减轻线粒体损伤有关。这将为改善SMI 患者治疗方案,延长患者的生存时间和生活质量提供有效依据。但是,本实验仍具有一定局限性,动物实验不能完全代替临床,需要更多随机对照实验或真实世界研究的证据支持。
