周期性拉伸通过组蛋白乳酸化修饰调控平滑肌细胞增殖功能
2023-09-28陈鑫吕慧珍艾玎
陈鑫,吕慧珍,艾玎
(天津医科大学基础医学院生理学与病理生理学系,天津 300070)
冠状动脉粥样硬化性心脏病(CHD)是世界范围的内主要致死病因。冠状动脉旁路手术是最常用于治疗闭塞性冠状动脉粥样硬化病变的策略之一[1]。该手术通过移植患者自身其他部位的血管来代替因动脉粥样硬化斑块而堵塞的病变血管,重新恢复该血管的血流从而达到治疗目的。手术常用自体隐静脉,但与动脉移植相比,静脉移植的通畅率通常不高[2]。早期(移植1 个月内)造成通畅率不高的原因通常是急性血栓的生成,晚期(>2 年)通畅率不高的原因通常是内膜增厚和动脉粥样硬化[3-4]。有研究发现,由动脉循环高压引起的高水平的周期性拉伸可导致静脉移植物管壁平滑肌细胞功能和状态改变,进而促进血管重塑的重要因素,其具体机制目前还未充分得到研究。
组蛋白修饰是基因表达的表观调控层面之一,它可以通过改变染色体的疏松程度来影响转录因子与基因的亲和性从而调控基因表达。近年来发现了各种新型的组蛋白修饰标记,如丙酸化、丁酰化、琥珀酰化、丙二酰化、戊二酰化和巴豆酰化。2019 年芝加哥大学赵英明教授课题组在《Nature》杂志报道了全新的蛋白翻译后修饰(posttranslational modifications,PTMs)类型——乳酸化修饰。该研究证实H3K18la 位点的修饰直接刺激基因转录从而参与调控巨噬细胞的M1/2 极化,糖酵解衍生的乳酸被确定为组蛋白乳酸化的底物[5]。本研究旨在研究血管平滑肌细胞(VSMC)在周期性拉伸后是否存在乳酸积累的增加和组蛋白乳酸化修饰的增加,为阐明代谢重编程和表观遗传修饰在这一力学刺激过程中的作用与机制作出探索。
1 材料与方法
1.1 实验材料 RNA 提取试剂盒(北京全式金公司),Taqq-PCR Mix(美国Thermo 公司),DMEM 培养基(美国Gibco 公司),胎牛血清(美国Gibco 公司),鼠抗GAPDH 抗体(美国Proteintech 公司),兔抗α 平滑肌肌动蛋白(α-SMA)抗体(PTM-5216)(杭州景杰生物科技有限公司),乳酸含量检测试剂盒(北京索莱宝科技有限公司),兔抗L-Lactyl Lysine、Lactyl-Histone H3(Lys9)、Lactyl-Histone H3(Lys14)、Lactyl-Histone H3(Lys18)抗体(杭州景杰生物科技有限公司),兔抗H3 抗体(北京索莱宝科技有限公司),细胞拉伸培养室(广州市华粤行仪器科技有限公司),荧光实时定量PCR 仪(美国Thermo 公司),NST-1400-04-R5 细胞拉伸仪(日本Nepa Gene 公司),恒温细胞培养箱(美国Thermo 公司)。
1.2 实验方法
1.2.1 大鼠主动脉平滑肌细胞的分离和培养 取Sprague-Dawley(SD)大鼠(150 g),麻醉后固定到手术板上,开胸,沿着脊柱取腹主动脉到主动脉弓的一段血管,用显微剪去除血管周围的结缔组织,显微镜下小心撕去血管外膜留下中膜部分,剪碎,用滴管转移到培养瓶中,两周后细胞生长融合。传代到P5 用于实验,每代培养到80%的密度时传代。
1.2.2 蛋白质免疫印迹和杂交实验 用细胞裂解液提取细胞的蛋白质,使用细胞超声破碎仪破碎细胞(3 s/次,超声3 个循环),12 000 r/min 下4℃离心10 min,收集上清液,用BCA 法测好浓度后计算所需上样量,加入SDS 上样缓冲液,100℃变性10 min。制备不连续的SDS-PAGE 凝胶,上样,跑胶,用快速湿转仪设定的程序转膜,室温脱脂牛奶封闭1 h,之后依次孵育一抗和二抗,最后用ECL 显色曝光,Image J 进行后续的定量分析。
1.2.3 细胞总RNA 的提取和qPCR 使用全式金RNA 提取试剂盒,按照说明书提取细胞的RNA 后,再按照逆转录试剂盒两步法合成cDNA,按照2×Taqq-PCR Mix(10 μL),cDNA 和RNAasefree 水(总体积为9 μL),qPCR 引物(1 μL)。具体的程序为:预变性:95℃,300 s;设置40 个循环:变性:95℃,30 s,退火:60℃,30 s,延伸:72℃,30 s;溶解:95℃,30 s,60℃,30 s,72℃,30 s。根据qPCR 得出的荧光曲线的Ct 值,以GAPDH 基因为内参,用2-ΔΔCt计算结果。所用到的引物序列见表1。

表1 qPCR 所需的引物序列Tab 1 Primer sequences for qPCR
1.2.4 组蛋白提取 收集细胞,并用冰PBS 洗涤两次。可以在PBS 和后续的缓冲液中补加5 mmol/L丁酸钠,以保持组蛋白的乙酰化水平。将细胞重悬于TEB 提取缓冲液[TEB:含0.5% Triton×100(v/v)、2 mmol/L 苯甲基磺酰氟(PMSF)和0.02%NaN3(w/v)的PBS],细胞密度为107个/ mL。轻柔搅拌,冰上裂解细胞10 min。4℃以650 g 的离心力离心沉淀细胞核10 min。去除并丢弃上清液。用一半体积的TEB洗涤细胞核,并按照前述方法进行离心。在0.2 mol/L HCl 中重悬沉淀,随后4℃过夜,第二天在4℃以650 g 的离心力离心样本10 min 后收集上清液(含组蛋白),加入等量的50%三氯乙酸,冰上混匀30 min,10 000 r/min 离心10 min,收集沉淀,冰丙酮洗涤沉淀,10 000 r/min 离心10 min,风干,将沉淀溶解在高压水中。测量蛋白浓度后存储于-80℃。
1.2.5 细胞内乳酸含量测定 在107个细胞中加入1 mL 提取液一,冰浴超声波破碎细胞(功率300 W,超声3 s,间隔7 s,总时间3 min);4℃,12 000 g 离心10 min,取0.8 mL 上清液,再加入0.15 mL 提取液二,4℃12 000 r/min 离心10 min 后留取上清待测。根据说明书配制标准品,将测定管、对照管和空白管于570 nm 处测定吸光值,利用标准曲线得到细胞内的乳酸含量。
1.2.6 细胞单轴周期性拉伸装置的使用 在使用细胞拉伸仪之前,使用75%酒精对仪器整体进行消毒,特别是拉伸小室安装的区域。细胞拉伸系统在运行时需要提前准备冷却水并连接至水泵,拉伸单元放置于孵箱里,控制单元放置在孵箱外(图1)。

图1 细胞拉伸仪示意图Fig1 Diagram of cell stretching instrument
(1)设置好频率和幅度后打开控制单元总电源开关,打开后开关灯闪烁绿光。(2)按下START 按钮,拉伸小室支架随之开始移动,此时按钮灯会闪烁绿光。(3)按下STOP 按钮,拉伸室支架停止移动。(4)拉伸完毕后关闭总电源和水泵开关。
既往研究中常用的拉伸幅度和频率条件有:25%、1 Hz[6-8],20%、1 Hz[9-10],15%、1 Hz[11],10%、0.5 Hz[12],10%、1 Hz[13]及10%、1.25 Hz[14-15]。
2 结果
2.1 周期性拉伸后VSMC 的收缩和增殖相关基因表达的改变 周期性拉伸的频率和幅度对细胞的功能改变也不相同,笔者确定了拉伸幅度15%、频率为1 Hz 的周期性拉伸作为模拟动脉循环中VSMC 受到的力学条件,静止于拉伸小室作为模拟静脉循环中VSMC 受到的力学条件。
当VSMC 处于上述两种力学条件24 h 后收集细胞的蛋白和RNA,通过免疫印迹实验和qPCR 对VSMC 中的增殖和表型转换的标志蛋白进行检测。
Western 印迹结果显示,周期性拉伸24 h 后PCNA 的蛋白表达水平无明显变化(P=0.777),α-SMA的蛋白表达水平下降(t=4.715,P<0.01)(图2)。qPCR结果显示,和静息状态相比,PCNA 的mRNA 水平在VSMC 周期性拉伸12 h 后上升,24 h 后恢复到正常水平;细胞周期蛋白Ccnd1 和Cdk6 的mRNA水平呈时间依赖性上升,细胞周期依赖性激酶抑制剂Cdkn1a 和分化相关基因Acta2、Tagln 的mRNA水平呈时间依赖性下降(图3)。
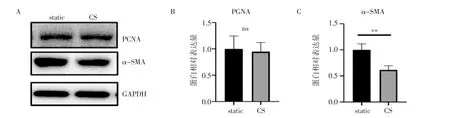
图2 周期性拉伸后VSMC 的PCNA 和α-SMA 的蛋白表达变化Fig 2 Changes in protein expression of PCNA and α-SMA in VSMC after cyclic stretch
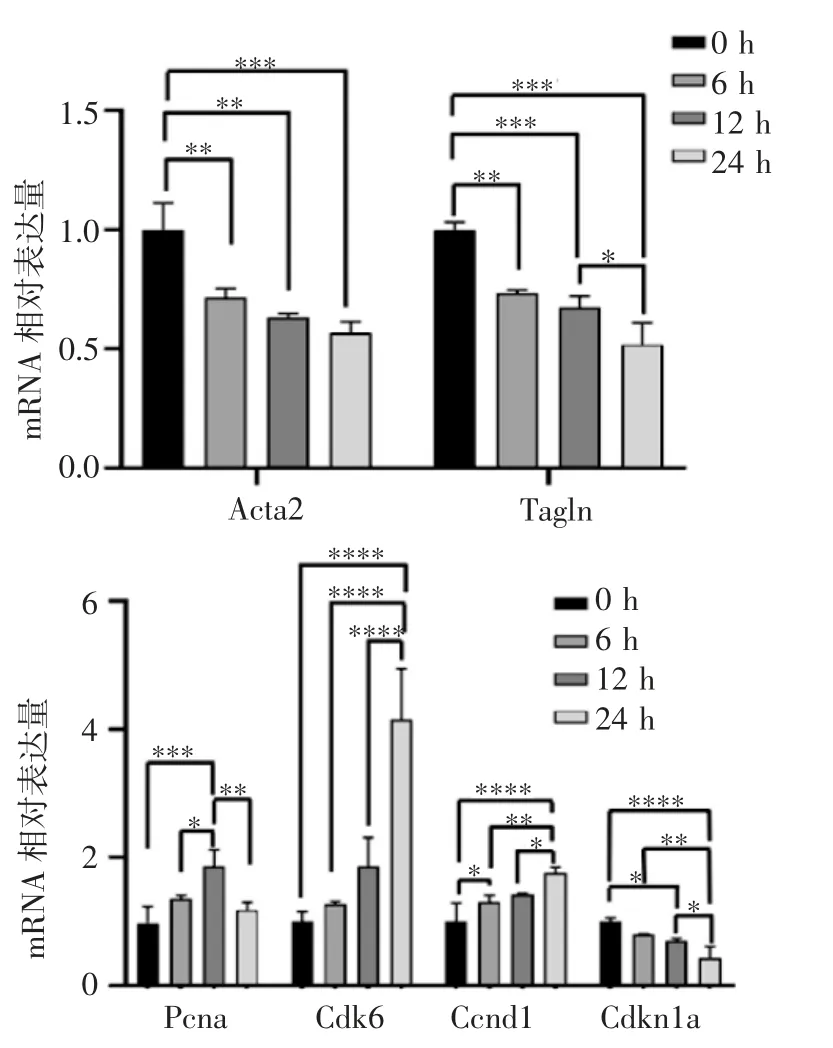
图3 周期性拉伸后VSMC 的增殖和分化相关基因的mRNA 变化Fig 3 Changes in mRNA levels of genes associated with proliferation and differentiation in VSMC after cyclic stretch
2.2 周期性拉伸对细胞内乳酸含量的影响 检测VSMC 周期性拉伸24 h 后细胞内的乳酸水平,与静息状态相比,细胞内乳酸积累增加(t=5.554,P<0.01)(图4)。
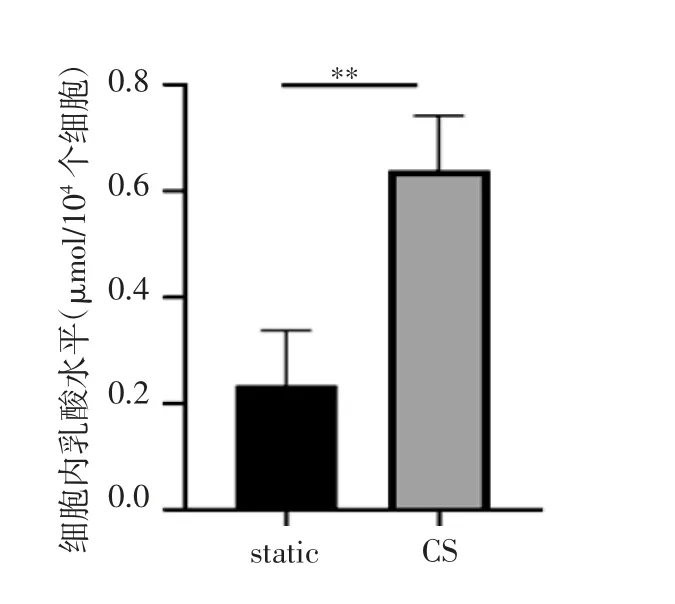
图4 周期性拉伸后VSMC 的乳酸含量变化Fig4 Changes of lactate levels in VSMC after cyclic stretch
2.3 周期性拉伸对组蛋白泛乳酸化修饰的影响 和静息状态相比,周期性拉伸24 h 后的组蛋白的泛乳酸化修饰水平升高(t=3.603,P<0.01)(图5)。
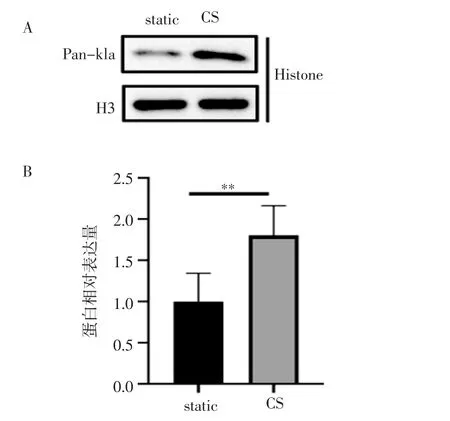
图5 周期性拉伸后VSMC 的组蛋白泛乳酸化修饰的变化Fig 5 Changes of pan-histone lactylation in VSMC after cyclic stretch
2.4 周期性拉伸对位点特异性组蛋白乳酸化修饰的影响 随着周期性拉伸时间的延长,特异性位点乳酸化修饰如H3K9la、H3K14la 和H3K18la 的水平升高并且表现出时间梯度依赖性。与静息状态(0 h)相比,H3K9la、H3K14la 和H3K18la 的水平显著增加(t=6.001、6.966、12.750,均P<0.000 1)(图6)。
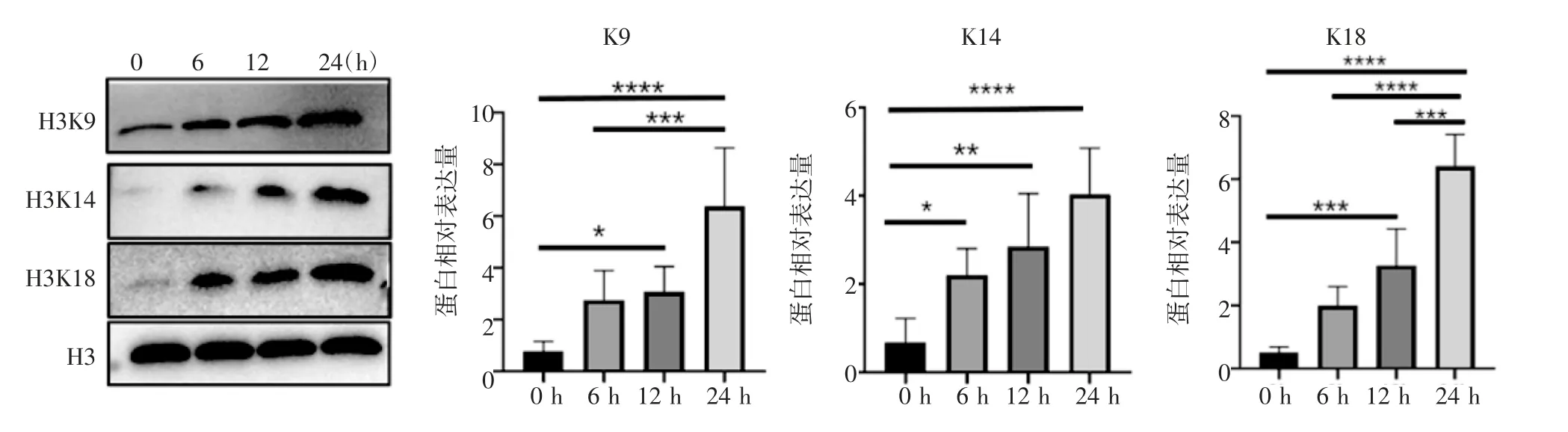
图6 周期性拉伸6、12、24 h 后VSMC 的特异性位点组蛋白乳酸化修饰的变化Fig 6 Changes of site-specific histone lactylation modifications of VSMC after cyclic stretching for 6,12 and 24 h
3 讨论
在血液循环系统中,左心室泵出的血液会对血管壁有3 种力学刺激:血液流动时和管壁的摩擦力,即剪切应力;血液压力引起管壁扩张所引起的周期性应力;由循环系统平均充盈压所产生的静水压力。血管内皮细胞直接接触血流因而主要受剪切应力调节,血管平滑肌细胞则主要受周期性应力调节[16]。周期性应力包括沿着管壁圆周传播的周向应力和纵向应力[17]。其中,VSMC 主要受周向应力的调控[18],形成细胞周期性拉伸。许多研究结果说明,VSMC 周向应力的增加会导致动脉粥样硬化病变的发生。
静脉移植物内膜增厚是静脉及其血管细胞在植入后生物力学和环境因素共同影响的结果,这会导致VSMCs 的激活,并通过包括细胞外基质和钙黏蛋白在内的多个因素共同调节其行为。增厚的内膜极易发生动脉粥样硬化,导致症状再次发生,需要进一步治疗。因此,深入探究静脉移植后周期性拉伸对VSMC 的作用机制,对静脉移植物疾病的临床用药和治疗至关重要。静脉受心脏搏动的影响很小,管腔内压力大约为9~15 mmHg(1 mmHg=0.133 kPa),血管壁细胞的周期性拉伸幅度约为5%~10%。在移植到动脉循环后,其周向应变最高值大约增加了1 倍。基于动、静脉管壁平滑肌细胞所处的周期性拉伸环境和前期对静脉移植的研究实验,笔者最终采用拉伸幅度15%、频率为1 Hz 的周期性拉伸来模拟动脉管壁的力学环境,静止于拉伸小室中则被用来模拟静脉管壁的力学环境。成熟VSMCs 表达α-SMA,这一蛋白标志表明细胞收缩能力强。和静息状态的对照组相比,15%、1 Hz 的周期性拉伸可以降低收缩标志α-SMA 的蛋白和mRNA 水平,说明周期性拉伸可能使VSMC 去分化,这一结果和之前的研究一致[19-20],说明本研究的模型构建成功。
乳酸是细胞糖酵解途径生成的重要代谢产物,其生物学功能因肿瘤细胞中Warburg 效应的存在得到了广泛关注。组蛋白乳酸化修饰水平受细胞乳酸含量的调控。与组蛋白乙酰化类似,组蛋白乳酸化可以直接刺激染色质的基因转录。之前有相关研究的代谢组学数据显示,15%、1 Hz 的周期性拉伸条件下VSMC 会改变其产能方式,即由氧化磷酸化转向糖酵解方向[21]。本工作证实了周期性拉伸的条件下VSMC 的乳酸积累增多,并且增多的乳酸会作为组蛋白乳酸化的底物,导致组蛋白乳酸化水平的改变。与静息状态相比,周期性拉伸后的VSMC 的泛乳酸化和特异性位点(K9、K14、K18)的乳酸化修饰水平均显著增加。目前已发现,即使在充分氧化的条件下,VSMC 也会产生大量乳酸,并且局部缺血、心脏骤停以及休克、烧伤、创伤和其他病理情况都会引起局部和全身的乳酸浓度升高。2017 年研究结果首次证明了VSMCs在富含乳酸的微环境中可以呈现出更多的合成表型,明确了VSMC 的代谢状态和平滑肌细胞表型转换的关系[22]。VSMC的增殖和肿瘤细胞一样需要大量能量,一些研究表明异常增殖的VSMCs 中也存在Warburg 效应[23]。内皮损伤后,VSMCs 中葡萄糖转运蛋白1 水平升高,表明葡萄糖摄取与VSMCs 增殖之间存在相关性[24]。有研究提出,血小板衍生生长因子(PDGF)通过糖酵解途径显著诱导VSMCs 增殖。在肺动脉高压中,Warburg 效应的抑制剂能够降低肺动脉VSMCs 的增殖水平、缓解肺血管重构,并改善心肌肥厚及心力衰竭[25-27]。这说明糖酵解在VSMCs 的增殖中具有十分重要的作用。
已有报道证实,H3K18la 和H4K5la 参与了缺氧性肺动脉高压的平滑肌细胞增殖过程,破坏乳酸的产生或组蛋白的乳酸化则使平滑肌细胞的增殖和血管重塑减弱[28]。机械力刺激下的组蛋白乳酸化,能够在早期激活VSMC 增殖相关细胞因子,提示组蛋白的乳酸化可能是VSMC 增殖的早期启动信号。周期性拉伸能够诱导VSMC 中血管内皮生长因子-α、转化生长因子-β 等细胞因子的表达并促进VSMC增殖[29-30]。有报道乳酸和组蛋白乳酸化能够在内皮细胞、单核细胞等多种细胞类型中激活血管内皮生长因子、转化生长因子-β 通路[31-33],推测VSMC 中也存在类似的细胞因子激活机制,即机械牵张可能通过组蛋白乳酸化激活血管内皮生长因子、转化生长因子-β 等信号通路,促进VSMC 增殖。周期性拉伸时,VSMC 中高度糖酵解活性和高组蛋白乳酸化水平的相互作用机制仍待进一步研究。
综上所述,本研究说明了周期性拉伸后VSMC存在代谢状态的改变,糖酵解的最终代谢产物乳酸积累增加,并且组蛋白乳酸化修饰水平也增加,这可能是VSMC 增殖的早期启动信号。
