先天性室间隔缺损致病基因SOX18新突变的发现及功能研究
2023-09-28徐惠玉严梓杨奕清刘兴元
徐惠玉 严梓 杨奕清 刘兴元
先天性心脏病是人类最常见的发育畸形,在新生儿中的发病率约为1%,临床上可分为20 种以上的不同类型,其中以室间隔缺损(VSD)最为常见,VSD 可导致脑损伤、脑发育迟缓、脑卒中、肺动脉高压、充血性心力衰竭、室上性及室性心律失常甚至死亡[1-2]。既往研究表明,先天性心脏病主要是由遗传缺陷所致,已经发现了100 多个基因与人类先天性心脏病有关,其中包括SOX7和SOX17基因[3-5]。SOX 族F 组转录因子基因总有3 个成员,包括SOX7、SOX17和SOX18,其表达与功能特点相似,有一定的相互代偿功能[6],由此推测SOX18基因突变也很有可能导致先天性心脏病。
1 对象与方法
1.1 研究对象
2017 年4 月—2021 年9 月,自同济大学医学院附属同济医院和上海市第一人民医院嘉定医院的就诊者中入选156 例患儿(病例组),均根据心脏超声检查结果或心脏手术记录明确诊断为先天性心脏病。来自同期体检者其中男性82 例,女性74 例,年龄为1~11 岁,平均年龄为(6±4)岁。对照组为216 名汉族无先天性心脏病儿童,来自同期体检者,其中男性114 名,女性102 名,年龄为1~12 岁,平均年龄为(6±3)岁。病例组8 例(5.1%)有家族史,对照组均无先天性心脏病家族史。2 组均无可诱发先天性心脏病的环境因素。本研究遵循人类医学伦理规范,并经过2 所医院的伦理委员会的审核、批准。经研究对象的法定监护人知情同意后,收集其临床数据和血液标本,常规提取其基因组DNA。
1.2 方法
1.2.1SOX18基因的扩增 采用聚合酶链反应(PCR)仪(美国Thermo Fisher Scientific 公司)特异性扩增SOX18基因整个编码区。所设计的扩增SOX18基因编码区即编码外显子1 和2 的引物序列见表1(由于编码外显子较大,分别分成2 段和3 段进行扩增)。
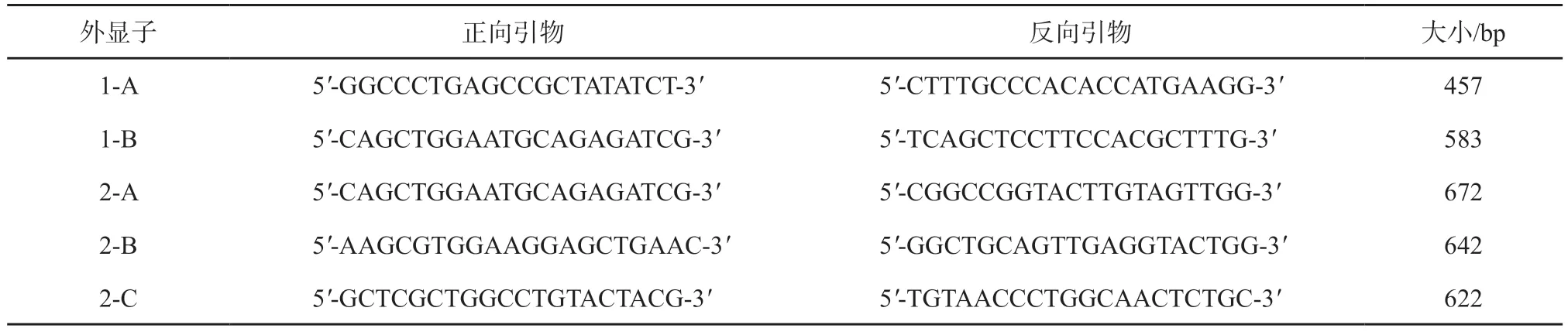
表1 扩增SOX18基因编码外显子的引物序列
以每位入选对象的基因组DNA 为模板,应用化学合成的上述SOX18基因扩增引物及热启动 Taq DNA 聚合酶试剂盒(美国NEB 公司),对SOX18基因片段进行PCR 扩增。PCR 混合物的总体积定为25 μL,包括10×标准Taq 酶反应缓冲液2.5 μL、dNTPs(10 mmol/L)0.5 μL、正反向引物(10 μmol/L)各0.5 μL、热启动 Taq DNA 聚合酶(5 U/μL)0.125 μL、基因组DNA(30 ng/μL)2 μL、双蒸水18.875 μL。PCR 的热循环条件为:95 ℃预变性30 s,随即进入35 个热循环,即95 ℃变性30 s、62 ℃ 退火45 s 和68 ℃ 延伸1 min,最后68 ℃延伸6 min。PCR 终产物经1.2%琼脂糖凝胶电泳分离后切胶回收并用凝胶DNA 纯化试剂盒(中国Sangon Biotech 公司)纯化PCR 终产物。
1.2.2SOX18基因的测序与序列比对分析 以纯化的PCR 终产物为模板,用1 条SOX18基因扩增引物和DNA 测序试剂盒在PCR 仪上进行测序反应。测序反应混合物的体积定为20 μL,其中预混合液8 μL、正向引物(2 μmol/L)2 μL、SOX18基因片段DNA(20 ng/μL)2 μL、双蒸水8 μL。测序反应的条件如前所述[7]:总计30 个循环,每个循环包括95 ℃变性20 s、50 ℃退火15 s 和60 ℃延伸l min。测序反应产物经纯化回收后在DNA 测序仪(美国Thermo Fisher Scientific 公司)上进行测序。
对比分析所测的SOX18基因序列与核苷酸数据库(https://www.ncbi.nlm.nih.gov/Nucleotide)中公布的SOX18基因序列(登陆号:NM_018419.3)以发现SOX18基因变异。一旦发现SOX18基因变异,就测序分析216 名对照者的SOX18基因,同时检索 SNP (https://www.ncbi.nlm.nih.gov/snp)、PubMed(https://pubmed.ncbi.nlm.nih.gov)和万方数据库(https://c.wanfangdata.com.cn/periodical),以明确所发现的SOX18基因变异是否为新突变。
1.2.3SOX18基因变异的致病性预测 借助2021版 在线软 件MutationTaster2021(https://www.mutationtaster.org/)预测SOX18基因变异是否为致病性突变。
1.2.4 构建真核表达质粒 以人类心脏cDNAs 为模板,设计合成1 对特异性扩增SOX18基因全长cDNA 的引物(正向引物为5'-GACGAATTCCGC GCTCCCGCGCTCCGTTC-3',反向引物为5'-GTC CTCGAGGAGGAAGCGCTGCAGGGACC-3'),使用高保真Phusion®DNA 聚合酶试剂盒(美国NEB公司)在PCR仪(德国Eppendorf MasterCycler公司)上通过PCR 生成SOX18基因全长cDNAs。PCR混合物的总体积定为50 μL,包括5×Phusion HF 缓冲液10 μL、dNTPs(10 mmol/L)1 μL、正反向引物(10 μmol/L)各2.5 μL、Phusion DNA 聚 合酶(2 U/μL)0.5 μL、cDNAs(10 ng/μL)2 μL、双蒸水31.5 μL。PCR 的热循环条件为:98 ℃预变性30 s 后,进入30 个热循环,每个热循环包括98 ℃变性10 s、62 ℃ 退火30 s 和72 ℃ 延伸1 min,最后72 ℃延伸10 min。
使用核酸内切酶EcoRI 和XhoI 分别双酶切纯化后的SOX18基因全长cDNAs 和真核表达质粒pcDNA3.1,纯化后用T4 DNA 连接酶 将SOX18基因全长cDNAs 与pcDNA3.1 连接即可构建野生型SOX18的真核表达质粒SOX18-pcDNA3.1,然后通过测序证实。以野生型SOX18-pcDNA3.1 为模板,应用1 对以突变点为中心、长各为31 个碱基的互补引物和定点诱变试剂盒(美国Agilent 公司),通过PCR 获得突变型SOX18-pcDNA3.1。用DNA 酶Dpn I(美国NEB 公司)切除模板即野生型SOX18-pcDNA3.1 并经测序证实获得突变型SOX18-pcDNA3.1。
类似地,设计、合成1 对特异性扩增长度为1 545 bp 的NR2F2基因(登录号NC_000015.10)启动子区域(转录起始位点上游1 544 bp~转录起始位点即-1 544 bp~+1 bp)的引物(正向引物 为5'-GTGGCTAGCTGGTTGGTTTACCGGCA TG-3',反向引物为5'-CACCTCGAGCCGCGATCA GCTCACTGAGC-3'),以人基因组DNA 为模板,使用高保真Phusion®DNA 聚合酶试剂盒(美国NEB公 司) 在PCR 仪(德 国Eppendorf MasterCycler公司)上通过PCR 生成NR2F2基因启动子片段,通过NheI 和XhoI 双酶切NR2F2基因启动子片段和无启动子的萤火虫荧光素酶表达质粒 pGL3-Basic(美国Promega 公司),然后通过连接反应构建NR2F2基因启动子驱动萤火虫荧光素酶表达的质粒NR2F2-luc 并经测序证实。
1.2.5SOX18基因突变体的功能分析 常规培养HeLa 细胞,多种表达质粒共转染的方法如文献所述[5]。每次细胞质粒转染实验采用脂质体Lipofectamine 3000(美国Invitrogen 公司)转染0.6 μg pcDNA3.1 空质粒 或0.6 μg 野生型SOX18-pcDNA3.1 质粒或0.6 μg Gln144*-突变型SOX18-pcDNA3.1 质粒或0.3 μg pcDNA3.1 空质粒+0.3 μg 野生型SOX18-pcDNA3.1 质粒或 0.3 μg 野生型SOX18-pcDNA3.1 质粒+0.3 μg Gln144*-突变型SOX18-pcDNA3.1 质粒,同时共转染1.5 μgNR2F2-luc 质粒和20 ng pGL4.75 质粒(美国Promega 公司)。共转染海肾荧光素酶表达质粒pGL4.75 作为内对照以平衡转染效率。转染后48 h收集、裂解HeLa 细胞。采用荧光分析仪(美国Promega 公司),应用双荧光素酶分析试剂盒(美国Promega 公司)定量分析细胞裂解液中2 种荧光素酶的活性,以萤火虫与海肾荧光素酶活性之比表示靶基因NR2F2启动子的转录活性。
1.3 统计学分析
连续数据如入选者年龄、靶基因NR2F2启动子的转录活性等用均数±标准差表示;分类数据如入选者的性别、种族等用数字(百分比)表示。2 组连续数据的比较用非配对Student’st检验;2 组分类数据的比较用Fisher’s 精确概率检验或Pearson’sχ2检验。双侧检验P<0.05 表示差异有统计学意义。
2 结果
2.1 发现SOX18基因新突变
本研究2 组入选者均为中国汉族人,组间的性别构成差异无统计学意义(经Pearson’sχ2检验P>0.05),年龄差异也无统计学意义(经Student’st检验P>0.05)。通过对156 例先天性心脏病患儿的SOX18基因的编码区进行测序分析,在其中1 例4 岁男性散发性先天性VSD 患儿发现了1 种SOX18基因杂合突变,即NM_018419.3:c.430C>T;p.(Gln144*) 突变。该SOX18基因无义突变不存在于216 例对照组,在SNP、PubMed 和万方数据库也未见报道,表明该SOX18基因突变是新发现的突变。该例先天性VSD 患儿的SOX18基因c.430C>T杂合突变DNA 序列见图1。

图1 SOX18基因c.430C>T杂合突变
该例先天性VSD 患儿的SOX18基因c.430C>T杂合突变的纯合野生型C/C 对照DNA 序列见图2。

图2 SOX18基因c.430C>T杂合突变的纯合野生型C/C对照DNA序列
2.2 SOX18基因突变c.430C>T是致病突变
SOX18基因突变c.430C>T 被在线软件MutationTaster2021 预测为致病性突变,该预测的正确率>99.99%。
2.3 Gln144*-突变型SOX18对靶基因NR2F2 的转录激活效应丧失
在转染了基因表达质粒的HeLa 细胞中,0.6 μg野生型SOX18-pcDNA3.1 质粒和等量(0.6 μg)的Gln144*-突变型SOX18-pcDNA3.1 质粒对靶基因NR2F2启动子的转录激活作用分别约为16 倍(16.36±1.92)和1 倍(1.12±0.57),2 组间的转录激活作用有显著性差异(t=13.15,P=0.000 2);而在同时转染0.3 μg 野生型SOX18-pcDNA3.1 和等量(0.3 μg)Gln144*-突变型SOX18-pcDNA3.1 时,所诱导的转录激活作用约为8 倍(8.36±0.73),显著低于0.6 μg 野生型SOX18-pcDNA3.1 对靶基因NR2F2启动子的转录激活作用,2 组间有显著性差异(t=6.73,P=0.002 5)。
3 讨论
本研究在1 例男性散发性VSD 患儿中检测出1 种新的SOX18基因杂合突变,即NM_018419.3:c.430C>T;p.(Gln144*) 突变。该SOX18基因无义突变不存在于216 名无先天性心脏病儿童中。计算机软件MutationTaster2021 模拟分析表明该突变是致病突变。双报告基因定量分析显示Gln144*-突变型SOX18对靶基因NR2F2启动子的转录激活效应完全丧失,而NR2F2基因功能障碍已经被证实可导致多种类型的先天性心脏病,包括VSD[8-10]。因此,SOX18基因新突变c.430C>T即 p.(Gln144*) 很可能是该例VSD 患儿的分子病因。
人类SOX18基因定位于20 号染色体20q13.33区域,编码由384 个氨基酸残基组成的转录因子,属于SOX 家族F 组[11]。SOX18在胚胎发育期间大量表达于心脏、血管和淋巴管系统,主要通过单独或与其转录合作伙伴如NKX2.5 或MEF2C 协同调控心血管发育相关靶基因如NR2F2或GATA4的表达,对心血管的正常发育发挥关键影响[4-6,11-13]。不仅如此,NR2F2、GATA4、NKX2.5和MEF2C基因功能丧失性突变均被发现可导致先天性心脏病[8-10,14-15]。本研究发现SOX18基因功能丧失性突变可导致VSD,显示人类SOX18基因单倍型不足是VSD 发生的分子机制之一。
在脊椎动物中,目前已经克隆了至少20 个SOX族基因,这些SOX族基因被分为10 个组(从A 组到I 组),其中F 组的SOX7、SOX17和SOX18均在胚胎发育时期共表达于心血管系统,调节细胞特化和组织分化,从而在心血管形态发生方面发挥重要作用[6,16]。在蟾蜍中,敲减Sox18或Sox7可部分抑制心脏发育,而同时敲减Sox18和Sox7则可显著增强对心脏发育的抑制;Sox18mRNA 可以拯救Sox7敲减的效应,反之亦然,表明Sox18和Sox7在功能上的冗余作用[17]。在斑马鱼中,敲减Sox18或Sox7可导致轻微的血管发育畸形,而同时敲减Sox18和Sox7则可导致严重的动静脉血管发育畸形;单独敲减Sox18或Sox7时,只有一部分斑马鱼表现出血管畸形(部分外显),而在Sox18和Sox7双基因同时敲减时,所有斑马鱼均表现出血管畸形(完全外显),显示这2 个基因功能上的互补作用[6]。在小鼠中,Sox17基因敲除可导致胎心环化异常和动静脉畸形,而Sox17和Sox18双基因敲除则导致严重的胚胎心血管发育畸形[16]。在人类中,Sox7和Sox17基因功能丧失性突变均已发现可导致先天性心脏病[4-5]。这些研究结果提示SOX18基因功能丧失性突变可导致人类先天性心血管畸形。
值得一提的是,此前已有报道SOX18基因突变可导致毛发稀少-淋巴水肿-毛细血管扩张综合征以及主动脉扩张、肺动脉高压和肾功能衰竭[18]。本研究发现SOX18基因功能丧失性新突变可导致VSD,扩大了SOX18基因突变的表型谱。
总之,本研究发现1 个新的SOX18基因功能缺失性突变可导致VSD,为部分VSD 的早期精准医学防治提供了新的分子靶标,具有一定的临床意义。
