微小RNA-127-3p在乙型肝炎病毒相关性肝癌中的表达意义及对HBV阳性肝癌细胞增殖迁移侵袭的影响*
2023-09-28刘洪涛冯守宁刘金强吴慧丽
刘洪涛 冯守宁 刘金强 吴慧丽
1.郑州人民医院急诊科 (河南 郑州,450000) 2.郑州中心医院消化内科
肝细胞癌是临床上最常见恶性肿瘤之一,发病率和死亡率分别位列第7位和第4位。肝癌早期症状不明显,多数患者一经发现已处于中晚期,预后不佳,5年生存率仅为15%~40%,给患者的生命安全带来严重威胁[1]。乙型肝炎病毒(HBV)是肝细胞癌最常见的危险因素,HBV相关性肝癌在国内的原发性肝癌病例中占80%左右,HBsAg呈阳性患者患肝细胞癌地风险比HBsAg阴性人群高10~50倍[2]。因此,早期诊断、早期治疗可极大提高患者的治愈率,延长生存期。微小RNA(miRNA)是一种小的类似于小干扰RNA(siRNA)的分子,参与多种肿瘤细胞的分化、增殖、凋亡等多个过程,现已成为新一代疾病诊断与分子靶向治疗的标志物[3,4]。miR-127-3p是一种小分子的非编码RNA,在不同癌症中均具有重要作用,研究表明,其在胃癌、宫颈癌患者中表达水平较低,并对癌细胞的生长、增殖主要起抑制作用[5,6]。目前关于miR-127-3p在HBV相关性肝癌中的表达意义及其对肝癌细胞生物学行为的影响研究鲜有报道。基于此,本研究探讨miR-127-3p在HBV相关性肝癌中的表达意义及对HBV阳性肝癌细胞增殖、迁移、侵袭的影响,为HBV阳性肝癌分子靶向治疗提供依据。
1 材料与方法
1.1 肝癌组织标本来源 肝癌组织标本均取自2018年12月至2020年12月在医院普通外科接受手术切除的64例HBV相关性肝癌患者。所有标本采集均经过患者及其家属同意并签署知情同意书。所有患者乙型肝炎表面抗原HBsAg或HBV DNA检查为阳性,且术前均未行放化疗,术后病理证实为HBV相关性肝癌。本研究经医院医学伦理委员会审核批准。
1.2 实时荧光定量聚合酶链反应 通过实时荧光定量聚合酶链反应(RTFQ-PCR)检测肝癌及癌旁组织miR-127-3p相对表达量。Trizol法提取肝癌组织、癌旁组织及细胞中总RNA。以5 μl总RNA为模板,使用RT-PCR试剂盒(上海吉玛制药技术有限公司)将RNA反转录成cDNA,总反应体系:2 μl cDNA,2.5 μl Taq DNA聚合酶,0.5 μl上下游引物,10 μl双蒸水。以逆转录产物为模板,在美国ABI 7300实时荧光定量PCR仪系统上进行扩增,反应条件:95℃预变性5 min,95℃变性15 s,60℃退火45 s,共35个循环。每个样品的CT值以U6作为内参进行校正,△CT=CT目的基因-CTU6,采用2-ΔΔCt法计算miRNA的相对表达量。miRNA的引物序列来自Sanger数据库,由上海赛百胜基因技术有限公司合成。miR-127-3p正向引物序列:5′-UGAUUGGUACGUCUGUGGGUAGTT-3′,反向引物序列:5′-CUACCCACAGACGUACCAAUCATT-3′;内参基因U6上游序列:5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游序列:5'-CGCTTCACGAATTTGCGTGTCAT-3′。
1.3 肝癌HepG2细胞培养与转染 将购于上海生工生物工程股份有限公司的人肝癌HepG2细胞株快速解冻,加入RPMI-1640培养液(含10%小牛血清及1%的青霉素链霉素双抗),混匀后置于离心机中,1 000 rpm/min离心5 min,弃上清,用8 ml配好的RPMI-1640重悬细胞并吹打混匀,将细胞悬液移至培养瓶中,于37℃、5% CO2、湿度 85%的细胞培养箱中培养。倒置显微镜下观察细胞,待瓶底铺满时弃上清,用高温灭菌的1×PBS洗涤3次,加入2 ml胰蛋白酶,常温静置4 min,弃去胰蛋白酶,用含10%FBS的1640培养液终止消化,反复吹打后将细胞悬液置于15 ml离心管,1 000 rpm/min离心5 min,获得细胞沉淀。转染前24 h,将肝癌HepG2细胞接种于6孔板中,待细胞长到80%汇合度时,按照LipofectamineTM2000试剂盒(北京索莱宝科技有限公司)操作说明书将不同浓度的miR-127-3p mimic(10、20、50 pmol)(广州市锐博生物科技有限公司)和LipofectamineTM2000混合均匀,用完全培养基定容至2 ml,8 h后更换新鲜培养基,48 h后收集细胞提取总RNA检测转染效率及进行功能实验。对照组(0 pmol miR-127-3p mimic)加等量Opti-MEM培养基进行培养。
1.4 HepG2细胞中miR-127-3p表达量检测 取各组转染48 h后细胞,以RTFQ-PCR检测miR-127-3p表达量,具体操作方法同癌症组织与癌旁组织miR-127-3p相对表达量检测步骤。
1.5 MTT法检测各转染组细胞增殖情况 收集10、20、50 pmol miR-127-3p mimic转染组及对照组细胞,0.25%胰酶消化后重悬,按照2.0×104个/ml接种至96孔板,每组5个复孔,培养至48 h时,加入新鲜制备的20 μl MTT溶液(5 mg/ml)(武汉普诺赛生命科技有限公司),同条件培养4 h后弃去上层培养液,各孔加入150 μl DMSO溶液,振荡至紫色结晶充分溶解,使用酶标仪于波长570 nm处测定各孔的光密度(optical density,OD)值。重复实验3次。细胞增殖率=(OD试验-OD空白)/(OD对照-OD空白)×100%。
1.6 细胞划痕实验检测细胞迁移能力 用马可笔在6孔板背后划均匀平行的横线,间隔约1 cm,横穿过孔,每孔至少穿过5条线,在孔中加入5×105个细胞的培养基,次日待细胞铺满孔底后,使用枪头垂直于马可笔的横线划痕,PBS漂洗细胞3次,去除划下的细胞,加入无血清培养基,于37℃、5% CO2的细胞培养箱中培养,于48 h取出,于倒置显微镜下观测拍照,测量周边细胞向划痕区域中央迁移的距离。
1.7 Transwell实验检测细胞侵袭能力 提前将Matrigel基质胶均匀平铺于上室,消化收集各转染组细胞,用无血清培养基重悬,将含7×104个细胞的无血清细胞悬液200 μl添加至小室上层,小室下层添加含10% FBS的血清DMEM培养基作为诱导物,常规培养48 h后终止培养,用体积分数4%多聚甲醛固定细胞15 min,擦去小室内室膜上的细胞,1%结晶紫染色30 min,轻轻擦去小室上层未穿膜细胞,用自来水清洗后于室温晾干,用Olympus显微镜(200×)随机选取3个视野计算穿膜细胞并进行统计。
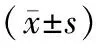
2 结果
2.1 肝癌组织与癌旁组织miR-127-3p表达量比较 见表1。
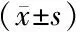
表1 肝癌组织与癌旁组织miR-127-3p表达量比较
2.2 各转染组细胞miR-127-3p表达量比较 见表2。
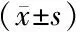
表2 各转染组细胞miR-127-3p表达量比较
2.3 各转染组细胞增殖情况比较 见表3。
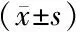
表3 各转染组细胞增殖情况比较
2.4 各转染组细胞迁移能力比较 见表4。各转染组细胞迁移形态见图1。

图1 各转染组miR-127-3p对肝癌HepG2细胞迁移的影响
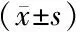
表4 各转染组细胞迁移能力比较
2.5 各转染组细胞侵袭能力比较 见表5。各转染组细胞结晶紫染色见图2。

图2 各转染组miR-127-3p对肝癌HepG2细胞侵袭的影响(结晶紫染色×200)
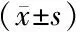
表5 各转染组细胞侵袭能力比较
3 讨论
HBV感染作为肝细胞癌的主要病因已被世界公认,每年0.4%~0.6%的HBV慢性感染者被诊断为肝癌,其危险程度远高于非感染者[7]。miRNA是一类长19~25 nt的非编码微小RNA,作为基因表达的转录后调控因子,是基因调控网络中的核心成分,广泛存在于从病毒到人类的各种生物中,近年来逐渐被报道广泛参与包括细胞生长、增殖、分化凋亡等多种生物进程,包括肿瘤的形成,且不同miRNA在不同的肿瘤中发挥不同作用,包括致癌和抑癌作用[8]。miRNA与HBV相关性肝癌的发生发展具有密切关系,但其表达存在显著差异,作用机制也多有不同。因此明确HBV感染引起肝细胞肝癌的发生机制、寻找新的早期诊断指标以及治疗靶标具有重要作用。
miR-127-3p是人类miR-127基因前体可以表达的成熟miRNA之一,在多种肿瘤组织中均有表达,但表达程度不同[9]。典辉等[10]报道显示,miR-127-3p在乳腺癌组织中的表达高于癌旁组织,认为其在乳腺癌中发挥促癌作用。但多数研究均显示[11,12],miR-127-3p是一种肿瘤抑制因子,可通过不同信号通路抑制葡萄膜黑色素瘤、人骨肉瘤等肿瘤细胞的增殖。如Ji等[13]研究报道显示口腔鳞状细胞癌患者miR-127-3p表达下调,认为miR-127-3p通过影响KIF3B信号通路抑制癌细胞的增殖、迁移和侵袭。另有研究报道称[14],miR-127-3p通过下调MAPK4抑制大鼠卵巢癌的增殖。上述文献报道证实miR-127-3p在肿瘤中主要发挥抑癌作用。本研究结果表明,HBV相关性肝癌患者肝癌组织miR-127-3p表达量低于癌旁组织,提示miR-127-3p在HBV相关性肝癌患者中低表达,可作为重点筛查指标,以提前预警并监测肝癌的发生。
据报道,肝癌发生的潜在机制是肝细胞中载脂蛋白B mRNA编辑酶催化亚基2的过表达诱导的抑癌基因突变[15]。miRNA可通过靶向HBV基因表达所需的细胞转录因子或通过直接结合HBV转录物来调节HBV转录水平的感染[16]。Li等[17]研究显示,miR-122可以特异性结合酶催化亚基2 mRNA的3′-非翻译区(3′UTR),从而抑制肝癌细胞的表达。本研究结果显示,上调miR-127-3p表达后,肝癌HepG2细胞增殖率降低,迁移距离减小,穿膜细胞数减少,说明miR-127-3p参与了HBV阳性肝癌细胞的增殖、迁移和侵袭,并呈负调控作用,与张玉蓉等[18]研究结果基本一致,证实miR-127-3p在HBV阳性肝癌中发挥抑癌作用。推测其作用机制可能与miR-127-3p可靶向下调MAPK4表达,抑制其下游蛋白MAPKAPK5及HSPB1磷酸化有关[19]。
综上所述,miR-127-3p与HBV相关性肝癌的发生、发展关系密切,在肝癌患者中呈低表达,可作为重点关注指标。此外,miR-127-3p过表达可抑制肝癌HepG2细胞的增殖、迁移和侵袭能力,发挥抑癌作用,但具体作用机制仍需更深入挖掘探究,以期发现肝癌早期诊断及靶向治疗的新途径。
