2型糖尿病相关非酒精性脂肪性肝病老龄小鼠模型的建立*
2023-09-28张春艳李永勤王聪霞
韩 拓 周 静 李 盈 徐 阳 李 成 姬 婧 张春艳 李永勤 张 岩△ 王聪霞
1.西安交通大学第二附属医院心血管内科 (陕西 西安,71004) 2.延安大学附属医院心血管内科 3.西安交通大学第二附属医院检验科
非酒精性脂肪性肝病(NAFLD)已经成为全球最为常见的慢性肝脏疾病之一,据统计,全球约25%的成年人患有NAFLD[1]。肥胖、2型糖尿病是NAFLD发生的重要危险因素[2]。有研究表明,55%~70%的2型糖尿病(T2DM)患者中合并有NAFLD,37.3%已出现非酒精性脂肪性肝炎(NASH)[3]。阐明T2DM与NAFLD之间的共同发病机制有赖于稳定且高效的实验动物模型。然而,目前多数研究经常使用的动物模型虽在一定程度上能够模拟T2DM患者肝脏病理改变,但都存在不足之处[4]。此外,T2DM和NAFLD都属于增龄性疾病,而现有动物实验很少有在老龄鼠中开展。本研究利用C57BL/6J老龄小鼠,通过高脂饮食(HFD)联合链脲佐菌素(STZ)腹腔注射建立T2DM合并NAFLD的老龄小鼠模型,为今后相关研究提供更理想的实验动物模型。
1 材料与方法
1.1 药物与试剂 高脂饲料(购自广州睿迪生物公司,货号#D12492,含60%的脂肪),链脲佐菌素(购自Sigma公司,货号#S0130),油红O粉末(购自Sigma公司,货号#O0625),苏木素-伊红染液(购自陕西中晖赫彩有限公司),总胆固醇与三酰甘油测定试剂盒(购自中生北控生物科技公司),BCA蛋白定量试剂盒(购自碧云天生物公司)。
1.2 主要实验仪器 全自动血液生化分析仪(贝克曼公司,型号#AU5800),电子分析天平(奥豪斯仪器有限公司,型号#CP224C),台式高速冷冻离心机(贝克曼公司,型号#Microfuge 20R),轮转式石蜡切片机(德国莱卡公司,型号#HistoCore MULTICULT),正置显微镜成像系统(德国莱卡公司,型号#DM2000LED)。
1.3 实验动物与造模方案 18周龄C57BL/6J雄性小鼠共16只购自西安交通大学实验动物中心(动物生产许可证号:SYXK(陕) 2018-001),饲养于清洁级环境,室内温度(22±2)℃,自由饮食。适应性饲养1 w后,随机分为模型组与对照组(n=8只/组)。模型组小鼠全程给予高脂饲料(HFD)喂养,对照组小鼠给予普通饲料。自第3周开始,模型组小鼠连续5 d腹腔注射50 mg/kg的链脲佐菌素(STZ,注射前过夜禁食14 h),对照组给予等体积柠檬酸/柠檬酸钠溶液腹腔注射。注射结束后3 d和1 w后分别于尾尖采血测禁食4~5 h后的血糖水平,血糖超过11.0 mmol/L表明糖尿病造模成功。期间模型组先后有3只小鼠死亡,对照组无小鼠死亡。每周监测体重,继续饲喂至第6 w造模结束,腹腔麻醉、眼球采血,分离心脏、肝脏及肾脏,进行血浆生化与组织病理检测。
1.4 血浆生化检测 小鼠摘眼球取血,EDTA抗凝后4℃、3 000 r/min离心15 min,收集上层血浆。采用全自动血液生化分析仪检测各组小鼠血浆谷丙转氨酶、谷草转氨酶、血肌酐、尿素氮、胱抑素C,以及血浆葡萄糖、总胆固醇、三酰甘油、高密度脂蛋白胆固醇与低密度脂蛋白胆固醇水平。
1.6 H&E组织病理染色 肝、心、肾组织于4%多聚甲醛固定48 h以上,流动水冲洗30 min,进行组织脱水、包埋与石蜡切片,切片厚6 μm。常规脱蜡入水,苏木素染液浸染3 min,流动水漂洗数秒,伊红染液浸染3~5 min,显微镜下观察。梯度酒精脱水、二甲苯透明,中性树胶封片。
1.7 肝脏脂质含量检测 取小鼠肝脏50 mg,用眼科剪在冰上快速剪碎并倒入玻璃匀浆器中,加入2 ml预冷的PBS,将匀浆器下端插入冰水中充分研磨5~8 min,制备肝组织匀浆。10 000 r/min、4℃离心10 min,取上清液备用。参照试剂盒说明书操作,使用紫外可见分光光度计检测上清液与血浆总胆固醇和三酰甘油含量。采用BCA法测定上清液中蛋白浓度,以校正肝脏内总胆固醇与三酰甘油含量。
1.8 统计学方法 采用SPSS 26.0统计学软件进行分析,数据均采用均数±标准误表示,两样本均数的比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠一般情况与体重变化 造模前两组小鼠一般情况良好,活动自如,体重接近(P>0.05)。模型组给予HFD喂食2周后,体重增加较对照组更明显,尽管组间差异并无显著性(P>0.05)。经连续5 d过夜禁食与腹腔注射STZ或柠檬酸钠溶液后,两组小鼠体重均迅速减轻。对照组小鼠在后续4周中体重逐渐恢复,而模型组小鼠体重则持续降低,造模结束时甚至低于对照组(P<0.05,图1)。
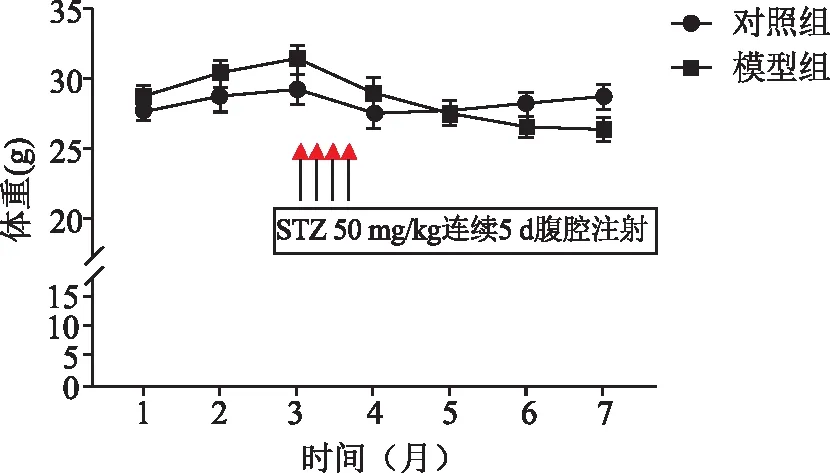
图1 小鼠体重变化(均数±标准误,n=8只/组)
2.2 小鼠主要脏器重量比较 造模结束后,小鼠腹腔麻醉、摘眼球取血,分离肝脏、心脏及肾脏并称重。与对照组相比,模型组小鼠肝脏重量显著增加(P<0.05),肝脏指数增加(P<0.01),而心脏、肾脏重量则无明显改变(P>0.05,图2)。

图2 小鼠主要脏器质量比较(均数±标准误,n=8只/组)
2.3 主要脏器组织病理染色 H&E染色结果显示,正常对照小鼠肝脏小叶结构完整,肝细胞大小、形态正常;模型组小鼠肝细胞内出现脂肪空泡与气球样改变,部分细胞核溶解消失,小叶结构破坏,并伴有炎症细胞浸润增加。同时,模型组小鼠心肌纤维排列紊乱、血管周围单核细胞增多;肾小球周围炎症细胞聚集增多(图3)。
2.4 血糖与肝肾功能检测 如图4所示,与对照组比较,模型组小鼠血浆葡萄糖水平明显升高(P<0.001),谷丙转氨酶与谷草转氨酶水平显著增加(P<0.001),肾损伤指标胱抑素C水平增加(P<0.05),尽管尿素氮与血肌酐含量组间无明显差异(P>0.05)。
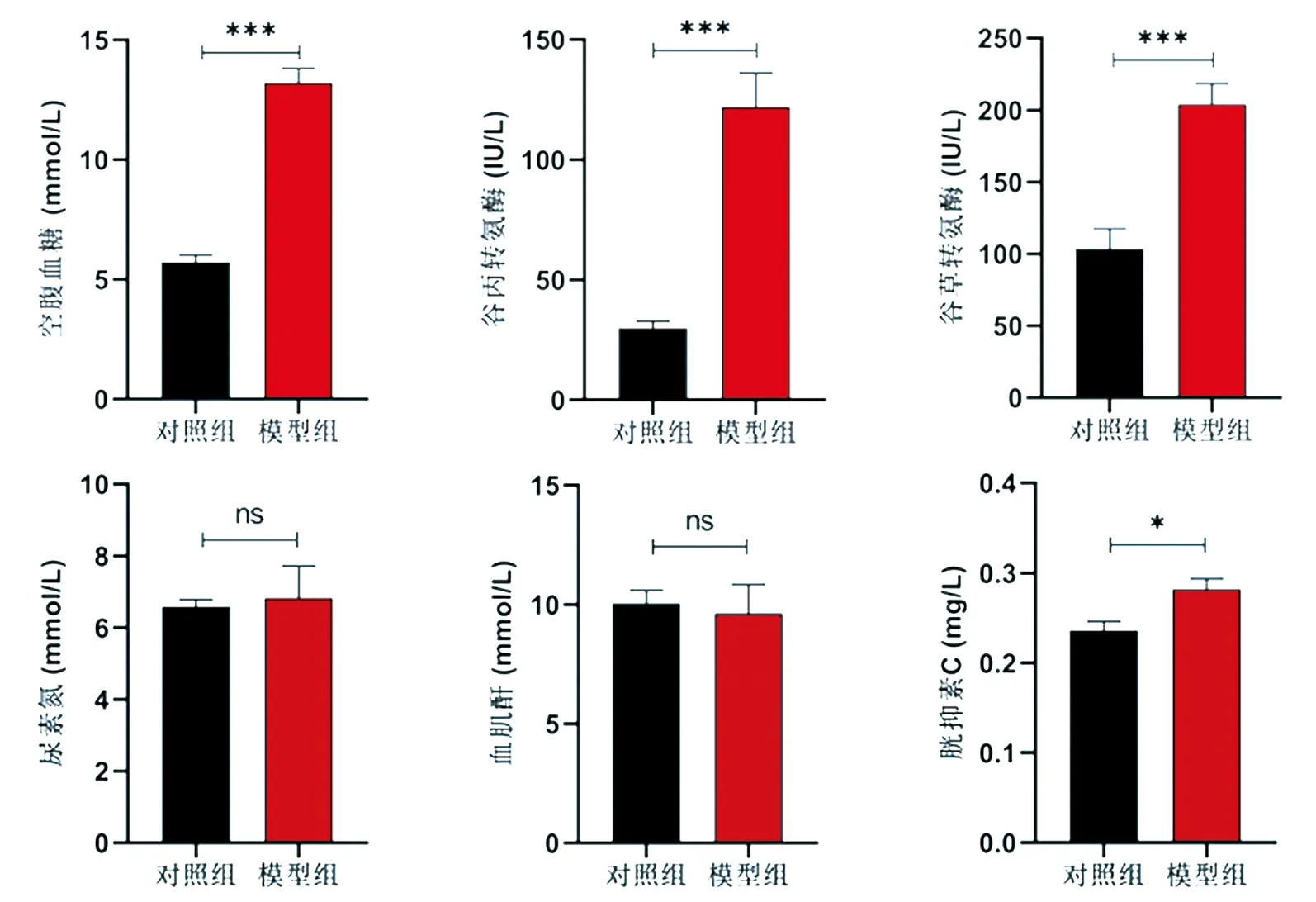
图4 小鼠肝肾功能指标检测
2.5 血脂谱水平 与对照组比较,模型组小鼠血浆总胆固醇、三酰甘油、高密度脂蛋白胆固醇与低密度脂蛋白胆固醇水平均显著升高(P<0.01或P<0.001),见图5。
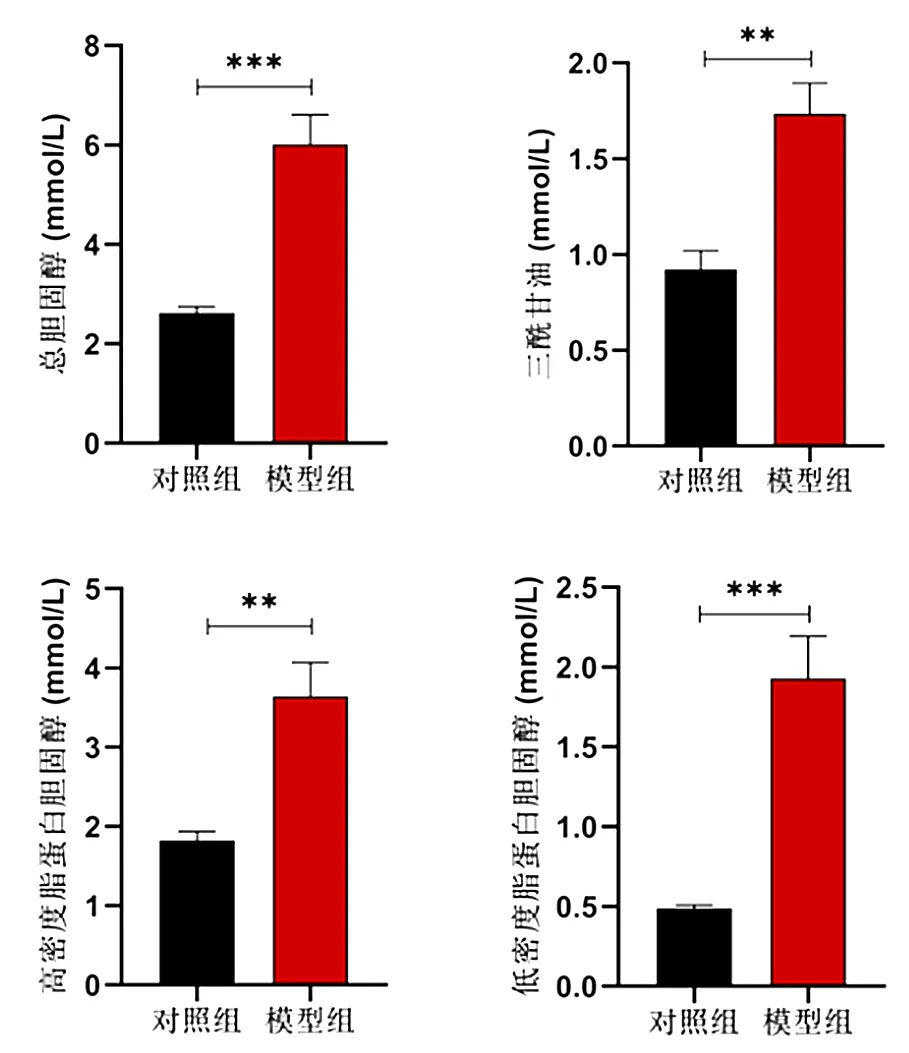
图5 血脂谱水平
2.6 肝脏油红O染色与脂质含量 油红O染色结果显示,正常对照小鼠肝脏内脂滴非常细小,模型组小鼠肝细胞内脂滴明显、蓄积增多,肝内总胆固醇与甘油三酯含量明显增加(P<0.05或P<0.01,图6)。
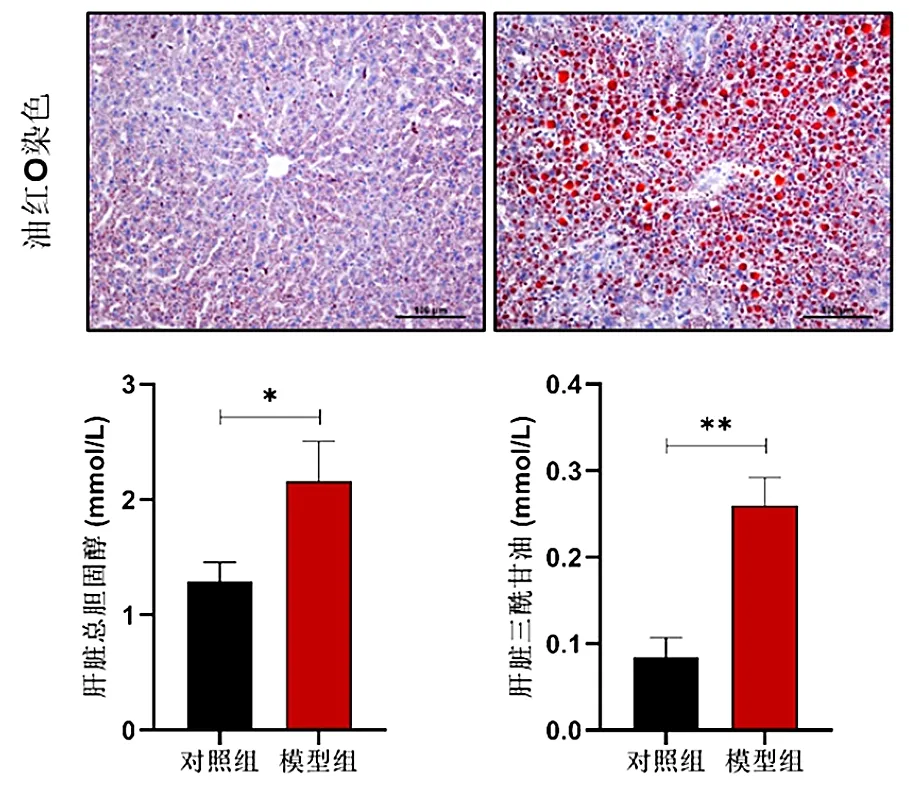
图6 肝脏油红O染色(×100)与肝内脂质含量
3 讨论
随着现代生活方式和饮食习惯的改变,NAFLD的发病率与患病人数正在不断增加,已成为最常见的慢性肝病之一,全球约有1/4的人群患有NAFLD[1,5]。我国NAFLD患病率更是高达29.2%,其中肥胖、T2DM及胰岛素抵抗与NAFLD的流行密切相关[6]。T2DM患者合并NAFLD的情况非常普遍。据统计,全球约有55.5%的T2DM患者合并有NAFLD,37.3%的患者进展为NASH,17.0%的患者出现晚期肝纤维化[3]。T2DM患者出现严重肝脏相关疾病或死亡的风险较非糖尿病患者升高2.25倍(95%CI:1.83~2.76)[7]。现常采用的糖尿病或NAFLD动物模型,为阐明T2DM及相关脂肪肝病发病机制与药物研发做出了巨大贡献[8,9]。然而,不同的疾病模型其发病机制与病理表现存在较大差异,并不能完全模拟和反映T2DM患者中NAFLD的疾病进展与病理机制[4,10]。
目前,糖尿病常见造模方法包括基因缺陷动物、高脂饮食和化学药物诱导等[11]。前者常见有ob/ob小鼠、db/db小鼠、Zucker大鼠、SHR/N-cp大鼠及JCR:LA-cp大鼠等[10]。这些啮齿类动物模型均是由于瘦素或瘦素受体缺陷而导致摄食过多,最终发展为肥胖,出现类似T2DM样表现[10]。这实际上与人类T2DM发病机制存在很大差异,因为在肥胖和T2DM患者中通常并不缺乏瘦素,甚至存在“瘦素抵抗”现象[12,13]。此外,基因缺陷小鼠价格昂贵、实验成本较高,这也极大限制了其在科学研究中的应用。高脂饮食能够诱导胰岛素抵抗与外周高胰岛素血症,以及糖尿病心肌病等发生,已被广泛用于糖尿病动物造模[9,14]。然而,高脂饮食造模周期较长,通常达3~4个月以上,且目前研究报道中所使用的高脂饲料配比,尤其是脂肪和糖水化合物含量,以及造模周期、小鼠品系及周龄等差异较大,缺乏规范性与可比性[4,15]。相比之下,化学药物诱导,如STZ、四氧嘧啶及糖皮质激素等,因其经济性、操作方便和快速出模而被广泛使用[11]。其中STZ与四氧嘧啶主要通过短期大量破坏胰岛β细胞,导致胰岛素分泌绝对不足,是1型糖尿病造模的经典模型。也有国内学者采用地塞米松腹腔注射联合高脂乳剂灌胃5 d快速诱导BALB/c小鼠发生肝脂肪变性[16]。然而,这种方式实际类似于临床上库欣综合征或长期使用激素引起的脂肪肝患者,与大多数NAFLD患者发病机制存在较大差异。此外,T2DM与NAFLD均属于增龄性疾病,老年人群中的发病率显著增加[6,17]。然而,现有糖尿病或脂肪肝动物实验很少在老龄鼠中开展。
本研究利用老龄C57BL/6J小鼠,通过高脂饮食喂养6周联合低剂量STZ连续腹腔注射5 d,成功建立了T2DM相关脂肪肝老龄小鼠模型。模型组小鼠肝脏重量与肝脏指数明显增加,肝细胞内出现脂肪空泡与气球样改变,小叶结构破坏,并伴有炎症细胞浸润增加;心肌组织与肾皮质亦出现相应病理改变。同时,血浆中谷丙转氨酶、谷草转氨酶及胱抑素C水平显著升高,提示肝肾功能损伤发生,符合T2DM合并NAFLD的病理特征。此外,模型组小鼠血浆中葡萄糖、血脂系列均显著升高,肝脏油红O染色显示脂滴大量蓄积,肝内总胆固醇与三酰甘油含量增加,均证实NAFLD与肝脂肪变性发生。
综上所述,本研究通过高脂饮食喂养联合STZ造模,快速有效地建立起T2DM合并NAFLD的老龄小鼠模型,从而较好地模拟临床T2DM患者发生脂肪肝的病理过程。该造模方法稳定可靠、可行性强,且操作简单、周期较短,为今后相关发病机制研究与治疗药物研发提供了理想的实验动物模型。
