加入尿激酶的改良血栓弹力图用于脓毒症纤溶状态评价
2023-09-28雷泽恺白劲松唐宁华中科技大学同济医学院附属同济医院检验科武汉430030成都市新都区中医医院检验科成都60500
雷泽恺,白劲松,唐宁(.华中科技大学同济医学院附属同济医院检验科,武汉430030;.成都市新都区中医医院检验科,成都60500)
脓毒症患者常出现以低纤溶状态为主要特征的凝血异常[1]。轻度低纤溶有助于将感染灶局限在局部[1]。然而,系统性的、过度的低纤溶状态也可能导致严重的凝血障碍,如脓毒症所致凝血病(sepsis-induced coagulopathy,SIC)或弥漫性血管内凝血(disseminated intravascular coagulation,DIC),进而影响患者预后[2]。及时准确地评估脓毒症患者的纤溶状态,有助于指导临床治疗方案,改善患者结局。目前用于评价纤溶状态的常规临床指标包括D-二聚体(D-Dimer,DD)、纤溶酶-纤溶酶抑制物复合体(plasmin antiplasmin complex,PIC)及血栓弹力图(Thromboelastogram,TEG)参数[1]。DD为凝血激活和继发纤溶亢进的共同标志物,其变化不能特异反映纤溶状态;PIC是评价纤溶亢进的特异性指标,但其评估纤溶抑制的可靠性还需进一步验证;TEG通过持续检测37 ℃下全血标本的凝血全过程,可以动态观察反映内源凝血因子、纤维蛋白原、血小板及纤溶因子水平的一系列参数,快速评估凝血状态[2]。
血凝块最大振幅MA值后的30 min振幅占MA值的百分比LY30,反映了血凝块的溶解程度,健康人LY30参考区间为0%~7.5%。常规TEG对纤溶状态变化的敏感性较低,难以区分正常和低纤溶状态[3-4]。尿激酶(urokinase,UK)可激活纤溶酶原生成纤溶酶,促进纤维蛋白凝块溶解。向TEG试剂中加入UK,可获得正常样本更高的LY30值,提高TEG发现低纤溶的敏感性。既往研究采用加入UK的改良TEG(UK-TEG)评估脓毒症患者,发现UK-TEG的LY30与细胞损伤指标(乳酸、乳酸脱氢酶和胆红素)及患者死亡率相关[4]。本研究拟应用UK-TEG识别SIC和DIC,并与DD、PIC等纤溶指标比较,评估其在脓毒症中的临床应用价值。
1 对象与方法
1.1研究对象 连续纳入2022年3月至6月入住同济医院重症医学科、符合sepsis 3.0定义[5]的临床诊断为脓毒症患者。根据国际血栓与止血学会(ISTH)推荐的评分系统(表1)[6-7],将纳入的脓毒症患者分为非脓毒症诱导凝血病(非SIC)组、SIC组和DIC组。SIC评分包含了序贯器官衰竭评估(SOFA),用于描述多器官功能损害程度[8]。排除标准包括:合并可显著影响纤溶功能的疾病或创伤史;已应用溶栓或抗纤溶药物;入院24 h内死亡或出院。另选择体检健康者作为健康人对照组。最终纳入脓毒症患者77例,分为非SIC组27例、SIC组21例、DIC组29例;健康人对照组40例。本研究经同济医学院伦理委员会批准(批准文号:2022伦审字S025号)。
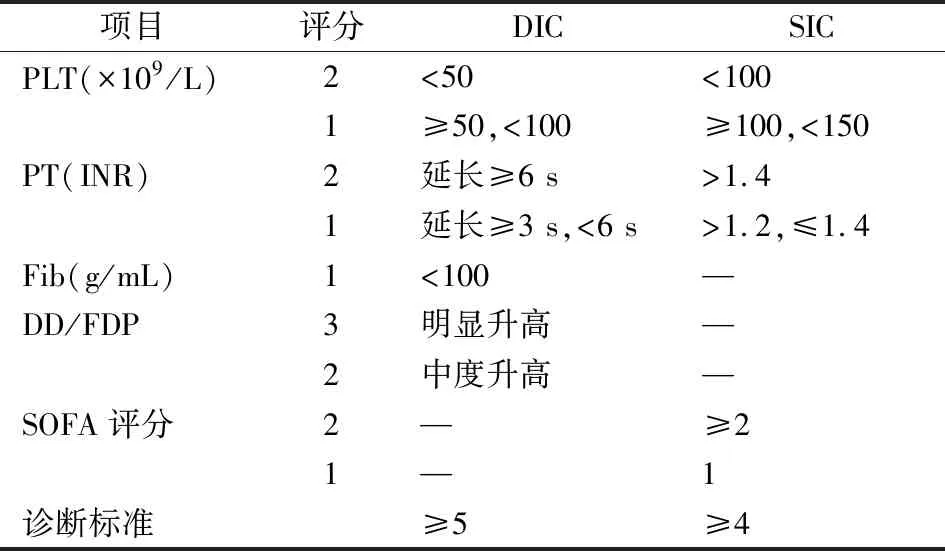
表1 ISTH推荐的SIC与DIC评分系统
1.2标本采集与处理 收集入组研究对象及体检健康者入院24 h内的枸橼酸钠抗凝全血3.0 mL,用于UK-TEG检测。UK-TEG检测后的剩余全血2 000×g离心10 min,收集血浆检测DD、PIC等纤溶指标及凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(Fib)、血小板计数(PLT)等常规凝血指标,用于DIC和SIC评分。
1.3主要仪器与试剂 UK-TEG检测采用TEG5000分析仪(美国血液技术公司)及配套试剂,加入注射用UK(南大药业公司);DD及凝血常规指标检测采用STA-R MAX血凝仪(法国STAGO公司)及配套试剂;PIC检测采用HISCL5000化学发光仪(日本SYSMEX公司)及配套试剂。所有试剂均按照说明书要求配置、分装和保存。
1.4UK-TEG检测 用5 mL生理盐水溶解注射用尿激酶,制备1×105U尿激酶储备液,取4 μL尿激酶储备液加入TEG高岭土试剂管中,再加入1 mL待测,全血混匀,最终尿激酶浓度为80 U/mL。然后从试剂管中吸取340 μL标本加入TEG反应杯,再加入20 μL氯化钙,最后按照高岭土TEG操作流程,在TEG5000分析仪上完成检测。
1.5UK-TEG性能评价 (1)批内精密度:选取健康人和脓毒症患者血浆各10份,混合后每水平检测10次UK-TEG。(2)批间精密度:选取正常和异常TEG质控品各1份,连续10 d检测UK-TEG。(3)参考区间:选取40份健康人样本检测UK-TEG,以中位数的95%置信区间确定LY30参考区间上下限。

2 结果
2.1UK-TEG LY30的95%参考区间 基于40例健康人初步建立的UK-TEG LY30的参考区间为36.8%~85.9%。
2.2UK-TEG LY30检测的重复性 UK-TEG LY30的两水平批内及批间不精密度见表2,均低于本室LY30参数的允许不精密度15%。

表2 UK-TEG LY30的不精密度评价结果
2.3脓毒症患者与健康人对照者间基本信息及凝血参数比较 脓毒症患者28 d死亡率为24.7%(19/77),与健康人对照组相比年龄显著更高,而性别比差异无统计学意义(P>0.05)。3组及健康人对照组间各参数比较见表3。

表3 脓毒症患者与健康人对照者间基本信息及凝血参数比较
图1展示并比较了3组脓毒症患者组及健康人对照组间纤溶参数的结果,DIC组的UK-TEG LY30分别低于其他各组;DIC组的DD高于SIC组,而与非SIC组差异无统计学意义;脓毒症患者组PIC高于健康人对照组,但DIC、SIC与非SIC三组间差异均无统计学意义。
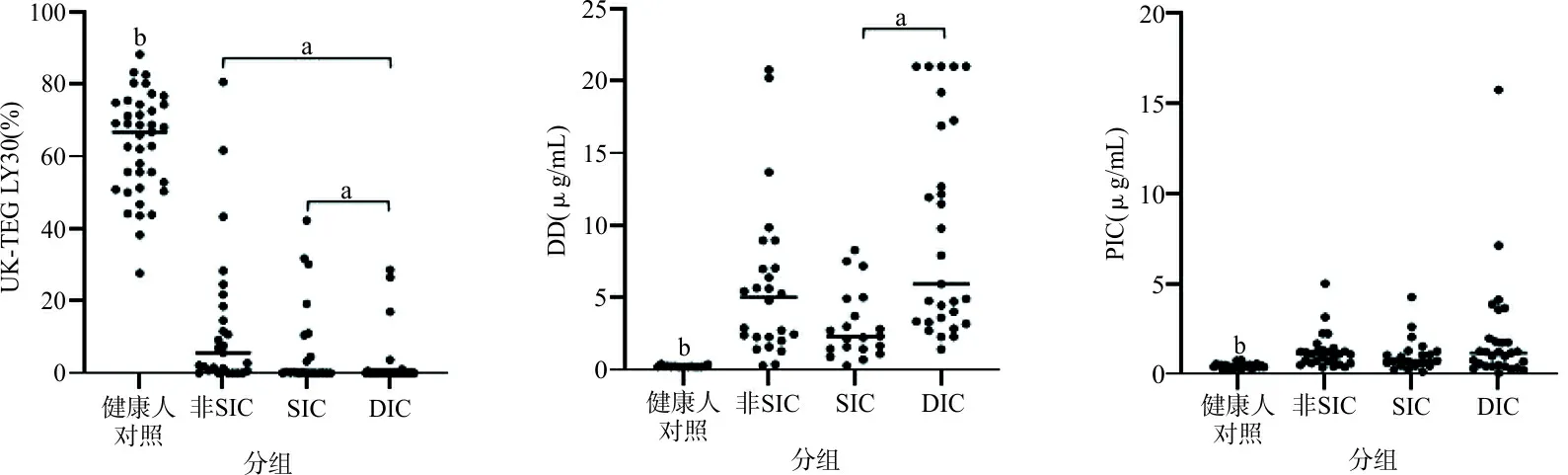
注:a,两组间比较,P<0.05;b,健康人对照组与其他各组比较差异均有统计学意义。
2.4UK-TEG LY30判断脓毒症的ROC曲线 根据ROC曲线,AUCROC为0.979(95%CI:0.952~1.000)。UK-TEG LY30判断脓毒症的最适阈值为43.5%,敏感性与特异性分别为96.6%和97.4%。
2.5纤溶参数与患者死亡的相关性 77例脓毒症患者中19例在入院28 d内死亡,利用多元Logistic回归分析各纤溶参数与患者死亡的相关性(见表4),纤溶参数异常分别定义为UK-TEG LY30=0%和PIC超出生物参考区间上限(0.8 μg/mL),由于几乎所有脓毒症患者DD均超出生物参考区间上限,未对DD给予赋值分类。结果这些参数中仅“UK-TEG LY30=0%”与脓毒症患者死亡独立相关。

表4 各参数与脓毒症患者死亡的相关性
3 讨论
由于组织因子在炎症细胞表面高表达、内皮细胞受损等,脓毒症患者存在凝血激活和纤溶抑制状态[9]。一方面,受损内皮细胞产生大量PAI-1;另一方面,凝血酶也可升高TAFI水平。这种纤溶抑制趋势可能有助于限制病原体局部扩散,但过度或持续的纤溶抑制也可导致微循环障碍、组织氧合能力下降等[2]。研究表明PAI-1和TAFI与脓毒症患者死亡风险相关,抗凝治疗可能有益。但是这些特异性生物学标志物检测需专门设备和试剂,临床应用受限。目前尚缺乏能反映纤溶抑制的常规指标。
DD作为凝血激活和继发纤溶亢进的标志物,其水平不仅与凝血酶和纤维蛋白生成相关,还受PAI-1抑制,因此反映纤溶抑制的特异性有限[10]。PIC和TEG的LY30指标虽可反映纤溶亢进,但难以识别纤溶抑制。基于前人研究[4],本研究建立了加入UK的改良TEG,提高LY30检出纤溶抑制的敏感性,并比较其与DD、PIC等在识别脓毒症凝血异常和预测预后方面的应用价值。结果显示,UK-TEG LY30=0%是这些纤溶指标中唯一与28 d死亡独立相关的一项。这与前期研究结果一致[4]。
ISTH推荐SIC评分可早期识别脓毒症凝血异常,SIC患者抗凝治疗往往获益[8,11-12]。本研究中,DIC组DD水平高于SIC组,可能误认为DIC患者继发纤溶亢进更显著,导致错误治疗。而DIC组UK-TEG LY30显著低于其他两组,准确反映DIC患者纤溶抑制更严重。SIC组LY30也较非SIC组降低,提示脓毒症发展过程中纤溶抑制持续加重。基于UK-TEG LY30的识别能力,未来可开展针对其结果给予抗凝干预的临床试验,探讨是否可改善预后。除预测效力优于其他指标,UK-TEG的优势还在于:TEG已广泛应用于临床,UK-TEG可快速床旁检测;UK易获得且廉价。本研究局限包括:样本量有限,需扩大样本量验证;UK-TEG检测步骤有待标准化;未全面评估临床结局的所有影响因素。
总之,本研究建立适用于中国人群的改良TEG评估脓毒症纤溶状态的方法,证实UK-TEG LY30识别凝血异常和预测死亡风险的能力,为后续干预研究奠定基础。
