传染性脾肾坏死病毒灭活疫苗对鳜肠道微生物的影响研究
2023-09-27何润真朱凝瑜梁倩蓉郑晓叶陈小明姚高华丁雪燕
何润真,朱凝瑜,梁倩蓉,郑晓叶,陈小明,姚高华,丁雪燕
( 浙江省水产技术推广总站,浙江 杭州 310023 )
鳜(Sinipercachuatsi)是我国具有重要经济价值的优质淡水品种,有“淡水石斑”之美称。随着鳜养殖规模的扩大和养殖密度的提高,鳜养殖中的疾病增多,其中病毒病由于传播快、发病率高、死亡率高、无特效药等特点危害最大。传染性脾肾坏死病毒病是自1994年以来在鳜养殖中暴发的一种流行性疾病,病原是一种双链DNA病毒,直径约150 nm,主要感染鳜的脾脏和肾脏[1-2]。感染该病的鳜主要临床症状包括:头、下颌、鳃盖、鳍条基部、体表等有点状或片状出血,鳃贫血,肝脏有出血点,脾脏和肾脏肿大,肠道内有黄色液体等[2]。病毒可以在鳜体内长期潜伏,发病10 d内致死率高达90%以上[3]。因此,有必要对其开展深入研究,探索该病的防治方法。
疫苗是预防和控制鱼类病毒性疾病最为有效的方式,目前主要有灭活疫苗、重组亚单位疫苗和DNA疫苗3种病毒疫苗,其中灭活疫苗因为安全性高、免疫效果稳定、制备方式成熟等优点是当前研发重点。Dong等[4]建立病毒敏感的鳜仔鱼细胞系,研制出传染性脾肾坏死病毒灭活疫苗在实验室和大塘两种环境下,疫苗对鳜的免疫保护率均超过90%。Fu等[5]用鳜脑细胞敏感细胞系制备的病毒灭活疫苗也获得了较好的免疫保护效果。此外,潘厚军等[6]采用感染传染性脾肾坏死病毒的鳜病变组织制备的匀浆疫苗也获得了较强的免疫保护效果。
已有的研究表明,肠道微生物群落通过参与物质代谢、营养吸收、免疫应答和疾病防御来维持宿主的健康[7-8]。肠道微生物的组成与丰度受到养殖环境[9]、水质[10]、饲料[11]、性别[12]、生长阶段[13]和病原感染[14]的影响。正常生理状态下,肠道微生物可以通过脂多糖、脂蛋白和代谢产物等特定组分调控宿主的免疫反应,促进免疫系统发育[15]。肠道微生物可以刺激杯状细胞分泌黏蛋白,维持肠道黏液层的完整[16-17]。在哺乳动物中发现肠道菌群可以通过树突状细胞刺激肠道黏膜相关淋巴组织的发育成熟[18-19]。部分肠道细菌被证实直接调控宿主的免疫反应,如分节丝状菌能够诱导Th17细胞分化[20],脆弱拟杆菌产生的多糖A能刺激Treg细胞分化[21],梭状芽孢杆菌Ⅳ簇和Ⅺ Ⅴa簇能诱导T细胞分化为Treg细胞[22]。大量的研究表明,肠道微生物在调节免疫方面发挥了重要的作用,但目前对水产用疫苗免疫引起的宿主肠道微生物的变化方面的研究较少。笔者拟通过宏基因组高通量测序技术探究传染性脾肾坏死病毒灭活疫苗免疫后鳜肠道微生物的结构变化和功能基因筛选,旨在揭示疫苗对肠道微生物的影响机制。
1 材料与方法
1.1 试验材料
试验用鳜来自浙江嘉善县新源水产种业养殖场,体质量(20±1.8) g,共800尾。养殖水温(25±2) ℃,pH 8.0,溶解氧(6±1) mg/L。日投喂2次,饲料为普通商业饲料。将鳜暂养14 d后,随机选取10尾用于细菌和病毒检测,确保鱼体健康无病。免疫试验用传染性脾肾坏死病毒灭活疫苗为中山大学何建国教授研究团队馈赠。
1.2 免疫试验
将鱼均分为对照组和免疫组2组,每组50尾,在免疫前1 d暂停饲料投喂。疫苗使用前混合均匀,免疫组鳜进行腹腔注射免疫,0.1 mL/尾;对照组注射等体积无菌生理盐水。对照组和免疫组放入同一池塘中养殖,池塘中间用纱网隔开确保将2组鱼分隔开。试验过程中每日投喂2次,并根据天气情况进行适当调整。
1.3 肠道微生物基因组DNA提取
在免疫后28 d取对照组和免疫组鳜各10尾收集肠道粪便样本,将每组样本分别混合,液氮冷冻后-80 ℃保存备用。按照QIAamp Fast DNA Stool Mini Kit(德国)的使用说明提取粪便样品中的微生物基因组DNA,提取的DNA用微量分光光度计检测DNA纯度,并通过0.8%琼脂糖凝胶电泳检测DNA片段的完整性。
1.4 文库构建及高通量测序
采用Illumina试剂盒进行双末端文库构建,文库质检合格后用NovaSeq 6000 PE150进行高通量测序分析。将测序得到的原始数据经过预处理后进行组装得到重叠群,利用MetaGeneMark对各个样本及混合组装的重叠群(≥500 bp)进行编码区预测,并且根据预测结果将编码区长度小于100 nt的序列进行过滤。随后根据编码区预测结果,利用CD-HIT软件进行去冗余,获得非冗余的基因,同时以95%一致性、90%覆盖度进行聚类,并选取最长的序列为代表性序列;利用Bowtie2将各样本的有效数据比对到基因序列上,计算各个基因在各样品中比对上的读长数目;过滤掉在所有样品中比对上读长数目≤2的基因,获得最终用于后续分析的序列。根据比对上的读长数目及各个基因长度,计算各基因在每个样品中的丰度信息,计算公式如下:
式中,Gk是某个基因在样本中的TPM(Transcripts Per Million)值,k代表某个基因,n是检测到有读长覆盖的基因数目,r为比对上基因的读长数目,L为基因的长度。
利用DIAMOND软件将序列与NR_meta库进行比对(BLASTP,e≤10-5);比对后对每个Unigene的比对结果,选取比对指标最好的比对结果进行物种分类。结合美国国家生物技术信息中心的物种分类系统可以得到不同分类学水平的具体物种注释信息。将物种分类信息与Unigene的丰度信息结合,可以得到各个分类等级的丰度信息,某个分类等级的丰度等于注释到该分类等级的Unigene丰度的加和。经过种水平注释信息统计,计算Alpha多样性、Beta多样性。将序列在物种分类、功能注释、基因水平上进行丰度统计及差异比较分析,并进行GO和KEGG数据库富集分析。该部分主要由杭州联川生物技术股份有限公司完成。
2 结果与分析
2.1 鳜肠道微生物Alpha多样性分析
对测序获得的序列进行组装后共获得8133条重叠群,其中:对照组有7166条重叠群,总长度为6 775 657 bp,N50为973 bp;免疫组有967条重叠群,总长度为756 549 bp,N50为753 bp。对样本的重叠群(≥500 bp)进行编码区预测,过滤掉小于100 nt的序列,去除冗余序列,最终获得有效的序列。以95%一致性、90%覆盖度进行聚类分析,2组样本共获得9669条序列,平均长度为543 bp,其中对照组有8736条序列、免疫组有933条序列,2组样本共有序列为933条(图1)。Alpha多样性分析结果表明,Chao1指数在对照组中更高,Goods_coverage指数免疫组和对照组相同,香农指数和辛普森指数在免疫组中更高,这些结果表明,免疫组中微生物的多样性和丰富度更高(图2)。
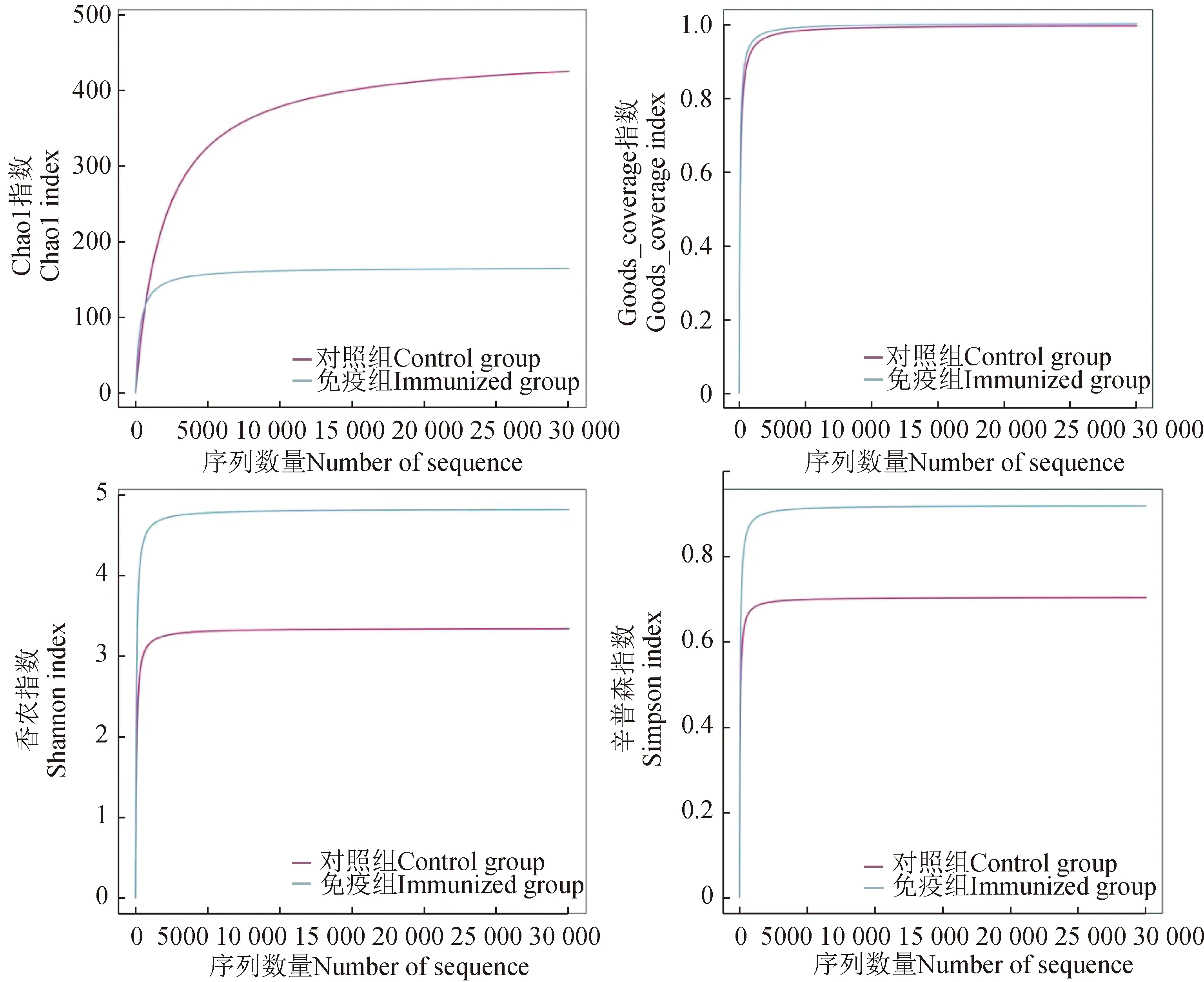
图2 肠道微生物Alpha多样性分析Fig.2 Alpha diversity analysis of intestinal microflora
2.2 鳜肠道微生物组成结构分析
物种丰富分析结果显示,在门水平上共鉴定出37个门。其中:对照组肠道微生物以变形菌门和厚壁菌门为优势菌门,相对丰度分别为72.23%和1.99%;免疫组肠道微生物以变形菌门、衣原体门、厚壁菌门、放线菌门和蓝细菌为优势菌门,相对丰度分别为28.57%、11.13%、6.38%、3.13%和1.00%(图3)。

图3 肠道菌群组成结构分析Fig.3 The composition of intestinal bacterial community
在属水平上对照组肠道微生物以气单胞菌属(Aeromonas)、梭菌属(Clostridium)、伯克霍尔德氏菌属(Paraburkholderia)和衣原体属(Chlamydia)为主要优势属,其中气单胞菌属相对丰度最高达71.73%;免疫组肠道微生物以衣原体属、埃希氏杆菌属(Escherichia)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)和肠球菌属(Enterococcus)为主要优势属,相对丰度分别为11.57%、8.70%、6.18%、5.48%、5.14%和3.53%(图3)。
在种水平上对照组肠道微生物主要包括维氏气单胞菌(A.veronii)和嗜水气单胞菌(A.hydrophila),相对丰度分别为51.67%和1.73%;免疫组肠道微生物主要包括沙眼衣原体(C.trachomatis)、大肠杆菌(E.coli)、鲍曼不动杆菌(A.baumannii)、粪肠球菌(E.faecium)、绿脓假单胞菌(P.aeruginosa)和肺炎克雷伯氏菌(K.pneumoniae),相对丰度分别为9.05%、8.91%、4.70%、3.61%、3.39%和3.20%(图3)。
2.3 差异基因功能注释分析
免疫组与对照组相比,共筛选出9656个差异丰度基因,其中有840个基因高丰度,8816个基因低丰度。GO富集分析结果显示,差异基因在生物学过程、细胞组分和分子功能上均有富集,其中:生物学过程主要包括DNA的转录调控、磷酸化信号传递系统、氧化还原过程、趋化性、蛋白水解作用等过程;细胞组分主要包括细胞溶质、质膜、细胞质和膜等组分;分子功能主要包括蛋白结合、DNA结合转录因子活性、核糖体的结构成分、ATP结合和DNA结合等功能(图4)。
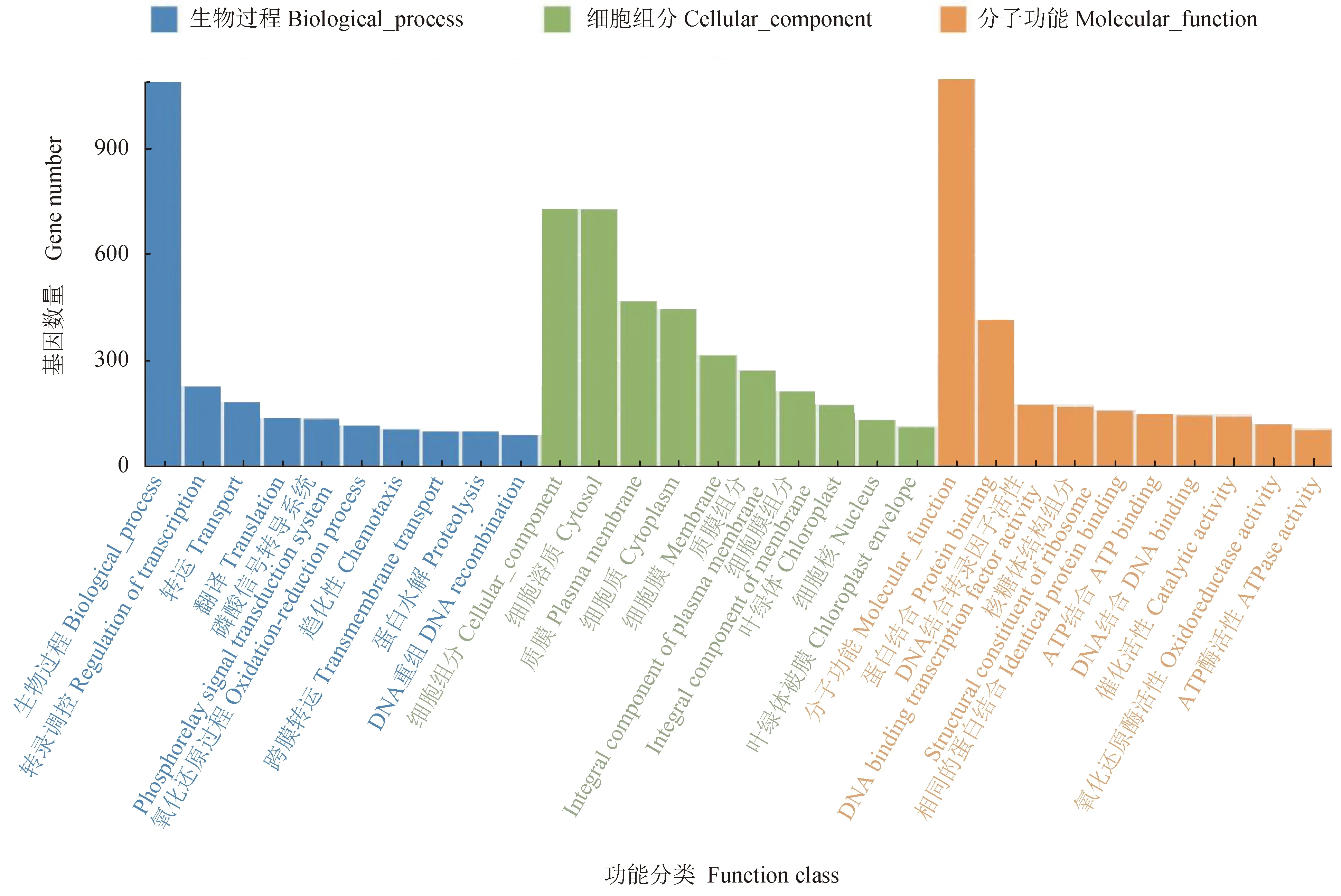
图4 差异基因GO富集分析Fig.4 GO enrichment analysis of differential genes
对差异基因进行KEGG富集分析,前20位的分析结果显示,差异基因主要富集在双组分系统、ABC转运子、嘌呤代谢、群体感应、细菌趋药性、鞭毛组装和细菌分泌系统等通路,通路中的绝大部分基因在免疫组中的丰度均低于对照组(表1)。

表1 注释到序列数目最多的20条KEGG通路
3 讨 论
3.1 疫苗接种对鳜肠道微生物组成的影响
由于水生动物所处的水体环境以及食性的不同,其肠道微生物的主要类群也各不相同。肠道中含有大量的微生物,近年来的研究表明,肠道微生物对宿主的生命活动有重要的影响,在宿主的消化吸收、抗逆性、免疫反应等方面均具有一定的作用[23-24]。肠道微生物可通过抑制病原微生物定殖,增强肠道免疫应答来保护机体免受感染与侵害[25]。
鱼类肠道中一般有变形菌门、厚壁菌门和拟杆菌门3门核心微生物。草食性的鱼类如草鱼(Ctenopharyngodonidellus)和团头鲂(Megalobramaamblycephala)肠道细菌主要来自变形菌门、梭杆菌门和厚壁菌门[26]。杂食性鱼类如鲢(Hypohthalmichthysmolitrix)、鳙(Aristichthysnobilis)肠道细菌主要来自变形菌门和厚壁菌门[27]。肉食性鱼类如鳜和翘嘴鲌(Culteralburnus)肠道微生物以盐单胞菌属(Halomonas)、梭杆菌属(Fusobacterium)等以产生蛋白酶为主要功能的微生物为优势肠道菌群[28]。虾肠道细菌主要来自厚壁菌门、放线菌门、梭杆菌门和变形菌门[29].三角帆蚌(Hyriopsiscumingii)肠道优势细菌来自厚壁菌门、放线菌门和变形菌门[30]。肠道微生物的组成为揭示不同类型微生物在宿主生命活动中的作用提供了重要的参考依据。
对健康和病变的圆口铜鱼(Coreiusguichenoti)的肠道微生物进行16S rRNA测序分析,发现病变鱼肠道细菌多样性低于健康鱼,且病变鱼中变形菌门丰度显著高于健康鱼,其中占比最高的气单胞菌属可能是造成疾病的关键病原[31]。采用16S rDNA测序技术分析海藻希瓦氏菌感染对半滑舌鳎肠道菌群结构的影响,结果发现,健康半滑舌鳎肠道微生物丰度及多样性均高于感染后[32]。本试验结果显示:对照组肠道微生物以变形菌门为优势菌门,相对丰度达到72.23%;免疫组肠道微生物以变形菌门、衣原体门、厚壁菌门、放线菌门和蓝细菌门为主。对照组微生物的种类更多,而免疫组中微生物的多样性和丰富度更高,这与之前的研究结果类似。张正等[33]在患腹水病和皮肤溃烂病半滑舌鳎(Cynoglossussemilaevis)、刘志刚等[34]在患链球菌病的尼罗罗非鱼(Oreochromisniloticus)的研究中也发现类似的结果。不同养殖环境的鱼类中肠道优势菌群不同,淡水鱼中主要以气单胞菌属、假单胞菌属和拟杆菌属(Bacteroides)为主要优势菌群[35]。本试验结果显示,疫苗免疫后鳜的优势菌群从对照组的气单胞菌属(71.73%)转变为免疫组的衣原体属(11.57%)、埃希氏杆菌属(8.7%)、不动杆菌属(6.18%)、假单胞菌属(5.48%)和肠球菌属(3.53%)。肠道微生物多样性的提高有助于出现拮抗特性的菌群,从而帮助鱼体应对病原菌的入侵,而抗生素的不当使用则会降低肠道微生物的多样性,促使病原体的定殖[36]。肠道微生物的多样性已被用作鱼类健康的生物标志物[37],大量研究发现,肠道微生物的多样化程度越高,对宿主的保护作用越大[38-39]。因此,本试验中传染性脾肾坏死病毒灭活疫苗免疫的鳜肠道微生物多样性增加,有利于减少感染致病性病原菌的风险。
3.2 疫苗接种对鳜肠道益生菌组成的影响
乳酸菌和芽孢杆菌是广泛使用的益生菌,它们通过调节肠道黏膜免疫、与共生菌群或潜在有害病原体相互作用、产生代谢产物(如短链脂肪酸和胆汁酸)、激活信号通路作用于宿主细胞来调节肠道微生态,这些机制有助于抑制和消除潜在病原体,改善肠道微环境,增强肠道屏障,减轻炎症,增强抗原特异性免疫应答[40-41]。Liu等[42]用枯草芽孢杆菌(Bacillussubtilis)E20饲喂点带石斑鱼(Epinepheluscoioides)4周后,其生长指标、固有免疫性能和疾病防御能力均有明显提高。Son等[43]研究发现,在石斑鱼的饲料中添加植物乳杆菌可显著提高石斑鱼的存活率、饲料转化率和平均体质量。Carnevali等[44]从成年金头鲷(Sparusaurata)中分离出的两株食果糖乳杆菌(Lactobacillusfructivorans)可显著提高金头鲷鱼苗的成活率。Bagheri等[45]研究发现,饲料中添加枯草芽孢杆菌可显著提高虹鳟(Onchorhynchusmykiss)幼苗的存活率。Zokaeifar等[46]研究发现,枯草芽孢杆菌投喂8周后的凡纳滨对虾(LitopenaeusVannamei)具有更强的抵抗哈维氏弧菌的能力。益生菌具有增加肠道皱襞面积和厚度,提高肠道消化酶活性、促进肠道内双歧杆菌(Bifidobacterium)或乳酸菌的生长的作用[47]。笔者发现,一些肠道益生菌如乳杆菌属、芽孢杆菌属和类芽孢杆菌属(Paenibacillus)的细菌在免疫组中均有显著上升。此外,免疫后的鳜肠道维氏气单胞菌和嗜水气单胞菌的数量明显减少,大肠杆菌和粪肠球菌等明显增加。维氏气单胞菌和嗜水气单胞菌是广泛存在于水体环境中的条件致病菌,在鱼体免疫力降低或体表损伤时容易侵入鱼体导致其发病。免疫组鳜肠道维氏气单胞菌和嗜水气单胞菌数量的明显减少可能与鱼体接种疫苗后免疫力增强有关。
一些肠道微生物与T细胞分化有关,如克雷伯氏菌(Klebsiellasp.)的异常定殖可以诱导树突状细胞吞噬作用并释放促炎细胞因子白细胞介素-6、白细胞介素-12、肿瘤坏死因子,促进辅助性T淋巴细胞1的极化作用[48];脆弱拟杆菌(B.fragilis)是一种寄生于人体消化道的共生厌氧菌,它在肠道中定殖可预防小鼠肠道炎症性疾病[49]。笔者发现,克雷伯氏菌和脆弱拟杆菌在免疫组中均有显著增加,该变化可能有助于增强鱼体的炎症免疫应答。
4 结 论
已有的研究表明,肠道微生物在调节免疫方面发挥了重要的作用,笔者通过高通量测序技术发现,传染性脾肾坏死病毒灭活疫苗免疫后鳜肠道微生物的组成和功能基因出现明显变化,可引起致病菌维氏气单胞菌和嗜水气单胞菌比例的减少,同时引起乳酸菌属、芽孢杆菌属和类芽孢杆菌属等有益细菌比例增加,这为了解疫苗的作用机制提供了新的思路。此外,通过肠道微生物组成的改变有利于筛选出新的“疫生菌”,对于预防和控制疾病开辟新的治疗方案。
