鱼类铁调素生物学功能与体外表达的研究进展
2023-09-27李旭东孔祥会
颜 研,李旭东,裴 超,孔祥会
( 1.河南师范大学 水产学院,河南 新乡 453007; 2.河南省水产技术推广站,河南 郑州 450008 )
近年来,细菌性疾病频发,抗生素不规范使用导致细菌耐药性问题日益严重[1]。研发新的抗菌药物,替代抗生素是解决细菌耐药性问题的一个方向。抗菌肽是具有抗菌作用的小分子多肽,相比于抗生素,不易产生耐药性,可作为抗生素耐药细菌治疗的潜在药物[2-3]。其中鱼类铁调素(Hepcidin)具有广谱的抗菌活性,抗菌效果明显,已成为当前抗菌肽研究的热点。笔者对鱼类铁调素的分子结构、铁调控作用、抗菌、抗病毒和抗肿瘤功能,以及其在原核、真核及植物表达系统中体外表达的研究进行了综述,并对铁调素在食品、医药及水产领域中的应用现状及前景进行了总结与展望,以期为鱼类铁调素抗菌机制及在渔业上的应用提供参考和指导。
2002年,Shike等[4]第一次从杂交条纹鲈(Moronechrysops×M.saxatilis)鳃中分离出铁调素,它与人类和其他物种的铁调素序列同源,并研究发现细菌感染可诱导Hepcidin基因的表达。随后,国内外学者从团头鲂(Megalobramaamblycephala)[5]、尼罗罗非鱼(Oreochromisniloticus)[6]、大弹涂鱼(Boleophthalmuspectinirostris)[7]、斑马鱼(Daniorerio)[8]、舌齿鲈(Dicentrarchuslabrax)[9]、点带石斑鱼(Epinepheluscoioides)[10]、大菱鲆(Scophthalmusmaximus)[11]、卵形鲳鲹(Trachinotusovatus)[12]、大黄鱼(Larimichthyscrocea)[13]和太平洋鳕(Gadusmacrocephalus)[14]等多种鱼类中分离和鉴定了Hepcidin基因,并进行了分子结构和功能的一系列研究。
1 鱼类铁调素的分子结构
鱼类铁调素属于肝脏表达抗菌肽LEAP家族,又称LEAP-1。Shike等[8]研究了铁调素在几种不同物种中的序列和分子结构,发现铁调素的基因组结构在硬骨鱼中高度保守,由2个内含子和3个外显子组成。外显子编码氨基酸序列分为3部分,包括信号肽、前体肽和成熟肽。第1个外显子编码信号肽和前体肽的一小部分,其他2个外显子编码剩余的前体肽和成熟肽。信号肽含有24个氨基酸,具有抗菌功能[15]。铁调素前体肽含有典型的RX(K/R)R序列,用于招募前肽转化酶形成由19~31个氨基酸组成的成熟肽,该成熟肽中第1个Cys残基之前的N-末端6个残基QSHLSL,对于铁调节活性至关重要[16]。成熟肽含有较多的碱性氨基酸,使得铁调素带正电荷,属于阳离子抗菌肽。从鱼类到哺乳动物的铁调素成熟肽序列进行比较分析,显示成熟肽中8个半胱氨酸残基具有高度保守性,这些半胱氨酸残基通常形成4个分子内二硫键,其中1个相邻的二硫键桥形成发卡结构,有助于铁调素折叠成亲水和疏水侧链,是铁调素发挥抗菌活性的关键结构[17]。在Hepcidin基因的上游区域,普遍具有TATA框结构及珠蛋白转录因子(GATA)、信号转导及转录激活因子(STAT)、CCAAT增强子结合蛋白α(C/EBPα)、CCAAT增强子结合蛋白β(C/EBPβ)、激活蛋白(AP)、核因子激活的B细胞的κ-轻链增强(NF-κB)和肝细胞核因子4(HNF4)等转录因子的结合位点,说明铁调素可能受这些转录因子的调节表达[9]。
大多数鱼类有2个或2个以上的同源Hepcidin基因,如斑马鱼、大菱鲆、黑点青鳉(Oryziasmelastigma)、点带石斑鱼、舌齿鲈和大弹涂鱼等均有2个基因变体,在尼罗罗非鱼中发现了3种类铁调素的抗菌肽,在大黄鱼基因组中发现了6种Hepcidin基因[6-11,13,18]。不同的基因亚型,在表达和功能上具有差异,如舌齿鲈1型Hepcidin基因主要发挥铁调节的作用,2型Hepcidins基因参与宿主的抗菌防御[9]。大弹涂鱼铁调素-2与铁调素-1相比具有更强的抗菌活性和更广的抗菌谱[19]。大黄鱼中6种铁调素亚型,虽然具有相似的分子特征,但每个亚型均具有独特的表达模式、转录调控和生物学功能[13]。
2 鱼类铁调素的表达调控
在病毒、细菌及其类似物刺激下,鱼体Hepcidin基因表达可快速上调,表明鱼类铁调素是一种急性期蛋白,参与类似于哺乳动物中的炎症反应[20-24]。鱼类Hepcidin基因的表达受到许多刺激的单独调节,感染/炎症、铁水平、贫血和缺氧等刺激均能引起Hepcidin基因表达变化[9, 25]。不同刺激诱导鱼类产生铁调素的细胞通路不同,如在炎症反应中,Hepcidin基因的表达通常是通过酪氨酸激酶/信号转导和转录激活因子途径介导的[26]。铁可通过参与骨形态发生蛋白/果蝇MAD相关蛋白通路对Hepcidin基因的表达进行调控[27]。贫血和缺氧分别通过抑制C/EBPα和STAT3与Hepcidin基因启动子结合,或抑制BMP/SMAD4依赖性信号传导,从而负调控Hepcidin基因的表达[28-29]。
环境污染物和高温的刺激也能够调节Hepcidin基因的表达。黑点青鳉在17α-乙炔基雌二醇(EE2)刺激后,17α-乙炔基雌二醇首先与雌激素受体α(ERα)结合,雌激素受体α识别并与Hepcidin基因启动子区域上新发现的调控元件雌激素反应元件结合,从而下调Hepcidin基因的表达[30]。大菱鲆皮肤中的Hepcidin基因表达水平较高,并且随着温度的升高而升高,在28 ℃时Hepcidin基因的表达量显著增加[31]。
这些研究结果表明,鱼类铁调素对多种病原和环境胁迫都有响应,这些刺激通过不同的分子途径来调节Hepcidin基因的表达,因此,铁调素在鱼类先天免疫反应中起着关键作用。
3 鱼类铁调素的生物学功能
3.1 鱼类铁调素抗菌功能
鱼类铁调素是一种铁稳态的调节剂,可以通过细胞铁转运蛋白的内化和降解,阻止肝细胞系中铁释放,并抑制细胞外细菌对铁的摄取与利用,从而抑制细菌的生长和繁殖[32]。网箱养殖中,饲粮中添加不同剂量的草鱼(Ctenopharyngoaonidellus)重组铁调素,能够控制体内铁的分布,从而防止细菌感染,具有保护作用[33]。
鱼类铁调素除了通过调节铁代谢以抑制细菌生长外,还具有直接杀伤细菌的作用。在体外,鱼类铁调素能破坏病原菌的细胞膜结构,显示其广泛的杀菌活性[15,17,34]。铁调素可通过非膜裂解机制进入到胞内干扰细菌的正常代谢[35]。舌齿鲈铁调素通过与某些细胞内靶点结合或与细菌膜结合而对鳗鲡弧菌的复制产生影响[36]。鱼类铁调素还能通过其N-末端的Cu2+和Ni2+结合性(ATCUN)基序,以促进细菌DNA水解[37]。研究显示,鱼类铁调素在体内具有抗菌活性。体内注射合成的大菱鲆铁调素,可以大大降低受感染鱼肾脏、脾脏和肝脏中的细菌数量[11]。
鱼类铁调素可以作为免疫调节剂,诱导细胞因子和趋化因子产生,从而调节和平衡病原引起的炎症反应。在创伤弧菌(Vibriovulnificus)感染斑马鱼后,转入鱼体的Hepcidin基因表达可诱导白介素10(IL-10)、白介素26(IL-26)、溶菌酶、Toll样受体4(TLR-4)和髓样分化因子88(Myd88)基因的表达,从而有效抑制细菌生长[38]。腹腔注射100 μg合成的中华乌塘鳢(Bostrychussinensis)铁调素成熟肽,不仅可以提高中华乌塘鳢肝脏中免疫相关基因的表达,还能提高中华乌塘鳢感染副溶血性弧菌(V.parahaemolyticus)的存活率[39]。
以上研究表明,铁调素功能主要有:(1)在免疫反应期间通过调节铁代谢,阻隔铁对细菌的供应,以限制病原菌生长;(2)利用其抗菌活性将病原体直接杀死;(3)利用与宿主免疫系统相互作用来调节宿主免疫。这三者共同作用,最终限制感染性病原菌的增殖和传播(图1)。
3.2 鱼类铁调素在铁代谢中的功能
鱼类铁调素在机体铁稳态调节、感染后降低宿主血铁含量、抵御入侵病原等方面发挥关键性作用。与哺乳动物类似,鱼类铁调素通过抑制膜铁转运蛋白1(FPN1)调节体内铁离子的动态平衡。在试验性铁超载情况下,斑马鱼肝脏中Hepcidin基因的表达显著增加[40]。Hepcidin mRNA水平增高后,可以使血清铁含量降低。大菱鲆肝脏中Hepcidin基因表达水平增加,可以降低FPN1基因的表达水平,表明铁调素在铁代谢中具有重要作用[41]。鳜(Sinipercachuatsi)注射硫酸亚铁后,肝脏中Hepcidin基因的表达显著增加,同时白介素1β(IL-1β)、白介素8(IL-8)、肿瘤坏死因子α(TNF-α)和Toll样受体22(TLR22)基因的表达增加,FPN1基因表达减少,表明铁调素除了参与铁平衡的调节,还在免疫系统中具有重要作用[42]。鱼类铁调素通过调节铁代谢,导致铁重新分布,降低血清铁水平,增加肝胰腺中的铁积累,并调节免疫基因的表达,从而保护鱼体免受病原菌的感染[33]。
3.3 鱼类铁调素抗病毒功能
鱼体感染传染性脾肾坏死病毒、神经坏死病毒和病毒性出血性败血症病毒后,宿主通过上调体内Hepcidin基因的表达,以抑制病毒感染[42-44]。尼罗罗非鱼铁调素1-5对神经坏死病毒和日本脑炎病毒具有抗病毒活性,还能够提高感染传染性胰腺坏死病毒的大鳞大马哈鱼(Oncorhynchustshawytscha)胚胎细胞的存活率[45-47]。鱼类铁调素对鳜鱼弹状病毒、大口黑鲈呼肠孤病毒和肿大细胞病毒也具有抗病毒活性[11,48]。铁调素还可显著抑制新加坡石斑鱼虹彩病毒和白斑综合征病毒的复制[10,13,18]。最近研究发现,包括冠状病毒在内的病毒,需要含铁酶参与才能完成其复制过程,通过操纵铁调节的关键因子铁调素,以限制铁的利用,已成为治疗病毒感染的一种辅助策略[49]。鱼类铁调素可作为病毒感染治疗的一种新型药物,这将拓展现有的抗病毒药物。鱼类铁调素的抗病毒活性及其作用机制见表1。
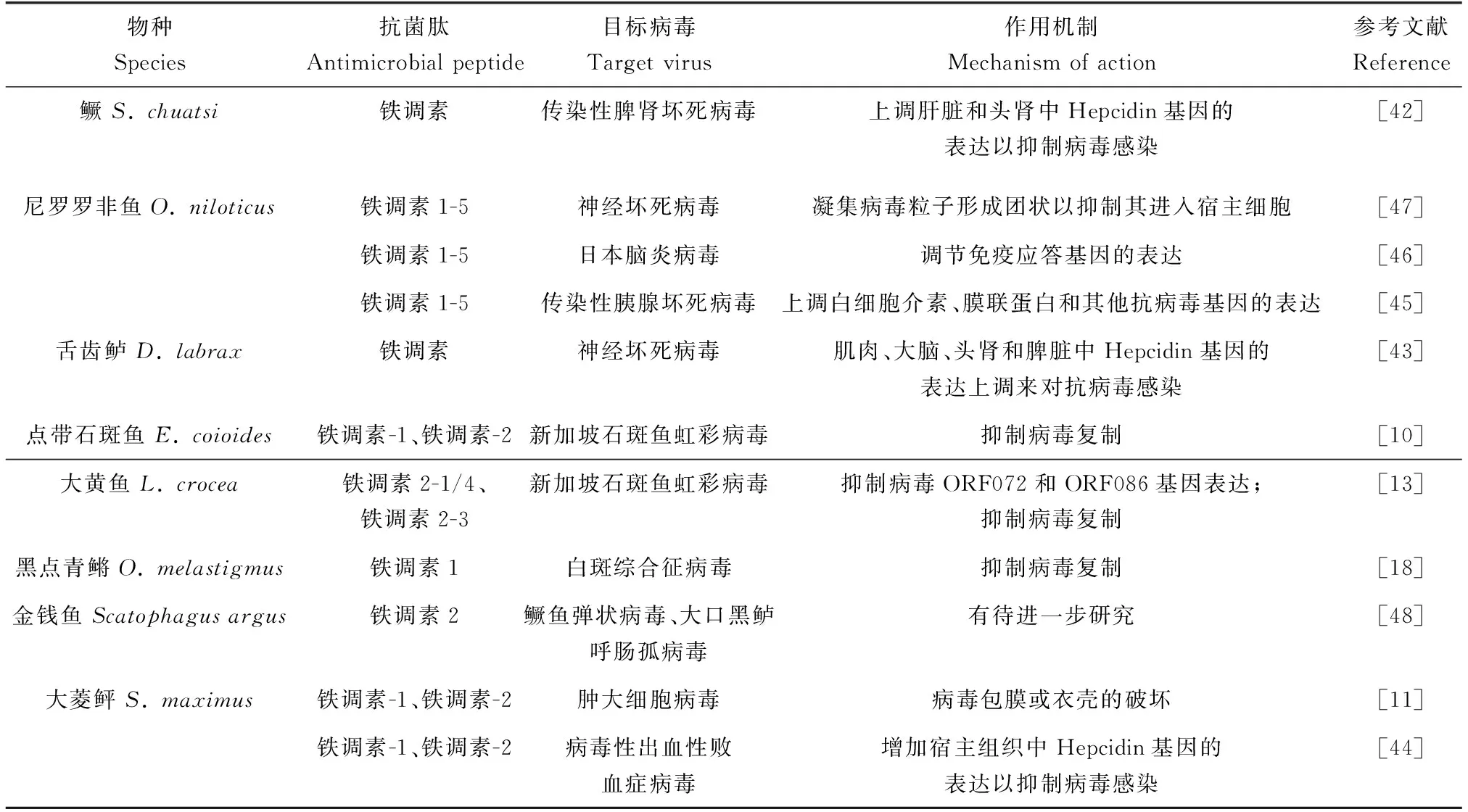
表1 鱼类铁调素抗病毒活性及作用机制
3.4 鱼类铁调素抗肿瘤功能
鱼类铁调素的抗肿瘤活性已有较多报道。在软琼脂试验中,尼罗罗非鱼铁调素有效抑制了人纤维肉瘤细胞、人宫颈癌细胞和人肝癌细胞的生长并减少了集落生成[50]。黑点青鳉铁调素对培养的人肝癌细胞也同样具有抗肿瘤活性,大约有40%的肿瘤细胞受到了明显抑制[18]。这些研究表明,鱼类铁调素对人类肿瘤细胞表现出较好的抑制活性,这为开发新型抗癌抗肿瘤药物指明了新途径。
3.5 鱼类铁调素抗寄生虫功能
卡氏锥虫(Trypanosomacarassii)、卵圆鞭毛虫(Amyloodiniumocellatum)、鱼虱(Argulussiamensis)和刺激隐核虫(Cryptocaryonirritans)通常黏附在鱼体表面,引起持续的炎症反应,诱导Hepcidin基因表达显著上调[22,51-53]。研究发现,重组大黄鱼铁调素可导致刺激隐核虫膜破裂和内容物泄漏[34]。以上研究表明,鱼类铁调素在抗寄生虫感染时发挥了重要作用。
4 鱼类Hepcidin基因的体外表达
4.1 原核表达系统
大肠杆菌(Escherichiacoli)原核表达系统可利用多种表达载体表达鱼类Hepcidin基因,如利用pGEX-KG载体,在16 ℃下,用1 mmol/L IPTG诱导,可表达黄颡鱼(Pelteobagrusfulvidraco)Hepcidin基因,并通过谷胱甘肽转移酶融合系统进行纯化,可获得较高纯度的铁调素,并证实铁调素可以通过铁调节有效地抵抗细菌感染[54]。利用pET系列载体,可原核表达黑点青鳉、南亚野鲮(Labeorohita)、泥鳅(Misgurnusanguillicaudatus)和大黄鱼重组铁调素,对主要鱼类病原体均显示有抗菌活性[18,22,34,55](表2)。
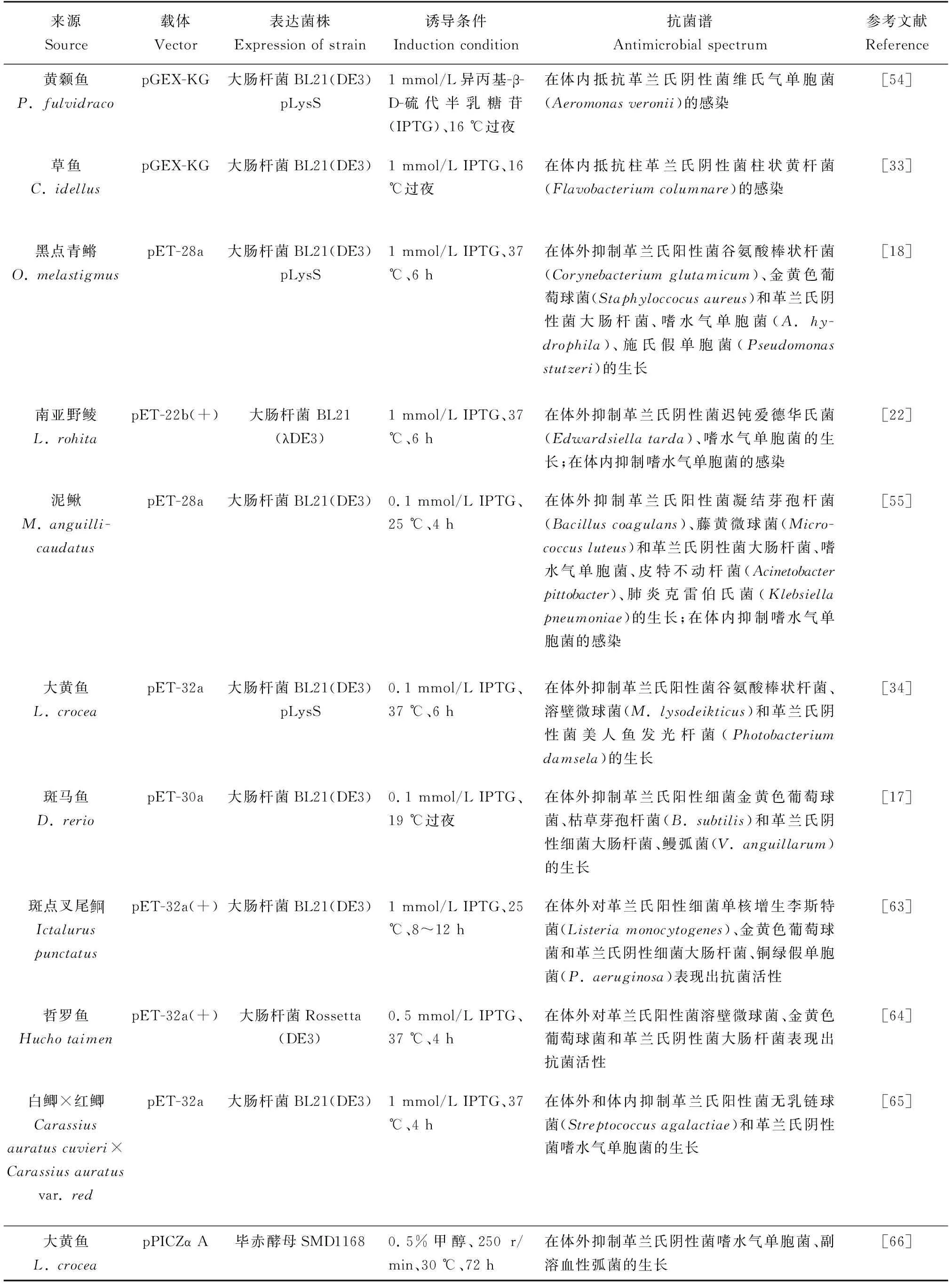
表2 鱼类铁调素的体外表达和抗菌谱
原核表达系统中,表达菌株为大肠杆菌,细菌中表达的蛋白不能进行转录和翻译后的修饰,包括糖基化、磷酸化和形成二硫键,但这些修饰有利于蛋白质的正确折叠和组装[56]。原核表达系统表达的铁调素由于不能够正确折叠,从而会导致其失去直接杀菌活性。因此,采用真核表达系统表达Hepcidin基因,或合成铁调素多肽,更易于研究铁调素的生物学功能。
4.2 真核表达系统
真核表达系统中,最常用的表达菌株为毕赤酵母(Pichiapastoris),由于它自身集合了原核表达系统和真核表达系统的诸多优点,成为当前真核表达系统中最为理想的一种宿主菌。鱼类铁调素含有4对二硫键,由于特殊的结构,难以正确折叠其构型。采用毕赤酵母真核表达系统更有利于二硫键桥的形成,更容易获得大量具有活性的铁调素[57]。毕赤酵母真核表达的松江鲈(Trachidermusfasciatus)铁调素,具有模式识别功能和对多种细菌的凝集活性[58]。为进行尼罗罗非鱼铁调素的大规模生产,将小体积重组毕赤酵母的过夜培养物转移到发酵罐,甲醇诱导发酵1 d,就能产生大量的铁调素,这些蛋白可作为石斑鱼养殖的膳食补充剂,通过饲料添加可提高石斑鱼免疫力[59](表2)。
真核表达系统虽然解决了原核表达系统表达蛋白活性较低问题,但重组蛋白质通常是高糖基化的,这会改变免疫原性表位,并且在此类系统中的高甘露糖基化会导致蛋白质在体内的半衰期较低,这两个因素都会影响产品的治疗活性[60]。
4.3 植物表达系统
植物表达系统具有许多优势,主要优势为:低生产成本、低运输成本(无需冷藏运输)、快速扩大规模、简单的种子分发、易于基因操作、口服递送以及低健康风险等[61]。He等[62]将大黄鱼Hepcidin基因与拟穴青蟹(Scyllaparamamosain)性腺素(Scy)基因进行融合表达,获得能稳定高效表达Scy-hepcidin融合基因的小球藻(Chlorella),其产生的重组性腺素-铁调素融合蛋白在体外具有较强的杀菌活性。喂食转基因的小球藻后,可以有效保护鱼类免受嗜水气单胞菌的感染(表2)。鱼类和对虾的幼体阶段,其主要以微藻(如小球藻)等为开口饲料,所以,在养殖中可根据养殖品种或生长阶段的不同,采取不同的饲料制备技术来取得更经济、更高效的健康养殖模式。
5 鱼类铁调素在食品、医药及水产领域中的应用
鱼类铁调素在食品、医药及水产领域中都有较大的实际应用价值。外源重组表达的大黄鱼铁调素,可用于食品添加剂,这种添加剂能够影响肠道微生物群落而不引起炎症[68]。尼罗罗非鱼铁调素对人纤维肉瘤细胞有较好的杀伤力,并且可特异性抑制人纤维肉瘤细胞的增殖和迁移,这表明铁调素是一种应用前景较好的抗人纤维肉瘤细胞的化疗药物[50,69]。鱼类铁调素还可作为口腔癌治疗的辅助或主要化疗药物,将尼罗罗非鱼铁调素纳入脂质体制剂中,并增强了“表阿霉素”对人类舌鳞状细胞癌、人类胚胎癌细胞和人宫颈癌细胞的治疗效果[70,71]。水产养殖中,铁调素可作为一种潜在的免疫调节剂和抗菌治疗剂。星斑川鲽(Platichthysstellatus)铁调素,无论是单独使用还是与常规抗生素联合应用,对大部分菌株均有协同作用[72]。表达铁调素的鱼卵可作为一种新型饲料补充剂,能够提高斑马鱼对病原感染的免疫力[73]。Ting等[59]研究了尼罗罗非鱼铁调素在石斑鱼养殖中的应用效果,结果发现,在饲料中添加1%的铁调素,可提高石斑鱼的免疫力,从而保护石斑鱼免受细菌感染。尽管铁调素具有替代抗生素的潜力,但在实际应用中仍面临较多挑战,如溶血和蛋白水解的不稳定性[74]。今后,还需要不断深入研究铁调素功能,并不断优化其表达体系,以获得更易于应用的抗菌肽。
6 总结与展望
鱼类铁调素是一个富含半胱氨酸的小分子抗菌肽,也是铁代谢的关键调节因子,具有抗细菌、抗病毒、抗肿瘤、抗寄生虫等多种功能。鱼类铁调素不仅可作为饲料添加剂应用于水产养殖业,而且也可作为抗生素的替代药物,以用于疾病防控。多种鱼类中存在铁调素,但鱼体内含量较少。由于化学合成铁调素价格高昂,因此,采用基因工程技术,选择适宜的表达体系,高效表达Hepcidin基因,通过优化发酵工艺,以进行工业化生产,从而获得大量具有生物活性的铁调素。目前鱼类铁调素的基础研究还有待深入,关于鱼类Hepcidin基因表达的信号调控、铁代谢调节和杀菌机理的研究还需开展更多试验,以弄清相关机制。鱼类铁调素在临床应用方面还不够成熟和完善,其在体内的稳定性、毒性等方面研究还不全面,有效性及安全性的研究需要进一步加强。水产养殖上铁调素的应用还需不断优化,以系统评价其免疫防控效果,从而使铁调素作为抗生素替代药物或免疫增强剂在渔业生产上更好地应用,以确保生态养殖和渔业可持续发展。
