HLA-G基因多态性在肾移植排斥反应中的作用
2023-09-25滕昊林
刘 念,滕昊林,赵 军,远 航
(吉林大学第一医院 1.泌尿外二科;2.肾病内科,吉林 长春130021)
人白细胞抗原G (HLA-G)是一种非经典的人主要组织相容性复合体(MHC)Ib分子,早期针对HLA-G的研究主要集中在妊娠期的免疫发育,其对母体和胎儿异种抗原的耐受性具有重要意义。近年来,越来越多的研究揭示了HLA-G在不同疾病中的作用和机制。HLA-G作为一种重要的免疫调节分子,在器官移植中的作用也有陆续报道。肾移植是终末期肾衰竭最有效的治疗选择,然而排斥反应是移植后主要的并发症,早期诊断急性、慢性排斥反应对于降低移植物丧失的风险和提高长期生存率非常重要。本文综述HLA-G的功能、多态性及其在肾移植排斥反应中的免疫调节作用的最新进展,报道如下。
1 HLA-G的结构及多态性
HLA-G基因于1987年首次被确定为非经典MHC I家族的成员。它是一个功能性的非经典I类HLA分子,具有经典样HLA抗原结构,位于染色体6p21.3的MHC区,然而与经典HLA-I类分子相比,HLA-G具有更少的多态性和更有限的组织分布[1-2]。HLA-G基因全长4170 bp,由8个外显子组成:外显子1编码信号肽;外显子2、3和4分别编码细胞外α1、α2和α3结构域;外显子5和6分别编码重链的跨膜结构域和细胞质结构域;由于外显子6中存在终止密码子,外显子7不能转录成成熟的mRNA,而外显子8是一个3’UTR[3]。在生理条件下,HLA-G仅在胎盘滋养细胞、胸腺、胰岛细胞、骨髓间充质干细胞、角膜和有核红细胞中表达[4-6]。HLA-G的表达可由肿瘤、病毒感染和自身免疫性疾病等病理条件诱导[7-8]。HLA-G具有7种异构体:4种具有跨膜和细胞质结构域的膜型异构体(HLA-G1至HLA-G4)和3种无跨膜结构域的分泌型异构体(sHLA-G5至HLA-G7)[9]。膜结合型和分泌型HLA-G通过结合自然杀伤细胞(NK)、树突状细胞(DC)、CD8+ T细胞和中性粒细胞表达的抑制性受体发挥免疫抑制特性,从而抑制CD4+T细胞的增殖、NK细胞和CD8+T细胞的杀伤功能、抑制DC的抗原呈递和B细胞分化;上调抗炎细胞因子白细胞介素(IL)-10的分泌,以调节先天和适应性免疫反应[10-12]。
HLA-G的表达受基因型和多态性的影响。HLA-G呈现出低多态性的特点,只有88个等位基因编码26种已知的多态性等位基因(包括4个无效等位基因和2个可疑等位基因)[13]。HLA-G编码区相对保守,同样具有很少的功能多态性。HLA-G调控区域是可变的,包含许多转录和转录后调控元件的靶点[14]。这些片段中的部分多态性位点与HLA-G表达水平相关,这可能影响其生物学功能。影响HLA-G表达的最常见多态性位点位于两个非编码区:上游调控区(5’URR)和非翻译区(3’UTR)。3’UTR中的7个单倍型占所有单倍型的90% (UTR-1至UTR-7)。通常单倍型UTR-1与可溶性HLA-G水平升高有关,UTR-5或UTR-7与sHLA-G水平降低有关,UTR2、3、4、6、8和10对sHLA-G的表达无显著影响。HLA-G 5’URR多态性可能影响HLA-G基因的调控,从而影响蛋白表达或疾病易感性[15-16]。一项体外研究表明,5’URR的多态性会影响细胞微环境调节剂对HLA-G表达的作用。然而,5’URR对sHLA-G水平的预测价值有限,血浆sHLA-G水平与健康供者的单倍型或基因型之间没有很强的相关性[17]。到目前为止,HLA-G 5’URR多态性在器官移植方面还没有报道。
HLA-G 3’UTR片段在2010年通过Sanger测序被完全鉴定。HLA-G 3’UTR变体通过几种潜在的机制调节mRNA的稳定性,包括HLA-G mRNA和miRNA之间的差异亲和力。3’UTR是大多数miRNA的主要靶点。功能研究表明,HLA-G 3’UTR至少有三种变异体参与调节HLA-G的表达:第一种是HLA-G外显子8的14bp插入或删除片段多态性,其研究最广泛,与mRNA稳定性有关;第二种是+3142位的SNP,它是多种miRNA的靶标;其中+3142 G>C变异影响部分miRNA与HLA-G的结合;第三种是+3187A,它与HLA-G表达下降有关,可能引发HLA-G mRNA的降解[18]。这三种多态性是相互关联的,14bp的插入通常与+3142G和+3187A共同发生,导致HLA-G mRNA表达降低。
2 HLA-G和免疫耐受
HLA-G对免疫耐受有直接和间接的影响,其直接作用是HLA-G与其受体相互作用的结果。HLA-G受体包括Ig样转录物ILT-2和ILT-4、杀伤细胞Ig样受体(KIR)2DL4、 CD8和CD160。ILT2在T细胞、B细胞、单核细胞、巨噬细胞、NK细胞和DC细胞中表达;ILT-4主要存在于单核细胞、巨噬细胞、NK细胞和DC中;KIR2DL4仅在肥大细胞和NK细胞中表达。CD8在T细胞和NK细胞表面表达,CD160在内皮细胞表面表达。目前的研究表明,HLA-G具有:(1)与NK细胞上的ILT2和KIR2DL4受体相互作用,抑制NK细胞的迁移、增殖、裂解活性和杀伤功能,抑制IFN-γ分泌,下调趋化因子受体,抑制外周血NK细胞趋化性,从而保护表达HLA-G的细胞[19-20];(2)识别HLA-G分子的受体ILT2在幼稚T细胞中表达水平较低,但在HLA-G富集环境中表达上调。HLA-G可直接抑制CD4+T细胞的增殖。混合淋巴细胞培养实验表明,sHLA-G5通过应答性CD4+T细胞抑制同种异体T细胞的增殖。HLA-G还可以抑制APC介导的CD4+体细胞活化,并通过消除同种异体反应性T细胞和诱导细胞因子的表达来调节CD8+细胞的功能,从而驱动向Th2型细胞的转化[21];(3)HLA-G通过与ILT2相互作用抑制外周血和次级淋巴器官(如扁桃体)中B细胞的增殖、分化和抗体分泌[22]。HLA-G还可以在刺激时增强IL-10+记忆Bregs (mBregs)的扩增,从而进一步降低CD3+T细胞的增殖能力[23];(4)与DC上的ILT2和ILT4受体结合后,HLA-G可调节单核细胞APC的功能(即抗原摄取和递呈、迁移、细胞因子产生和共刺激分子的表达)。人类DC分泌IL-10 (DC-10),研究证实,HLA-G的表达调节DC-10的耐受性,诱导T调节性1型(Tr1)细胞[24]。HLA-G的调控作用如图1所示。
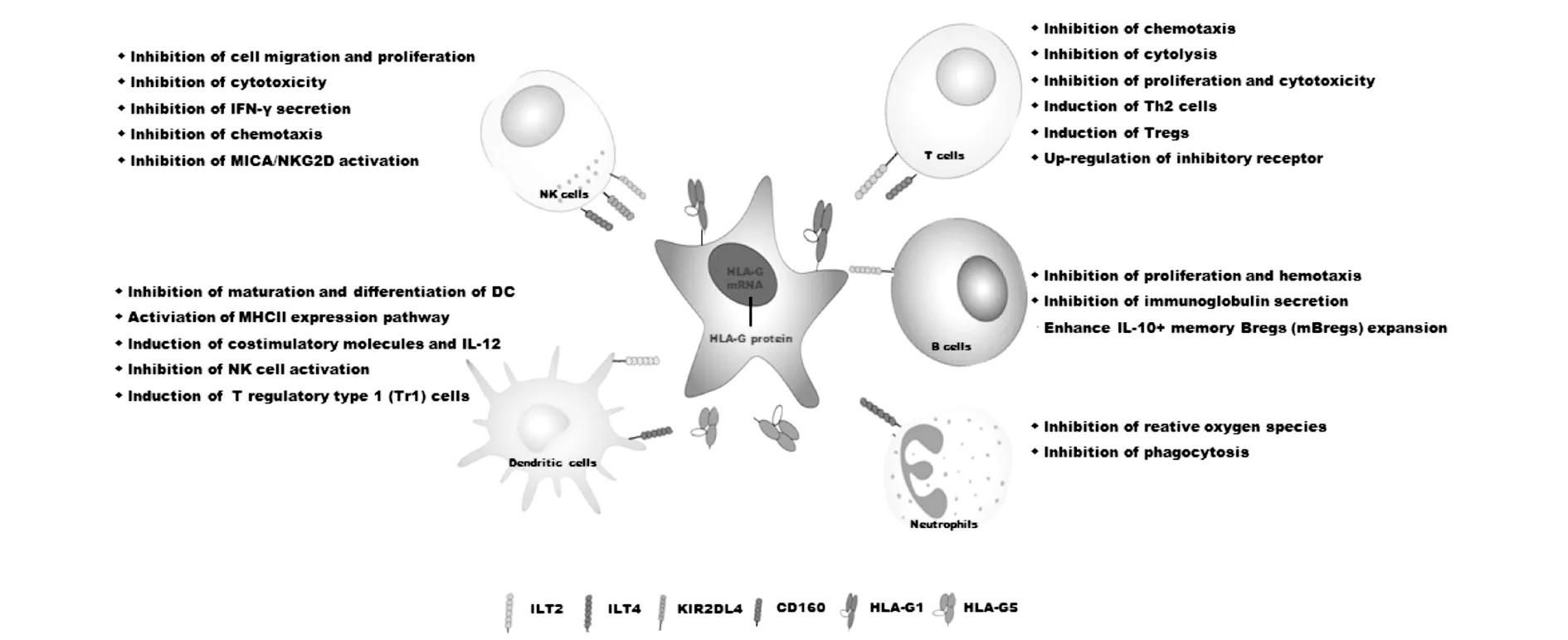
图1 HLA-G的免疫调节功能
3 HLA-G在肾移植中的重要作用
随着围手术期抗体诱导治疗和新型强效免疫抑制剂的应用,急性排斥反应的发生率逐渐降低,但排斥反应仍是影响移植物长期存活的主要独立危险因素。排斥反应可在移植后的不同时间发生。免疫调节对于维持移植物和减少排斥或感染发生至关重要。免疫抑制药物用于预防排斥反应,但会导致移植患者感染的风险增高。诱导免疫耐受可能是减少免疫抑制剂应用的最佳策略。最早在2000年的一项心脏移植研究提供了HLA-G在移植耐受中的第一个证据,HLA-G的表达在移植过程中被激活,通过调节宿主免疫反应促进同种异体移植物的耐受性[25]。此后,HLA-G被证实在移植后不同实体器官(心、肾、肝、肺、胰)中均有表达。
3.1 肾移植后HLA-G与急性排斥反应
2003年,CREPUT等[26]报道了血清和移植活检中高表达的新生HLA-G与较低的急性肝脏和肾脏移植排斥发生率相关,并且高表达的患者不会出现慢性移植排斥反应,这些结果首次证明了HLA-G在肾移植中的调节作用。陆续有研究报道sHLA-G对肾移植患者的保护作用,在表达sHLA-G的患者中,急性肾排斥反应和慢性同种异体肾病的发生率较低[27-28]。POLAKOVA等[29]证实,血清sHLA-G动态水平与肾移植排斥反应的发生有关;sHLA-G水平在移植后1~2周下降,但无排斥反应患者的sHLA-G水平在移植后1个月内逐渐升高。然而,在1~12个月内发生移植排斥反应的患者中,sHLA-G水平仍然很低,仅在移植后1年升高。
HLA-G的表达受基因型和多态性的影响。HLA-G多态性中,位于3’UTR的14 bp插入/删除(ins/del)多态性(rs1704)和+3142C>G SNP (rs1063320)影响mRNA稳定性和sHLA-G水平[30]。一些研究探讨了HLA-G 14bp(ins/del)与移植后急性排斥反应的关系,然而他们报告的结果不一致。一些报道证实14bp多态性与急性排斥反应之间存在关联,而另一些报道认为没有关联[31-38]。这些相互矛盾的结果可归因于不同的种族、研究规模和样本队列数量。最近,一项荟萃分析提供了14bp(ins/del)多态性与急性排斥反应之间关系更可靠的结果,研究纳入336例急性排斥肾移植受者和952例无急性排斥肾移植受者。结果显示,当纳入白种人和亚洲人时,结果没有显著性差异;然而,在亚洲人群中,HLA-G 14bp(ins/del)多态性与急性排斥反应之间存在显著关联[39]。除了14bp多态性外,+3035CT和+3187AG与同种异体移植物接受或排斥有关。大多数研究都集中在肾移植受体HLA-G的多态性上,一项研究探讨了肾移植受体和供体HLA-G 14bp(ins/del)和3142C>G多态性。结果显示,呈现14bp(ins/del)多态性的健康肾脏供体中的sHLA-G水平最高,这些供体器官发生排斥反应较少,这表明供体中HLA-G多态性在急性排斥反应的易感性中具有重要作用[40]。因此,供体基因型可能影响移植器官中HLA-G的局部表达,而受体基因型影响宿主免疫系统的活性。一般来说,HLA-G 14bp(ins/del)和+3187A/G和+3142SNP对HLA-G表达水平影响最大。其常见的多态性位点见表1。

表1 HLA-G多态性与肾移植术后排斥反应的关系
3.2 HLA-G与慢性排斥反应及移植物长期存活
慢性排斥反应仍然是影响移植受者的主要问题。同种异体移植物的慢性排斥部分原因是由于受体B淋巴细胞分泌抗体,然后与供体同种异体抗原结合并引发免疫反应。由于HLA-G具有免疫抑制作用,因此研究HLA-G在免疫抑制治疗期间移植物存活和排斥反应中的作用具有一定意义。2009年首次证实肾移植血清样本中存在sHLA-G,在该研究中约30%的肾移植患者血清中检测到sHLA-G。最初,sHLA-G与同种异体移植物慢性排斥失败呈负相关,与HLA IgG抗体的产生呈负相关,HLA-G阳性患者通常具有较低的移植排斥率,结果表明,HLA-G在移植肾中的表达与慢性移植肾的发生率较低有关。一项日本的队列研究评估了血清HLA-G5水平或肾脏HLA-G1/5表达与同种异体肾移植功能的相关性。结果显示,血清sHLA-G5水平是患者同种异体肾移植功能的独立预测因子,在同种异体肾移植功能良好的患者中,在移植后的前3~12个月检测到血清中sHLA-G水平的显著增加。因此,监测肾移植后3个月的血清sHLA-G水平或近端肾小管上皮细胞(pTEC) HLA-G表达可能有助于预测短期和长期预后[41]。另一项研究显示,HLA-G1/5表达对肾功能的保护作用可长达8.8年,证明了HLA-G对肾脏长期保护作用[42]。
4 总结
HLA-G作为一种重要的免疫耐受分子,在免疫调节中的作用已被广泛研究。进一步研究调控HLA-G表达的机制可以为提高免疫耐受和移植器官存活率提供新的策略。在本文中,我们总结了HLA-G在肾移植术后急性及慢性排斥反应的保护作用,然而HLA-G的临床研究结果受到许多因素的影响,如患者的种族、研究规模和患者特征的差异等。HLA-G作为一种潜在的无创生物标志物,可以用于预测或监测急性和慢性排斥反应的发生,但仍需要大规模的临床研究及深入的基础研究。
