生长分化因子15 沉默抑制人肝癌HepG2增殖及迁移作用研究
2023-09-25艾郁葱闫光志
艾郁葱,闫光志
(吉林省肿瘤医院 1.放疗一科;2.结直肠胃腹部肿瘤外一科,吉林 长春130012)
肝细胞癌(HCC)是一种高死亡率的原发性肝癌,为全球第三大癌症死亡原因,尽管手术切除、经导管动脉化疗栓塞和射频消融、肝移植及受体酪氨酸激酶抑制剂等手段的应用大大提高了肝癌患者生存率,但由于其复发率高,患者总5年生存率仍然很低[1-2]。阐明HCC发病机制,找到新的、有效的治疗策略是目前亟待解决问题。生长分化因子15(GDF15)是 TGF-β 超家族的成员,其多肽分子由一个29个氨基酸信号肽、一个112个氨基酸的成熟蛋白和一个167个氨基酸的前肽组成[3]。研究表明,GDF15在多种肿瘤如肺腺癌、结直肠癌、宫颈癌中有较高表达,并通过自分泌和旁分泌作用激活TGF-β/Smad、蛋白激酶1/2(ERK1/2)通路和ErbB2/AKT1等信号通路调节肿瘤细胞的增殖和凋亡,促进癌症的发展[4-5]。本研究拟通过用短发夹RNA(shRNA)构建人肝癌HepG2细胞GDF15稳定低表达细胞系(shGDF15),并检测其增殖及迁移能力变化,为寻找HCC治疗靶点提供实验依据。
1 材料与方法
1.1 材料
人肝细胞癌细胞系HepG2购自北纳创联生物技术研究院;大肠杆菌DH5α、干扰载体购自广州莱德盟生物科技有限公司;PLKO.1慢病毒载体购自上海吉凯基因化学技术有限公司;限制性内切酶 BglⅡ和 HindⅢ、DNA 连接酶购自TaKaRa公司;Transwell小室、逆转录试剂盒、荧光定量PCR试剂盒购自长春久欣生物科技有限公司;LipofectamineTM2000、DMEM培养基、胎牛血清(FBS)、TRIzol 裂解液购自Invitrogen 公司;兔抗人E-cadherin、Vimentin抗体购自Cell Signaling Technology公司;小鼠抗人GAPDH 抗体、GDF15抗体购自武汉博士德公司;二辛可宁酸(BCA)蛋白浓度测定试剂盒购自碧云天生物科技公司;辣根过氧化物酶标记的山羊抗兔 IgG 和辣根过氧化物酶标记的山羊抗小鼠 IgG 购自北京中杉金桥公司;ECL发光液购自Millipore公司;其余均为国产进口分析纯试剂。
1.2 方法
1.2.1细胞培养 HepG2用含10% FBS、1%青霉素/链霉素DMEM培养基于37℃、5% CO2的恒温孵箱内培养,隔日换液,待细胞铺满培养皿底部90%左右时按1∶3传代。
1.2.2GDF15 shRNA质粒构建及鉴定 用PLKO.1慢病毒载体构建并鉴定shGDF15表达载体。使用含有氨苄青霉素的LB琼脂平板筛选重组质粒。在提取和纯化无内毒素重组质粒后,使用 LipofectamineTM2000将 PLKO.1-sh-GDF15 载体和 Lenti-Easy 包装混合物共转染到293T细胞中。然后,收集细胞上清液用于浓缩和纯化。慢病毒滴度采用荧光计数法测定。将shGDF15载体转染到添加了聚凝胺的HepG2细胞中。转染后48 h,加入嘌呤霉素(2 mg/mL)进行抗性筛选,2 周后采用荧光显微镜观察转染效果。使用RT-qPCR和蛋白质印迹测量转染效果。
1.2.3RT-qPCR检测肝癌细胞GDF15 mRNA表达水平 将处于对数生长期的野生型HEPG2细胞及shGDF15转染细胞准确计数后,以6×105/孔铺于6孔板,待其完全贴壁后用无血清培养液继续培养24 h后,按TRIzol说明书提取培养细胞总RNA用于逆转录。按逆转录体系为20 μL,含总RNA 1 μg,4×gDNA Erase-Out Mix 5 μL,42℃ 逆转录15 min,经85℃ 5 s灭活逆转酶活性后用于qPCR。按试剂盒说明书进行qPCR,反应体系为20 μL,含cDNA模板2 μL,2×Q3 SYBR qPCR Master Mix 10 μL,上、下游引物各1 μL,经95 ℃预变性2 min,经95 ℃ 5 s、60 ℃ 30 s,共 40个循环后,以GAPDH为内参,用2-ΔΔCT法计算GDF15 mRNA的相对表达量。qPCR引物序列如下: GDF15上游5′-CA-ACTTCCGTGTGCTTTGGG-3′,下游5′-CAACG-TCTCTGCCTTCCACT-3′;GAPDH上游5′-CCT-CGCCTTTGCCGATCC-3′,下游5′-CGTGCTCGA-TGGGGTACTTC-3′。
1.2.4Western blot法检测 用Western blot法检测HepG2细胞shGDF15转染效果及GDF15低表达HepG2细胞E-cadherin和Vimentin相对表达量。按1.2.3所述接种并培养细胞,收集培养细胞总蛋白,BCA 法检测蛋白浓度。通过SDS-PAGE分离蛋白,电泳结束后,进行PVDF转膜;5%的脱脂奶粉 TBST 缓冲液室温封闭1 h;加适当比例稀释的一抗4℃孵育过夜;次日,TBST 洗膜10 min,共4次;加入HRP标记的山羊抗兔IgG (1∶10 000),室温孵育1 h;TBST洗膜10 min,共4次;用ECL化学发光显色后通过上海Tanon化学发光成像一体机拍照分析。所用一抗及稀释比例:GDF15(1∶1 000)、E-cadherin抗体(1∶500)、Vimentin(1∶300)、GAPDH(1∶5 000)。
1.2.5CCK8法检测细胞增殖活性影响 对生长状态良好的GDF15低表达HEPG2细胞分别以5×103个/孔接种于96孔板,于接种24、48和96 h后用CCK8法检测其增殖活力,以空载体转染的HEPG2做为对照。
1.2.6划痕实验检测 将细胞首先接种于6孔板中,待细胞汇合度达到>90%后,用200 μL无菌枪头划一横线,PBS 洗涤3次,将培养基更换为无血清DMEM培养基,用倒置显微镜进行观察、拍照。放回培养箱继续培养24 h后,再次用同样方法对相对位置进行观察、拍照。选取5个视野进行测量、统计分析。
1.2.7Transwell实验 用Transwell小室法检测培养细胞的迁移情况。将HEPG2细胞饥饿24 h后,胰酶消化,制备细胞悬液,PBS洗1次,将细胞浓度调整至4×105个细胞加入Transwell上室中,下室中加入800 μL含10% FBS的DMEM培养基,37℃孵育。24 h后,用棉签擦去上室内残留的细胞,甲醛固定10 min,0.1%的结晶紫室温孵育10 min,PBS清洗3遍,将小室底面朝上于显微镜下拍照,随机选取5个视野进行计数,统计分析,重复上述实验3次。

2 结果
2.1 GDF15低表达HEPG2细胞系的获得与鉴定
用shHK2质粒转染HEPG2细胞后经嘌呤霉素抗性筛选2周,荧光显微镜下观察转染效果超过90%,shGDF15组细胞GDF15 mRNA和蛋白表达水平明显低于shNC组,见图1。

图1 GDF15敲低稳定细胞株 HEPG2 细胞的获得与鉴定
2.2 GDF15低表达细胞增殖活力检测结果
在培养24、48及96 h后,GDF15低表达细胞的增殖活力均明显低于对照组,差异均有统计学意义(P<0.01)。见表1。

表1 细胞中各个时间点不同组别肝癌细胞的 OD570 nm相对值比较
2.3 GDF15低表达HEPG2迁移能力检测结果
细胞划痕实验检测结果显示,shGDF15组细胞划痕填充面积明显低于对照组,见图2A。Transwell细胞迁移实验结果见图2B,培养24 h后,shGDF15组细胞迁移细胞数量为正常组的50%(45.2%~66.7%)左右,明显低于正常组细胞数量,差异有统计学意义(P<0.05)。

图2 敲低GDF15对HEPG2 细胞迁移的影响
2.4 GDF15低表达HEPG2 E-cadherin和Vimentin表达检测结果
Western blot结果显示,shGDF15细胞E-cadherin表达水平明显增加,Vimentin 表达水平明显降低,与正常对照组比较,差异有统计学意义(P<0.01),见图3。
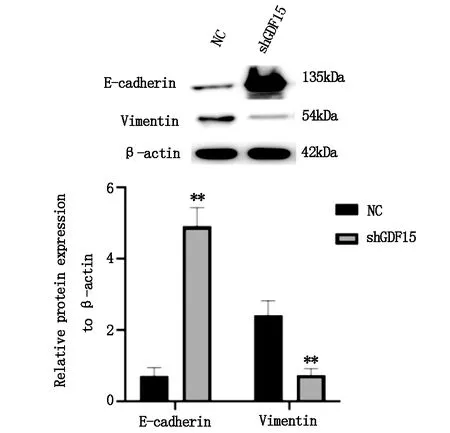
图3 敲低GDF15对HEPG2 细胞EMT相关基因表达的影响
3 讨论
增殖、迁移是肿瘤细胞的基本生物学性状,与肿瘤生长及转移能力高度相关,是评价肿瘤恶性程度的重要指标。上皮间质转化(EMT)是癌细胞转移的关键过程,是上皮细胞获得间充质细胞表型的生物学过程。E-cadherin为一种跨膜糖蛋白,属上皮细胞钙离子依赖的黏附分子家族,是常用的上皮细胞标志物,与多种肿瘤细胞的浸润和转移相关。Vimentin属于一种中间丝蛋白,在EMT过程中,肿瘤细胞Vimentin表达上调,是EMT的常用细胞标志物。肿瘤细胞增殖能力、迁移能力及EMT程度是评价肿瘤细胞恶性程度的重要指标[6]。本研究将shGDF15载体转染到HEPG2肝癌细胞中,获得了内源性GDF15转录及翻译水平均降低的HEPG2稳转细胞系。增殖活力检测结果显示,GDF15低表达稳转细胞系增殖活力明显下降,迁移能力显著降低,同时,E-cadherin表达水平明显增加而Vimentin表达水平明显降低,表明抑制GDF15表达可抑制肝癌细胞恶性转化。
研究表明,GDF15在器官损伤、缺氧、肿瘤等多种疾病状态下表达增加,并通过调节细胞增殖、免疫反应、血管生成、浸润和转移促进癌症发展[7-8]。近年来,GDF15在肝癌发生、发展及治疗中的意义引起了学者的重视。LIU等[9]对412例肝脏疾病患者血清和组织GDF15检测发现,HCC患者血清GDF15水平显著高于健康受试者及HBV和HCV携带者,而且,HCC癌巢中GDF15表达水平显著高于相应癌旁组织和正常肝脏,提示血清GDF15有作为HCC的生物标志物的价值。GDF15单克隆抗体可有效抑制小鼠原发肝癌肿瘤生长,降低Tregs在肿瘤浸润淋巴细胞中的比例,提高CD3+T细胞中IFN-γ+T细胞比例,降低IL-10+T细胞比例,提高CD4+和CD8+T细胞活性,表明有效抑制GDF15高表达可能抑制肿瘤生长、逆转肿瘤引发的免疫抑制作用[10]。本研究发现,内源性GDF15表达下降低后,肝癌细胞的增殖、迁移及表型转化能力均显著降低,靶向GDF15,抑制其表达及活性可能对HCC治疗有利,当然GDF15在HCC发生发展中的具体机制尚需大量研究证实。
