基于试纸条核酸提取和重组聚合酶扩增技术的HPV 16型DNA纸基电化学发光快速检测方法
2023-09-25任伟绮刘仲明
陈 钰,任伟绮,刘仲明,王 捷*
(1.中国人民解放军南部战区总医院 基础医学实验室,广东 广州510010;2.广东省第二人民医院 检验医学部,广东 广州510317)
人乳头瘤病毒(HPV)是人类最常见的性传播疾病病原体[1],高危亚型HPV 16是全球分布最广的基因型。HPV DNA检测是临床HPV常用的检测方法,包括核酸杂交检测[2]、实时荧光聚合酶链式反应(RT-PCR)[3]、测序系统[4-5]等技术,其中RT-PCR是当前HPV DNA检测运用最广泛的技术,但需要多个温度控制且易受背景光影响,依赖专业的设备和专业的操作人员[6]。
重组聚合酶扩增(RPA)技术降低了核酸扩增对于温度控制的要求,可在25~42℃恒温条件下快速完成核酸扩增,通过琼脂糖凝胶电泳[7]、荧光探针法[8]、侧流层析法[9]等方法进行结果判读,但这些方法普遍灵敏度不高。电化学发光(ECL)技术光学背景低、灵敏度高、检测迅速、线性范围宽[10-11],可以改善RPA方法结果分析灵敏度不高的问题[12-14]。本研究前期构建的纸基电极-ECL检测平台,可以有效避免传统检测池样本残留导致的交叉污染的问题,具有成本低、易携带、检测用量小、易操作等优点[15-16],将RPA技术与纸基电极-ECL技术结合,初步建立了一种气溶胶病原体的RPA-ECL检测方法[17],敏感、特异、快捷,可检出1.2 pg/mL乙型肝炎病毒DNA。
本研究通过对HPV 16 型DNA RPA上游引物进行酯化钌标记,下游引物标记生物素,利用前期构建的试纸条法[18]提取宫颈脱落细胞样本HPV DNA,将模板直接洗脱在RPA反应液中,进行RPA等温扩增,经磁分离纯化后进行纸基电化学发光检测[15-16],获得待测物的浓度信息。通过评估该法的特异性、准确性和适用性,确认该法检测临床宫颈脱落细胞样本HPV DNA的可能性。
1 材料与方法
1.1 材料
含HPV 16型基因片段的质粒、HPV核酸提取试剂盒和人乳头瘤病毒核酸检测试剂盒(PCR-荧光法)购自港龙生物公司;临床宫颈脱落细胞样本11例由南部战区总医院检验科提供;KH2PO4、NaOH、KCl、Na2HPO4·12H2O、NaCl购自广州化学试剂厂;硼酸购自阿拉丁;氨基修饰的RPA上游引物、生物素修饰的RPA下游引物由苏州泓讯生物科技公司合成;链霉亲和素偶联磁珠(浓度为0.72 mg/mL)购自罗氏公司; TPA、酯化钌(Ru-NHS ester)购自sigma-Aldrich公司;TwistAmpTM-Basic RPA试剂盒购自TwistDx Inc公司;N,N-二甲基甲酰胺(DMF)购自上海麦克林公司;定性滤纸浸蜡试纸条(核酸结合区面积为2 mm×10 mm)自制;HPV裂解液(50 mmol/L Tris pH 8.0,800 mmol/L盐酸胍,0.5% Triton X100,1% Tween-20)、HPV洗涤液(10 mmol/L Tris,pH8.0)为实验室自制;50 bp Ladder Marker购自东盛生物科技有限公司;琼脂糖购自Biowest公司。MJ Mini梯度PCR仪购自BIO-RAD公司;Nanodrop 2000超微量紫外分光光度计购自Thermo Fisher Scientific公司;恒温金属浴、涡旋振荡器购自CORNING公司;Whatman No.1色谱纸购自Whatman公司;SIGMA-1K5高速离心机购自Sigma-Aldrich公司;XQT-152型纸芯片电化学发光检测仪为我单位与西安新启特仪表仪器有限公司联合研制;8孔磁分离架、3KD 0.5 mL Amicon Ultra 超滤管购自德国Millipore公司;TE100印刷碳电极购自台湾禅谱科技股份有限公司;电泳仪购自BIO-RAD公司;一体化紫外凝胶成像仪购自北京赛智创业科技有限公司。
1.2 方法
1.2.1RPA引物的设计 从NCBI 数据库下载HPV高危型基因组序列,通过序列比对分析,找到HPV 16型特有序列,针对L1区保守基因及RPA引物设计原则进行引物设计;使用NCBI Blast比对引物同源性;对上游引物5’端进行氨基(Amino C6)修饰,下游引物5’端进行生物素(Biotin)修饰,引物序列如下:
F:NH2-GGCTCTGGGTCTACTGCAAATTTAGCCAGT;
R:Biotin-CATTATTGTGGCCCTGTGCTCG-TTGTAACC。
1.2.2酯化钌标记氨基修饰引物及表征 用DMF配制10 mmol/L酯化钌溶液,分别以20∶1和40∶1的摩尔比与50 μL 50 μmol/L氨基修饰的RPA上游引物溶液混合,室温下30 r/min避光颠倒混匀12 h 后转移至超滤管,4℃ 14 000×g下离心30 min,分离游离酯化钌;将超滤管倒置以回收钌标引物,1 000×g离心2 min,收集超滤浓缩液,重复4次。使用Nanodrop 2000紫外分光光度计在200~800 nm波长范围内考察特征吸收峰;在0.2~1.5 V范围内以0.1 V/s的速率进行循环伏安(CV)扫描,在光电倍增管高压(PMT)1 000 V下进行电化学发光检测,比较两种摩尔比钌标引物的电化学发光强度。

1.2.4RPA等温扩增 向RPA扩增反应管的管盖内加入2.5 μL 280 mmol/L 醋酸镁,混匀、瞬离,在38 ℃恒温下扩增 20 min。
1.2.5扩增产物琼脂糖凝胶电泳检测 取0.9 g琼脂糖与30 mL电泳缓冲液(0.5×TBE)混合,加热至完全溶解,加入3 μL super red核酸染料并摇匀。将溶液一次性倒入插入梳子的凝胶模型中,静置40 min后拔出,制成3%琼脂糖凝胶。放入电泳槽中,倒入0.5×TBE直至液面到胶上约5 mm,取10 μL RPA扩增产物与2 μL Loading Buffer混匀,小心加入凝胶孔中,并将50 bp DNA marker加入孔中,100 V下电泳1 h。通过凝胶成像仪查看电泳结果。
1.2.6扩增产物磁分离、纸基电极-电化学发光检测 取6 μL RPA 扩增产物、24 μL 0.72 mg/mL链霉亲和素磁珠和60 μL 0.01 mol/L pH 7.4 PBS 混匀;37 ℃下孵育30 min,12000×g离心2 min,通过磁分离架富集酯化钌标记的扩增产物,弃上清,PBS洗涤磁珠复合物3次;将洗涤后的磁珠复合物重悬于15 μL 40 mmol/L TPA溶液中,混匀后取5 μL滴加至纸基电极上,在0.2~1.5 V范围以0.1 V/s的速率进行CV扫描,在PMT 1000 V下进行电化学发光检测。
1.2.7灵敏度分析 将5×105copies/mL HPV 16质粒进行10倍稀释,得到5 copies/mL~5×105copies/mL的梯度溶液,按照图1流程检测,根据电化学发光强度分析其灵敏度。
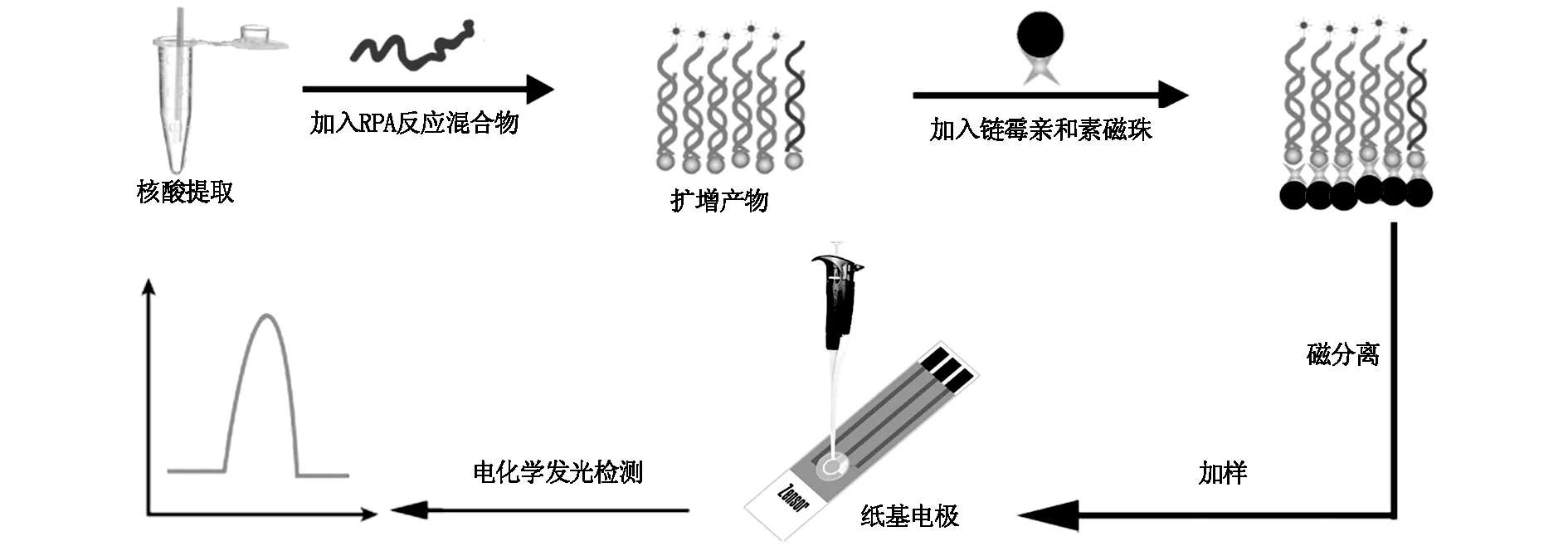
图1 检测流程示意图
1.2.8特异性及重复性分析 特异性:设置空白对照(灭菌水)、HPV阴性对照品(含人基因组DNA)、HPV 18阳性样本、HPV 52阳性样本、HPV 16阳性样本,每份样本重复3次。重复性:选择5×102copies/mL和5×105copies/mL的HPV 16阳性质粒,重复5次。
1.2.9方法学比较 RT-PCR方法按照港龙HPV核酸提取、检测试剂盒说明书操作。临床样品检测比较:对10例HPV临床宫颈脱落细胞样本进行检测,其中8例HPV 16型阳性样本(5~12#),1例HPV 18型样本(3#)、1例HPV 52型样本(4#样本),设置健康人宫颈脱落细胞样本作为阴性对照(2#),灭菌水为空白对照(1#),分别用本法及RT-PCR方法进行3次重复检测。灵敏度比较:对已知浓度HPV 16型阳性质粒进行梯度稀释,分别根据电化学发光强度及Ct值分析检测灵敏度。检测时间比较:记录本法每个步骤(包括核酸提取、RPA等温扩增、磁分离和电化学发光检测)所用时间,与RT-PCR法所用时间比较。
1.3 统计学分析
2 结果
2.1 酯化钌标记引物及表征
使用紫外-可见光吸收光谱考察酯化钌标记引物的情况,如图2所示,在455 nm波长处,酯化钌(100倍稀释)、20倍摩尔比和40倍摩尔比酯化钌标记的引物溶液均出现明显的特征吸收峰,且20倍摩尔比的钌标引物吸光度更高,灭菌水与氨基修饰引物(100倍稀释)均未出现明显的信号锋。
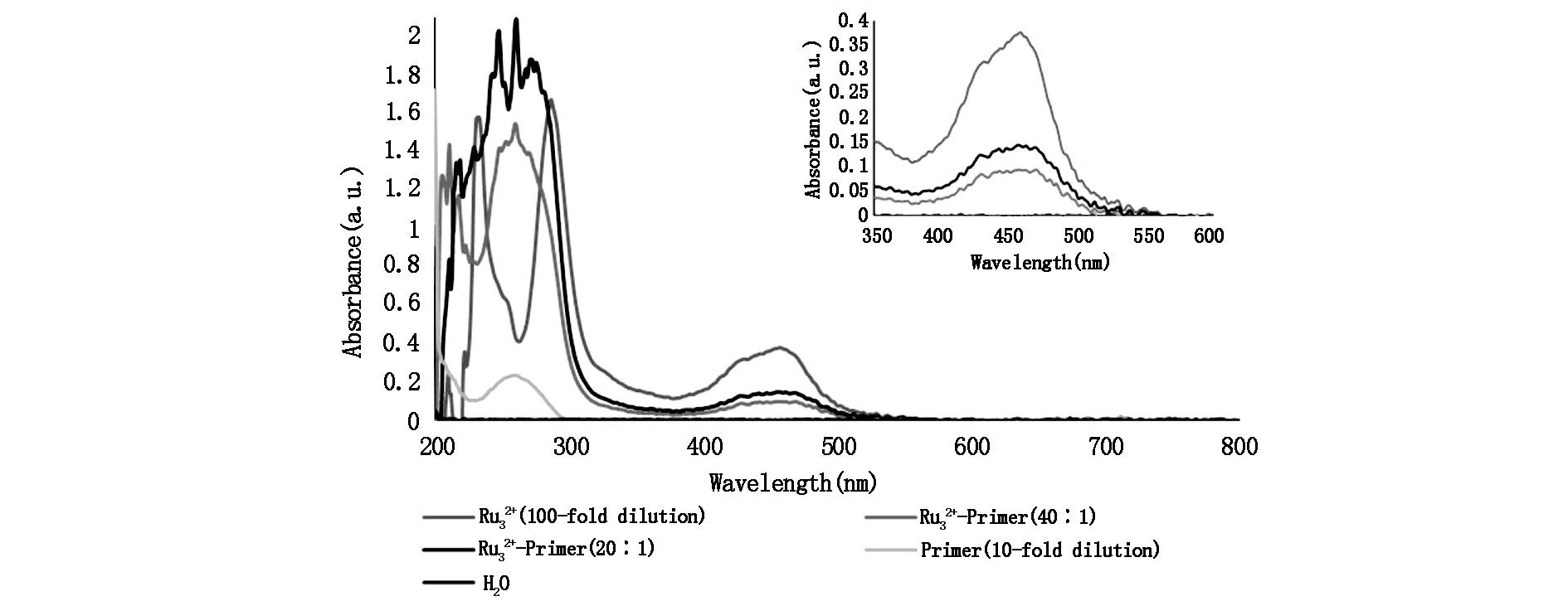
图2 引物、水、两种摩尔比的酯化钌标记引物和酯化钌紫外-可见光光谱
根据反应方程式及参考相关文献[17-20],根据下列公式,通过计算得到20倍摩尔比和40倍摩尔比的标记率分别为87.21%和64.82%。
R(label ratio)=A455·MNH2-Primer·VRu32+-Primer/(ε·d·F·A260·D·VNH2-Primer)×100%。其中A455:在455 nm波长处20倍摩尔比和40倍摩尔比酯化钌标记引物的吸光度0.142和0.092,A260:在260 nm波长处稀释10倍的氨基修饰RPA上游引物的吸光度为2.300,MNH2-Primer=9393.2,A455=εd C,ε=13700 L/mol·cm-1,d=0.1 cm,F=33 ng/μL,VRu32+-Primer:20倍摩尔比和40倍摩尔比酯化钌标记的引物体积分别为34 μL和39 μL,D:氨基修饰的上游引物稀释倍数为10,VNH2-Primer:加入的上游氨基修饰引物体积为50 μL。
通过电化学发光法考察酯化钌标记引物情况,如图3所示,20倍摩尔比钌标引物比40倍摩尔比钌标引物具有更高的发光强度。

图3 两种摩尔比酯化钌标记引物ECL响应图
综合紫外分光光度法和电化学发光法结果,酯化钌与氨基修饰引物摩尔比为20∶1时钌标记率与电化学发光强度更高,且发光强度足以满足实验后续检测的需要。
2.2 RPA产物琼脂糖凝胶电泳结果
设置灭菌水为空白对照,用试纸条法对2例HPV 16型样本、1例HPV 18型样本、1例HPV 11型样本进行核酸提取,经RPA扩增后进行琼脂糖凝胶电泳结果如图4所示。HPV 16阳性样本在150 bp左右出现特异性条带,空白对照、HPV 18型、HPV 11型在150 bp处未出现明显特异性条带,其他条带为非特异扩增条带。结果说明试纸条法提取的宫颈脱落细胞中的HPV 16型DNA,经RPA扩增可以得到阳性结果,且特异性较好。

M:50bp Ladder Marker;1:灭菌水;2:HPV16型样本1;3:HPV16型样本2;4:HPV18型样本;5:HPV11型样本
2.3 灵敏度分析
如图5所示,随着HPV 16型阳性质粒DNA浓度(5 copies/mL~5×105copies/mL)的增加,ECL发光强度逐渐增强,最低检出限为50 copies/mL(S/N>3)。
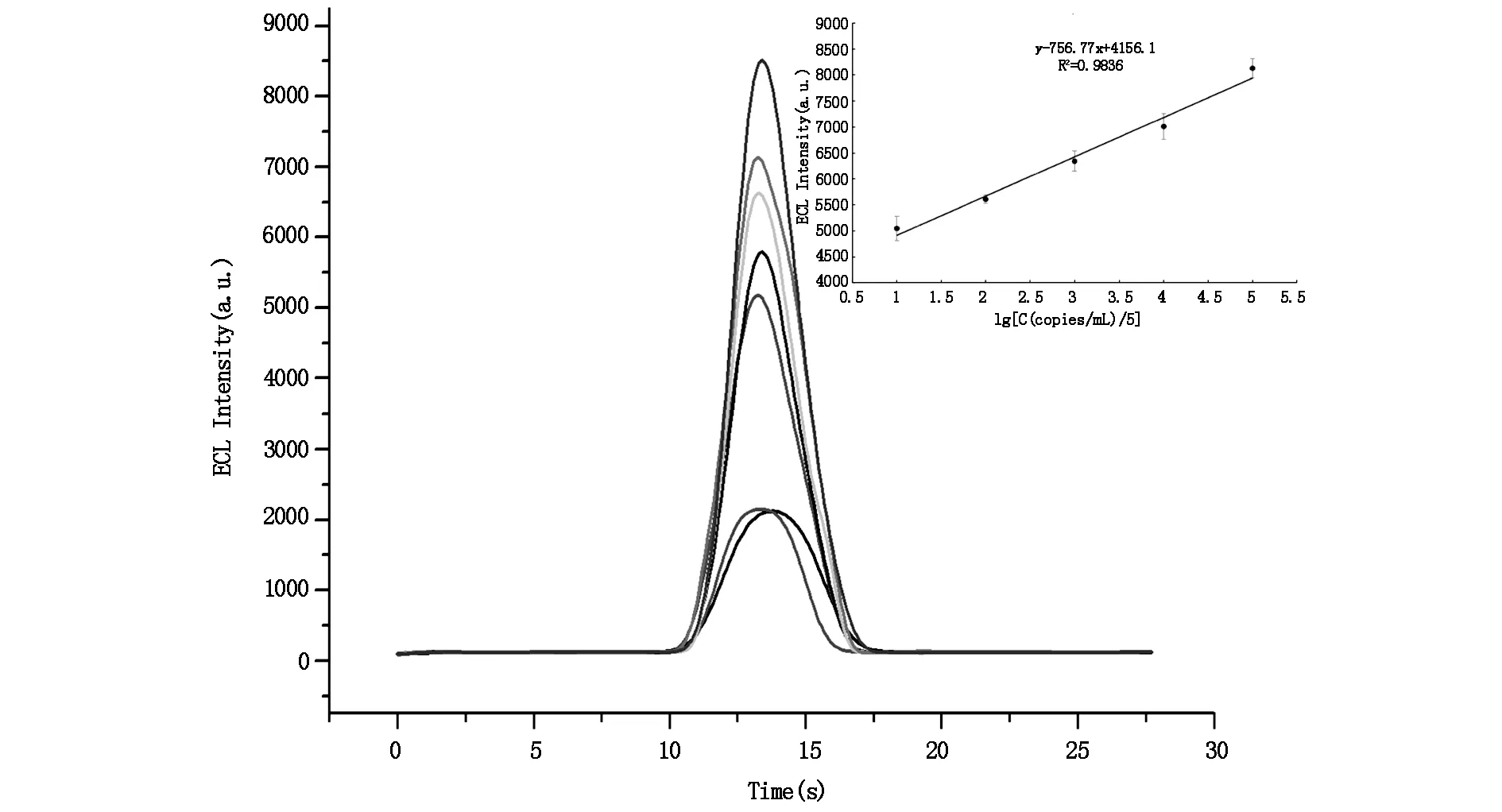
曲线从下到上浓度为0 copies/mL,5 copies/mL,50 copies/mL,5×102 copies/mL,5×103 copies/mL,5×104 copies/mL,5×105copies/mL
2.4 特异性及重复性
通过平行检测空白、阴性对照、HPV18型、HPV52型、HPV16型阳性样本的电化学发光响应情况,以考察所构建方法的特异性。图6显示,干扰物质的电化学发光强度远低于HPV 16型的电化学信号强度,对HPV 16 DNA的检测基本不造成干扰,说明本方法特异性较好。
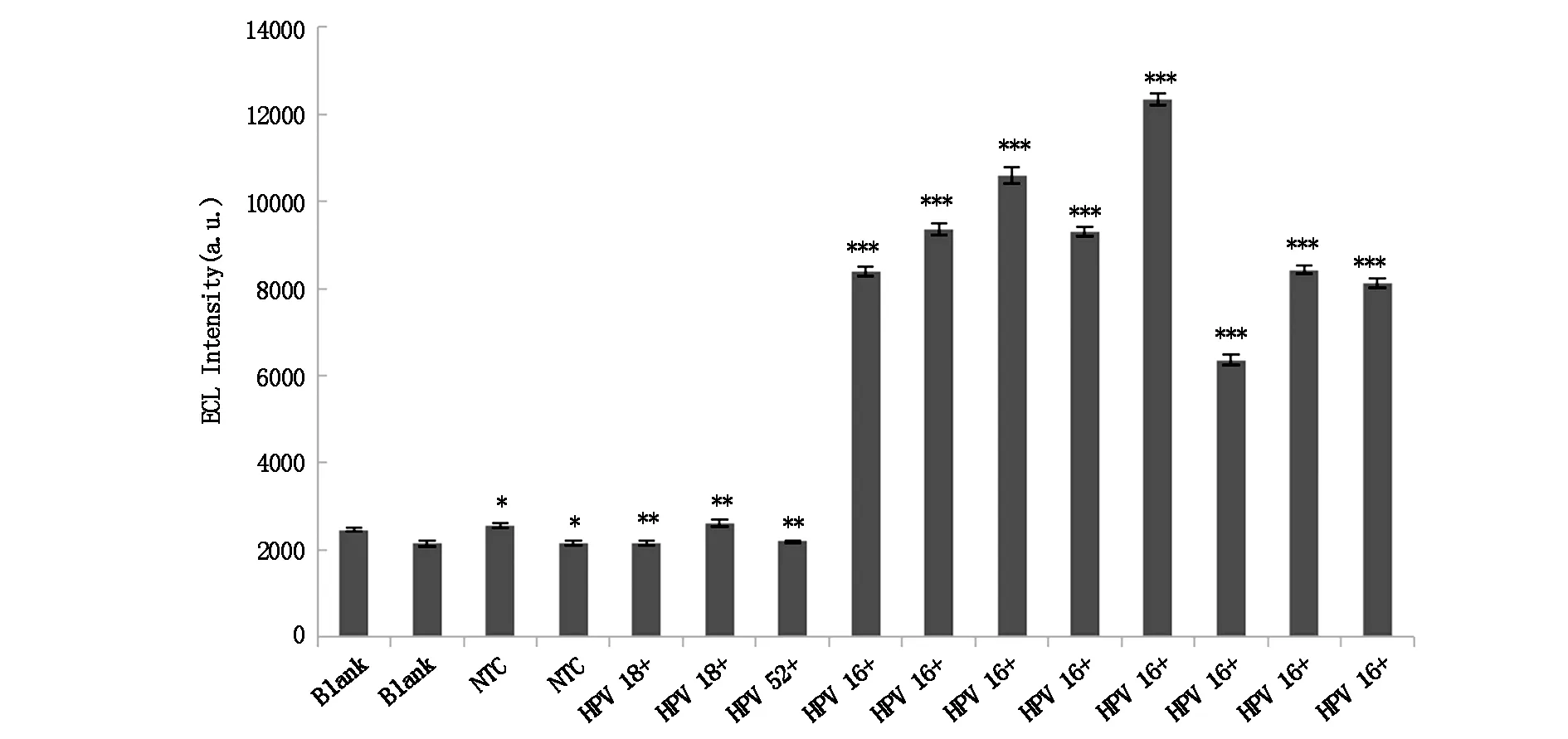
*空白与阴性对照比较P>0.05,差异无统计学意义;**空白与HPV 18、HPV52阳性组比较P>0.05,差异无统计学意义;***空白组与HPV 16阳性组比较P<0.05,差异有统计学意义
检测两种不同浓度HPV 16 型DNA(5×102copies/mL、5×105copies/mL),每个浓度检测5次,结果显示相对标准偏差分别为1.82%和2.28%,说明本法重复性较好。
2.5 方法学比较
临床样品检测:健康人宫颈脱落细胞样本(2#样品)、HPV 18阳性(3#样品)、HPV 52阳性样本(4#样品)与空白对照(1#样品)的电化学发光强度没有差异,电化学发光强度约为2100,RT-PCR法无典型的扩增曲线;8例HPV 16型阳性样本(5~12#样品)均能产生较强的电化学发光信号,可见典型的扩增曲线,两种方法具有较好的相关性,本法适用于临床宫颈脱落细胞样本HPV检测,有较好的临床应用前景,见图7。
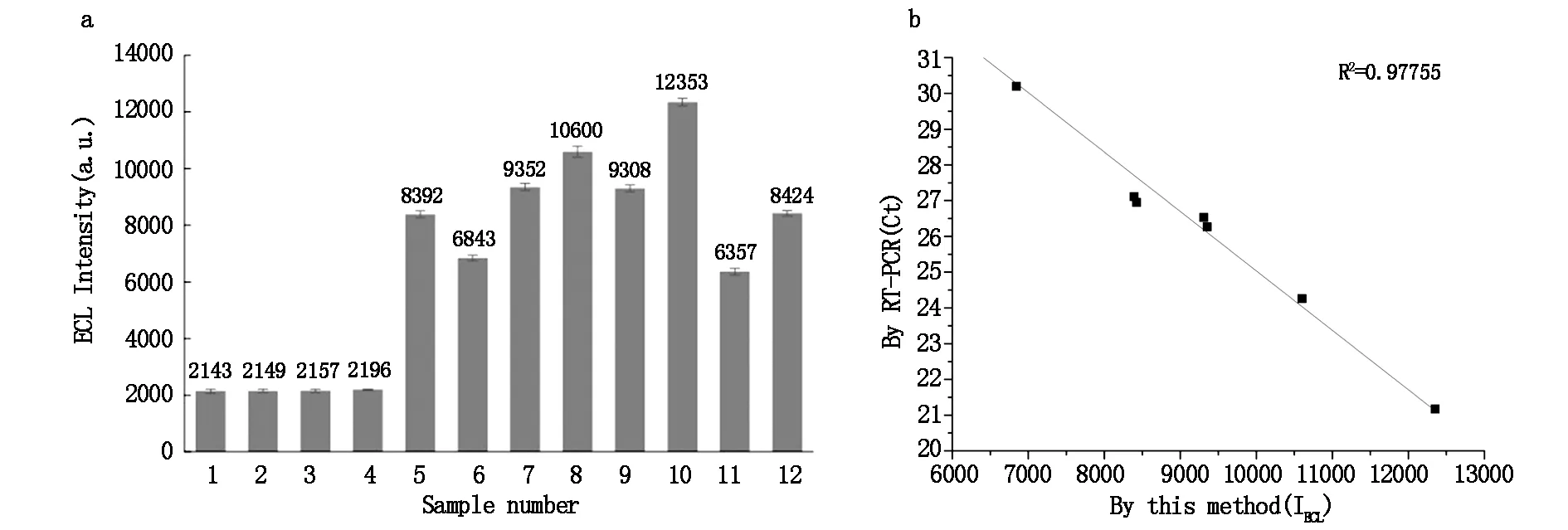
1:空白,2:阴性对照,3:HPV 18型阳性样本;4:HPV 52型阳性样本;5~12:HPV 16型阳性样本a:1~4#样本比较P>0.05,差异无统计学意义;5~12#样本与1#样本比较P<0.05,差异有统计学意义
灵敏度比较:RT-PCR对HPV 16阳性质粒的检出限为8×102copies/mL[18],本法对HPV 16阳性质粒的检出限为50 copies/mL,本法检测灵敏度高16倍。
检测时间比较:浸蜡试纸条的制备、裂解液和洗涤液的配制、RPA反应混合的配制、酯化钌标记引物的过程可提前进行准备,故这部分时间不计算在内。两种方法检测时间见表1,本法从样本核酸提取到得到检测结果时间<1 h,且无需对样本进行复杂的处理、无需复杂的仪器设备,极大的缩短了核酸提取的时间,在病原体即时检测方面具有绝对优势。

表1 本法与RT-PCR法的HPV检测所用时间
3 讨论
常见的HPV高危亚型 HPV16,与宫颈癌的发生密切相关,临床上HPV检测多为分型或定性检测,依赖于专业检测仪器,对实验室环境要求严格,因此,建立HPV 16简便、快速、灵敏、特异的检测方法意义重大。
本研究分别用20∶1和40∶1摩尔比的酯化钌标记氨基修饰引物,用紫外分光光度法和电化学发光法进行钌标引物表征,酯化钌分别在245 nm(金属到配体电荷转移(d →π*))、282 nm(配体内的电荷跃迁(π→ π*))、455 nm(自旋允许的金属到配体电荷转移(d→π*))处有特征吸收峰[16];氨基修饰引物在260 nm(嘌呤环和嘧啶环的共轭双键)处有特征吸收峰。氨基修饰引物通过酰胺键与酯化钌共价结合形成钌标引物复合物,在455 nm处的吸收峰表明酯化钌与氨基修饰引物的结合。根据标记率及电化学发光响应结果,最终采用20倍摩尔比的钌标引物进行后续RPA实验。
本研究利用试纸条提取核酸,通过纸基材料表面的特殊处理,对裂解液和洗涤液的组成成分或pH值、试纸条在3种溶液中的停留时间、提取时的环境温度等因素的优化,在保证模板质量的前提下,大大缩短了样本的检测时间;利用重组聚合酶扩增技术只需一个简单的加热装置即可在20 min内完成扩增,甚至室温条件下也可实现扩增;利用磁性颗粒使生物素-亲和素在近均相的条件下实现快速的反应动力学,通过外加磁场快速高效地富集扩增产物;利用可抛式纸基电极,简化操作步骤,减少试剂(样品)用量,降低检测成本,利用电化学发光高灵敏度、高选择性、动态范围宽、抗干扰能力强的特性[16];最终构建的基于试纸条核酸提取和重组聚合酶扩增技术的纸基电极-电化学发光分析方法,从样本核酸提取到得到检测结果时间<1 h,最低检出限为50 copies/mL,具有较高的特异性、稳定性和灵敏度,对临床宫颈脱落细胞样本HPV检测分析,HPV 16型阳性样本的电化学发光信号强度与阴性样本和其他型阳性样本有显著差异,与RT-PCR结果一致,可用于临床宫颈脱落细胞样本HPV16型检测,在即时检测领域有一定的应用前景。
功能化纳米材料是提高电化学发光强度的有效途径[11,20],后续可发展纳米尺度下石墨烯或贵金属粒子与其他功能材料复合的绿色可控制备技术,通过各组分的协同效应提高传感界面性能,实现核酸高灵敏检测。
