整合素β1在大鼠BMSCs软骨分化过程中的实验研究*
2023-09-25左右清胡熙苒
邓 娟,左右清,王 念,胡熙苒,曾 礼
1.湘潭医卫职业技术学院临床学院,湖南 湘潭 411104;2.中南大学湘雅医学院基础医学院,湖南 长沙 410013
创伤和关节炎等引起的关节软骨缺损性症状给患者的生活质量带来极大的影响,也是骨关节外科目前的难题[1-2]。软骨组织主要成分是水、胶原与蛋白多糖等,其营养主要由周围关节液或下面的骨基质扩散而来,其中无血管无神经无淋巴组织,则限制了软骨再生[3-4]。种子细胞骨髓基质干细胞(bone marrow stem cells,BMSCs)取材方便,来源广泛,且增殖能力强,具有多项分化潜能[5-6]。已有研究显示,外源性诱导因子、物理刺激、仿生支架等技术已成功地将BMSCs诱导成软骨细胞,表达软骨表型或特异性软骨标志[7-8]。本实验旨在利用TGF-β3和抗整合素β1单克隆抗体,分别促进和抑制整合素的表达,研究和探讨整合素β1在大鼠BMSCs诱导软骨分化的过程中的作用及其机制,以期为临床软骨组织的修复和应用提供理论基础和实验依据。
1 资料与方法
1.1 一般资料
健康4 周龄SD 大鼠(180~200 g/只)由中南大学湘雅医学院动物中心提供,实验均在湘雅基础医学院实验中心进行。L-DMEM 培养基(GIBCO,美国),胎牛血清(Fetal bovine serum,FBS)(Hyclone,美国),Dexamethasone 和VitaminC (Sigma,美国),TGF-β3(PEPROTECH,美国),FITC anti-rat CD29 及同型阴性对照和FITC anti-rat CD45 及同型阴性对照(Biolegend,美国),FITC anti-rat CD34 及同型阴性对照(北京博奥森),CD29 单克隆抗体(Biolegend,美国),Col-II 抗体(北京博奥森),IHC 试剂盒(武汉博士德),DAB 显色试剂盒(Pierce,美国),甲苯胺蓝染液(Sigma,美国),预染maker (#SM0671)(Fermentas,美国),变性凝胶电泳(SDS-PAGE)和半干转印所用试剂(Sigma,美国)。
1.2 实验分组
采用全骨髓培养法培养大鼠骨髓基质干细胞,传至第三代首先进行流式细胞仪检测细胞表面CD29、CD34、CD45 的表达情况,得出CD29 的阳性率达99.0%。实验分三组,(1)对照组:以基础培养液(L-DMEM+10%FBS+1%双抗+3%谷氨酰胺)常规培养(5% CO2,37℃)7 d 和14 d。(2)诱导组:在基础培养液中加入TGF-β3(40 ng/mL)、地塞米松(0.1 μmol/L)、胰岛素(6.25 μg/mL)、维生素C(50 μg/mL)。培养条件及时间同上。(3)抑制组:在基础培养液中加入anti-CD29 单克隆抗体(0.1 μg/mL)、地塞米松(0.1 μmol/L)、胰岛素(6.25 μg/mL)、维生素C(50 μg/mL),培养条件及时间同上。
1.3 col-Ⅱ免疫细胞化学染色
分别取诱导7 d 和诱导14 d 的细胞,每组随机抽取2盒。PBS 清洗,甲醛固定,H2O2+纯甲醇浸泡以灭活内源性过氧化物酶,蒸馏水洗1~2次,BSA封闭液。滴加一抗(col-Ⅱ),37℃孵育1 h,PBS 清洗。滴加生物素化山羊抗鼠lgG,20~37℃孵育20 min,PBS清洗。滴加试剂SABC,20~37℃孵育20 min,PBS 清洗。DAB 显色,苏木素轻度复染,依次75%,95%,95%,100%,100%酒精各5 min脱水,二甲苯透明,封片,显微镜观察结果。
1.4 蛋白多糖甲苯胺蓝染色
取诱导14 d 的细胞,每组随机抽取2 盒。PBS 清洗,10%中性甲醛固定,PBS 清洗,加甲苯胺蓝染液(注意加前要把染液过滤,以去除杂质),50 ℃下20~30 min,或者常温下2~4 h。蒸馏水洗2次,把爬片固定在载玻片上。95%酒精分色10 s。PBS 洗2 次,封片,然后显微镜下观察。
1.5 Western Blot检测col-Ⅱ和integrin的表达
取诱导14 d 的细胞,每组随机抽取2 盒。步骤分四步,(1)提取细胞蛋白(冰上操作):用预冷的PBS 洗涤,加入细胞裂解液裂解20 min,刮取转移至1.5 mL Ep 管,静置、涡旋,使充分混匀,高速低温离心机离心,4 ℃下14 000 转/分离心10 min。取上清液并定量取5 μL 按BCA蛋白定量试剂盒说明书操作,在酶标仪上进行蛋白浓度定量。煮样,-20℃保存。(2)SDS-PAGE 电泳:分别配置好分离胶与浓缩胶,蛋白样品按每孔60 μg 上样,电泳槽置于冰盆中(4℃环境),电压30 伏,待蛋白跑出孔,约30 min,调电压60 伏,待蛋白跑进分离胶,约1~2 h。调电压120 伏,电泳1.5~2 h。(3)半干式转印:在转膜槽底部阳极的平板上从下往上依次放置滤纸(三张)-PVDF膜-凝胶-滤纸(三张),以横流转印25~30 min。(4)免疫显色:转印完毕后室温下封闭2 h。将PVDF膜与一抗(兔抗鼠col-Ⅱ,兔抗鼠integinβ1)在4 ℃下孵育过夜,TBST洗膜3次,再与辣根过氧化物酶标记的羊抗兔二抗室温孵育1 h,TBST 洗膜3 次,进行ECL 显色,在暗室中操作,再采用Bio-1D 凝胶成像系统扫描显影的胶片,并用BioCapt 图像分析系统进行定量分析(以平均光密度值Density 表示)。
2 结果
2.1 免疫细胞化学检测col-II的表达
在TGF-β3的作用下,诱导组II 型胶原免疫细胞化学结果显示有部分细胞呈阳性;诱导7 d,可见有软骨细胞分化趋势;诱导14 d,可见多数细胞形态由原来的长形向宽大扁平多角形变化;对照组与抑制组型胶原表达则为阴性,细胞仍为长形或长梭形,见图1。

图1 免疫细胞化学检测col-II的表达
2.2 甲苯胺蓝染色检测蛋白多糖的表达
取诱导14 d 的细胞进行甲苯胺蓝染色检测蛋白多糖,可见诱导组的大部分细胞甲苯胺蓝异染性着色明显,蛋白多糖表达阳性,见图2,左图为×100,右图为×200。

图2 甲苯胺蓝染色检测蛋白多糖的表达
2.3 Western Blot检测col-II蛋白和integrin的表达
诱导组细胞integrin 的表达量均较抑制组、对照组增多,差异有统计学意义(P<0.01),说明细胞膜上的整合素受体被明显下调,TGF-β3提高了整合素受体的表达量,见图3。诱导组col-II 的表达量显著高于抑制组和对照组,差异有统计学意义(P<0.01);对照组和抑制组col-II 的表达量则无明显差异,差异无统计学意义(P>0.05),见图4。
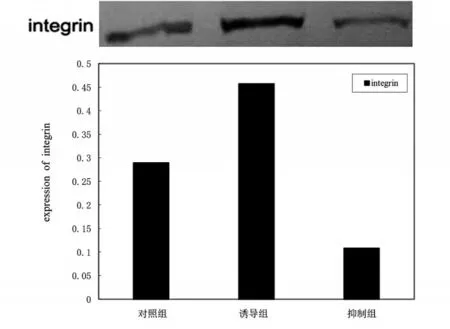
图3 Western Blot 检测integrin的表达

图4 Western Blot 检测col-II的表达
3 讨论
多种原因导致的软骨损伤是临床常见疾病,但软骨组织缺乏神经支配,痛感迟钝,致延误病情,缺乏血管、淋巴,致软骨再生能力差,故易导致损伤进行性加重[9],随着组织工程技术和干细胞研究的不断深入,诱导BMSCs分化为软骨细胞视为目前软骨再生修复的主要方法[10],诱导因子在BMSCs定向软骨分化过程中发挥着重要作用。
整合素是一个受体大家族,由α和β两个亚单位组成,目前已经发现有18 个α 亚基和8 个β 亚基,相互之间以非共价键结合,可以形成24 种有功能的异二聚体跨膜糖蛋白[11],分胞膜外区、胞浆区和跨膜区三部分。细胞外区能结合细胞外基质蛋白,而胞浆区与细胞骨架相互作用介导细胞形态和信号转导。在BMSCs表面表达的主要整合素受体有β1、α1β1、αvβ3、α2、αL、β2、α5β1[12],整合素介导的黏附作用调节着多种细胞功能,包括细胞分化与凋亡、细胞增殖、细胞黏附与迁移,淋巴细胞归巢等[13]。整合素的调节受多种因子的影响,研究最多的是TGF-β、PDGF(血小板衍化生长因子)[14],可以上调整合素的表达,而某些白细胞分泌的蛋白酶抑制物和细胞中抗肿瘤细胞增殖因子TNF(肿瘤坏死因子)、IL(白细胞介素)等以及抗整合素单克隆抗体[15]则可抑制其表达。有研究则表明:在体外用整合素抗体抑制肢芽间充质细胞表面整合素的表达可以抑制肢芽间充质细胞软骨分化[16]。
TGF-β 与生长分化因子(GDF)、骨形态发生蛋白(BMP)均属于TGF 家族,其中TGF-β、BMP 参与软骨与骨的生成调节,而TGF-β 是体外软骨分化的强诱导剂[17]。在人体内存在3种形式的TGF-β,分别是TGF-β1、TGF-β2和TGF-β3,其中TGF-β3诱导成软骨的作用最强,TGF-β2次之,TGF-β1相对最弱,其诱导生成的Ⅱ型胶原和蛋白多糖的表达均比TGF-β1诱导时产生的量多且时间早。TGF-β3促进MSCs向软骨方向分化,在5~40 ng/mL 范围内具有时间浓度依赖性,随着浓度增高和培养时间延长,Ⅱ型胶原的产生逐渐增多;大于40 ng/mL 时,无明显增多甚至减少。本实验采用40 ng/mL 浓度的TGF-β3来进行骨髓基质干细胞的软骨方向诱导。
本研究用10%FBS(胎牛血清)的L-DMEM 培养液(40 ng/mL TGF-β3、地塞米松1×10 mol/L、维生素C50 μg/mL、胰岛素6.25 μg/mL),抑制软骨分化培养液(anti-CD29 单克隆抗体100 ng/mL、地塞米松1×10~7 mol/L、维生素C50 μg/mL、胰岛素6.25 μg/mL),在单层培养条件下对大鼠骨髓基质干细胞进行诱导,诱导1 周时可见Ⅱ型胶原表达,2 周后进行甲苯胺蓝染色检测蛋白多糖的表达,提示有大量蛋白多糖的合成,免疫细胞化学检测Ⅱ型胶原表达增多,且细胞形态由原来的长形或长梭形向扁平宽大多角方向变化,呈现软骨细胞表型,抑制组和对照组检查结果一致。通过Western Blot 实验得到抑制组integrin 表达明显少于诱导组,且几乎不表达II 型胶原蛋白,与对照组结果相近,而诱导组能高表达integrin,同时II型胶原蛋白表达量亦明显增多。结果表明anti-CD29 单克隆抗体能有效抑制integrin 表达水平,从而抑制软骨形成,而TGF-β3能上调integrin的表达,促进软骨分化。
综合以上结果与分析,研究成功用TGF-β3诱导大鼠BMSCs 向软骨细胞分化,表达软骨细胞表型,也利用anti-CD29单克隆抗体抑制integrin表达,抑制了信号转导,从而阻碍软骨分化。研究明确了整合素通路可能是影响软骨分化的重要信号传导途径,为修复软骨缺损奠定了一定的理论基础,但其具体机制还需要进一步的科学研究。
