复方葶苈子汤降低COPD-PAH大鼠肺动脉压的机制研究
2023-09-24刘俊管聘朱俊米
刘俊 管聘 朱俊米
【摘 要】 目的:觀察复方葶苈子汤对COPD-PAH大鼠模型氧化应激的影响探讨其可能的机制。方法:采用随机数表法将50只SD大鼠分为正常组、模型组、中药低剂量组、中药中剂量组和中药高剂量组。每日2次,连续2周,分别予复方葶苈子汤低剂量组、中剂量组和高剂量组。分别检测大鼠肺功能、平均肺动脉压力、超氧化物歧化酶(SOD)活力值、丙二醛(MDA)含量、环磷酸腺苷(cAMP)含量、泛素连接酶2(Siah2)mRNA相对表达量、Siah2、A激酶锚定蛋白(Akap121)的蛋白表达水平以及观察肺组织病理形态变化(HE染色法)。结果:与模型组比较中药各剂量组mPAP下降、血清SOD活力值升高、MDA含量下降、cAMP含量升高、AKAP-121蛋白的表达上调(P<0.05);与低剂量组比较中剂量组mPAP升高、血清中SOD活力值升高、MDA含量下降、cAMP含量升高、AKAP-121蛋白的表达上调(P<0.05);与中剂量组比较,高剂量组mPAP降低、SOD活力值升高、MDA含量高剂量组下降、cAMP含量升高、AKAP-121蛋白的表达上调(P<0.05)。结论:复方葶苈子汤可有效降低慢阻肺相关性肺动脉高压大鼠的平均肺动脉压。复方葶苈子汤可以提高大鼠血清中cAMP的含量,可上调血清中SOD活力值对抗COPD大鼠缺氧状态下产生的ROS,降低氧化应激对大鼠肺动脉的影响,减少氧化应激产物MDA的产生。本实验中血清中cAMP含量升高与药物剂量呈正相关,血清中cAMP含量越高Siah2的表达水平下降越明显,AKAP121降解得越少。肺组织中肺动脉血管管壁变薄程度、官腔增大程度与cAMP含量呈正相关。这表明复方葶苈子汤可通过调控cAMP-Siah2-AKAP121通路,减少氧化应激对COPD-PAH大鼠的肺血管壁的损伤,降低肺动脉压。
【关键词】 复方葶苈子;氧化应激;慢性阻塞性肺疾病;肺动脉高压
【中图分类号】R285.5 【文献标志码】A 【文章编号】1007-8517(2023)14-0024-06
DOI:10.3969/j.issn.1007-8517.2023.13.zgmzmjyyzz202314007
Abstract:Objective To observe the effect of compound Tinglizi Decoction on oxidative stress in copd-pah rat model and explore its possible mechanism.Methods 50 SD rats were divided into normal group,model group,low dose group,medium dose group and high dose group by random number table. Two times a day for two weeks,the low-dose group,the middle dose group and the high-dose group of compound Tinglizi Decoction were given respectively. The pulmonary function,mean pulmonary artery pressure,superoxide dismutase (SOD) activity value,malondialdehyde (MDA) content,cyclic adenosine monophosphate (cAMP) content,relative expression of ubiquitin ligase 2 (siah2) mRNA,siah2,A-kinase anchor protein (akap121) protein expression level and pathological changes of lung tissue were detected respectively. Results Compared with the model group,mPAP in each dose group of Chinese medicine decreased Serum SOD activity increased,MDA content decreased,cAMP content increased,and akap-121 protein expression was up-regulated (P<0.05); Compared with the low dose group,the middle dose group had higher mPAP,higher SOD activity,lower MDA content,higher cAMP content and up-regulated expression of akap-121 protein (P<0.05); Compared with the middle dose group,the high dose group had lower mPAP,higher SOD activity,lower MDA content,higher cAMP content and higher expression of akap-121 protein (P<0.05).Conclusion Compound Tinglizi decoction can effectively reduce the mean pulmonary artery pressure in rats with chronic obstructive pulmonary hypertension.Compound Tinglizi decoction can increase the content of camp in rat serum,increase the activity of SOD in serum,fight against ROS produced by COPD rats under hypoxia,reduce the effect of oxidative stress on rat pulmonary artery,and reduce the production of oxidative stress product MDA. In this experiment,the increase of cAMP content in serum was positively correlated with the drug dose. The higher the cAMP content in serum,the more obvious the decrease of siah2 expression level,and the less the degradation of akap121. There was a positive correlation between the degree of thinning of the pulmonary artery wall and the degree of enlargement of the lumen and the content of camp. This indicates that compound Tinglizi decoction can reduce the damage of oxidative stress to the pulmonary vascular wall of copd-pah rats and reduce the pulmonary artery pressure by regulating camp-siah2-akap121 pathway.
Keywords:Compound Amaranth; Oxidative Stress; Chronic Obstructive Pulmonary Disease; Pulmonary Hypertension
肺动脉高压(pulmonary hypertension,PAH)是以肺中血管重构,肺血管收缩反应性增强导致平滑肌增厚,进而引起管腔狭窄及机化导致肺动脉压持续性升高的病理过程。PAH发病机制非常复杂,肺血管的功能结构受到多种细胞因子、离子通路、信号通路的影响[1-2]。慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)阻塞气流使机体长期处于低氧状态,这种低氧状态可刺激多种信号分子及相关通路对肺血管产生影响,改变肺血管的结构和功能,发展成慢性阻塞性肺疾病相关性肺动脉高压(COPD relatedpulmonaryarterial hypertension,COPD-PAH)。深入研究COPD-PAH发病机制及有效的治疗手段,有益于指导临床上防治肺心病。氧化应激近年来已成为PAH发病机制中研究最热的学说之一[3-4]。研究[5]显示,氧化应激可通过多种途径参与肺动脉血管重构加速PAH的进展。有实验[6-7]表明抗氧化治疗,可抑制肺动脉血管重塑及减轻肺循环压力,这表明氧化应激是肺动脉高压形成的重要因素。本课题柏正平教授根据多年临床经验及COPD-PAH中医病机原理,根据“饮瘀同治”的治则创立了复方葶苈子汤。研究显示复方葶苈子汤可明显改善COPD-PAH患者临床症状及减少急性发病次数,动物实验[8-10]證实复方葶苈子汤可降低肺动脉高压,增强肺血管顺应性,改善肺血管重塑。但作用机制并不明确,由此,我们推测复方葶苈子汤可能通过调控的氧化应激通路影响COPD-PAH的发展。
1 实验材料
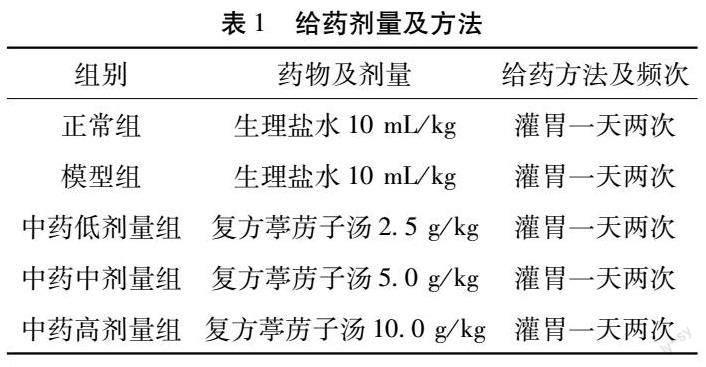
1.1 实验动物及实验条件 清洁级雄性SD大鼠50只,鼠龄10~12周,体重(230±20)g,由湖南省中医药研究院动物房,统一向湖南莱斯克实验动物中心采购[SYXK(湘)2019-0017]。饲养环境保持温度22~26 ℃,控制相对湿度40%RH~70%RH环境,8~12 h通风换气1次,采用高温高压灭菌饲料及纯净水饲喂。
1.2 实验药品 复方葶苈子汤,处方组成:葶苈子15 g,黄芩10 g,桃仁10 g,红花10 g,水蛭6 g,川芎15 g,茯苓15 g,桂枝15 g,白术15 g,矮地茶15 g,甘草6 g。
中药采用湖南省中医药研究院附属医院颗粒剂(四川新绿色药业科技发展有限公司生产)。给药剂量参考人和动物体表面积折算的等效剂量比率表,大鼠等效剂量相当于人的6.3倍。每只动物每千克按临床人(70 kg)的等效剂量为中剂量,0.5倍等效剂量为低剂量,2倍等效剂量为高剂量,故低剂量组、中剂量组、高剂量组生药量分别为 2.56 g/kg、5.13 g/kg、10.26 g/kg。
2 实验方法
2.1 实验动物分组 将清洁级雄性SD大鼠50只随机分为5组,每组10只,于右耳相同位置打记号钉标记,分为正常组、模型组、低剂量组、中剂量组、高剂量组,每组10只大鼠,依次编号并标记。
2.2 模型制备 正常组:大鼠饲养在室温条件22~26 ℃,相对湿度40%RH~70%RH环境中,饲料予高温消毒灭菌,不予熏烟、气管切开滴入脂多糖等操作,灌胃期间给与等剂量的生理盐水,灌胃剂量10 mL/kg/d。模型组:造模方法同舒家泽等[11]采取熏烟、气管暴露滴入脂多糖诱发气道炎症反应制作慢阻肺相关性肺动脉高压模型。造模期间(d1~d60),每日熏烟4 h。第1天水合氯醛腹腔注射麻醉后,固定大鼠,备皮,切开颈部皮肤,钝性分离出气管,肉眼下用眼科剪,斜45°气管剪开小口。然后用1 mL注射器滴入浓度1 mg/mL脂多糖0.2 mL,竖起固定夹板轻摇,使其充分进入肺部。最后缝合颈部皮肤。第14天重复第1天操作,手术当天不予熏烟处理。中药(复方葶苈子汤)高、中、低剂量组的大鼠处理同模型组。
烟熏造模结束后次日开始灌胃,连续灌胃14 d。
2.3 大鼠肺功能测定及肺动脉压测定
2.3.1 检测大鼠肺功能 取仰卧位气管插管,将大鼠放置于小动物肺功能检测仪内,然后记录相关肺功能指标包括肺活量(FVC)、0.3秒用力呼气量(FEV0.3)和FEV0.3/FVC。以验证慢性阻塞性肺疾病模型建立成功。
2.3.2 检测平均肺动脉压 测定平均肺动脉压(mPAP)术前12 h大鼠禁食无需禁水。给予质量分数10%水合氯醛腹腔注射麻醉,剂量按0.3 mL/100 g计算,麻醉后固定大鼠,沿颈部正中切开皮肤,钝性分离出右侧颈内静脉。将抗凝处理后的导管从颈内静脉进入,到达肺动脉后固定,活动端连接压力换能器,接入心电监护系统,待肺动脉压力波形稳定后,根据监视器所示的压力波形图多次记录肺动脉压,计算平均肺动脉压(mPAP)。
2.4 实验动物处理、取材及标本制备
2.4.1 苏木素-伊红(hematoxylin-eosin,HE)染色 平均肺动脉压检测完后,麻醉状态下,沿前正中线剪开大鼠,用真空采血管采集腹主动脉血,随后剖取肺组织,取右肺相同部位用生理盐水冲洗,并用4%多聚甲醛固定备用;剩余部分肺组织置于生理盐水中保存。多聚甲醛固定的肺组织按矢状面取材,用酒精脱水,再用苏木素浸染45 s,冲洗10 min去除多余染色液。然后选择无水乙醇脱洗,使用伊红染色液染色10 s。再行组织切片、脱水和包埋。4 μm连续切片,60 ℃烤干。然后脱蜡、水化后HE染色。标本于200倍光学显微镜下观察。
2.5 检测血清中氧化应激因子 黄嘌呤氧化酶法检测大鼠血清中超氧化物歧化酶(Superoxide Dismutase,SOD)活力值,按照SOD检测试剂盒说明书操作,加入待测样本、蒸馏水、酶工作液、酶稀释液、底物应用液,混匀,孵育20 min,450 nm处用酶标仪读数。按照如下公式计算SOD抑制率和SOD活力值。
2.6 Elisa检测血清中环磷酸腺苷(cAMP)的含量 通过腹主动脉采血获取的大鼠血清样品首先置于4 ℃冰箱中过夜保存,次日于台式冷冻离心机上进行离心处理。1000 g离心15 min,温度6 ℃,随后取上清液检测备用。于室温(约24 ℃)条件下配制洗液,并提前取出酶标板放置30 min。按照顺序依次加入标准品和样品溶液,PBS作为空白对照,加入体积100 μL。然后分别向各孔中加入50 μL的酶标记溶液(注:空白对照孔不加),随后用封板膜密封酶标板后置于37 ℃孵育箱中孵育1小时。取出酶标板用浓缩洗涤液清洗酶标板5次,保持各孔水压,先后加入显色剂A 50 μL及显示剂B 50 μL。并于37 ℃避光条件下反应20 min后加终止液50 μL以终止反应,读取并记录OD值。然后采用 Curve Expert曲线分析软件作曲线,以标准品浓度为纵坐标,OD值为横坐标。根据提示计算标准曲线方程,代入OD值以计算样本浓度。
2.7 定量PCR检测 取Trizol保存肺组织约0.02 g,于通风橱内加Trizol充分研磨,室温下裂解5 min。随后加入三氯甲烷200 μL,剧烈振荡15 s,室温静置3 min。离心机转速200HZ,控制温度于4 ℃,离心15 min后将上层液相转移到新的RNase-Free离心管中。加入等体积的异丙醇混匀,室温静置10 min。再将新离心管以200 HZ,4 ℃环境离心10 min去上清,加无菌DEPC水配制的75%乙醇,洗涤沉淀。再一次以200 HZ,4 ℃环境离心3 min去上清。干燥5~10 min。加入20~30 μL无菌无酶水溶解沉淀。最后用紫外分光光度计测定浓度,在260 nm与280 nm处测其吸光度值,计算其浓度跟纯度。
2.8 Western Blot检测蛋白表达 剪取约0.025 g组织样品,用预冷的PBS洗涤一次,加入300 μL的RIPA裂解液,用生物匀质仪调匀,冰上裂解10 min,4 ℃,200 HZ离心15 min。将离心后的上清液转移到1.5 mL的离心管中备用。按照分子量分别切胶,将6张与胶同样大小的滤纸和1张NC膜,一起浸入转膜缓冲液中。按照滤纸,NC膜,胶,滤纸的顺序依次放好。盖上仪器,接通电源,300 mA恒定电流转膜,各指标及转膜所需时间见抗体信息。转膜之后取出于置于1*PBST中洗1次。通过一抗孵育、二抗孵育,用1*PBST稀释HRP标记的二抗,按照如下比例稀释后与膜共同室温孵育90 min。孵育结束后1*PBST洗3次,每次15 min。
3 统计分析
各分组所得计量数据采用均数加减标准差(x±s)表示,采用 SPSS 22.0统计软件处理数据,各组间比较采用单因素方差分析,P<0.05表示有统计学意义。
4 实验结果
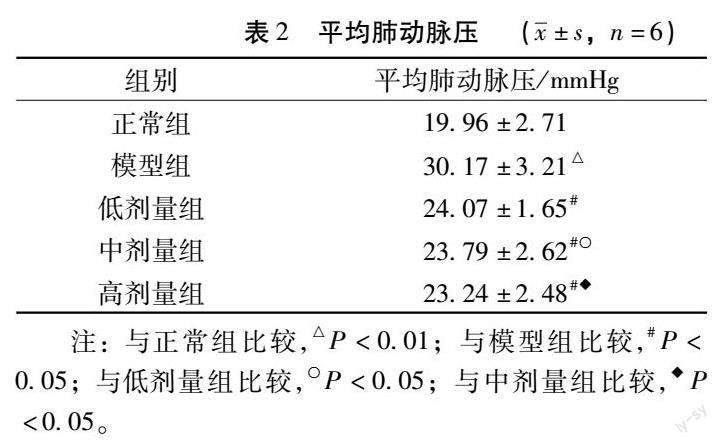
4.1 大鼠的平均肺动脉压(mPAP) 与正常组比较,模型组及中药各剂量组的mPAP均升高(P<0.05);与模型组比较,中药各剂量组mPAP下降(P<0.05);与低剂量组比较,中剂量组mPAP升高;与中剂量组比较,高剂量组大鼠mPAP降低(P<0.05)。详见表2。
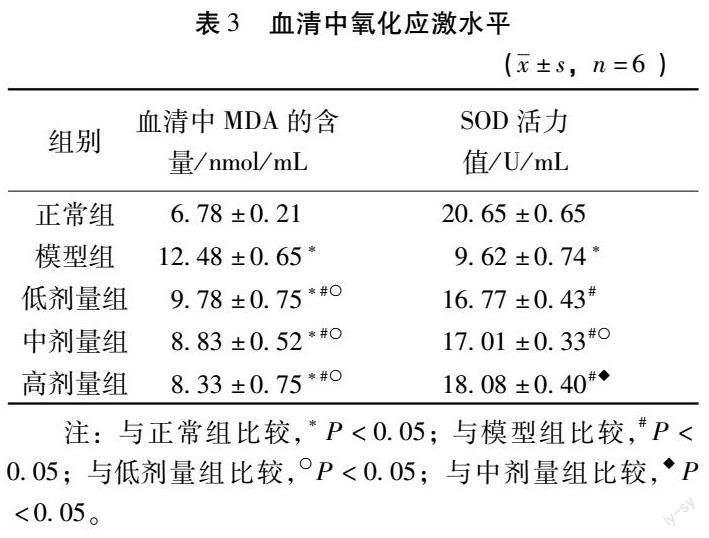
4.2 大鼠血清中氧化应激水平 与正常组比较,模型组的血清SOD活力值下降(P<0.05);与模型组比较,中药各剂量组血清SOD活力值升高(P<0.05);与低剂量组比较,中剂量组血清中SOD活力值升高(P<0.05);与中剂量组比较,高剂量组SOD活力值升高(P<0.05)。与正常组比较,模型组及中药各剂量组血清中MDA含量升高(P<0.05);与模型组比较,中药各剂量组血清中MDA含量下降(P<0.05);与低剂量组比较,中剂量组血清MDA含量下降(P<0.05);与中剂量组比较,高剂量组血清MDA含量下降(P<0.05)。详见表3。
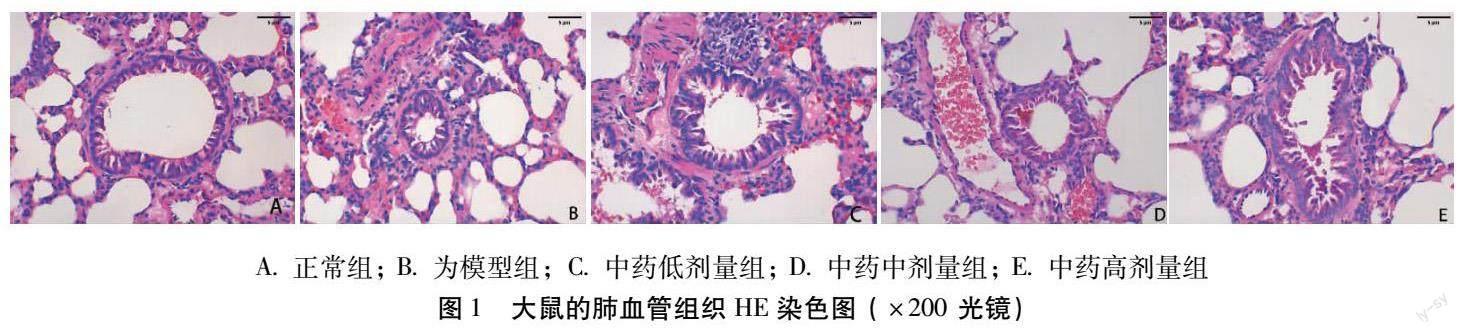
4.3 大鼠的肺血管组织学改变 HE染色后,于200倍光学显微镜下观察可见,正常组的肺血管内皮连续、管壁薄而均匀、管腔较大且通畅。COPD-PAH模型大鼠的肺血管的内皮不连续,管壁增厚、管腔狭窄血管重构较明显(如图1B)。与模型组比较大鼠的肺组织中血管壁变薄、官腔变大,其血管壁变薄及官腔变大程度与药物剂量呈正相关。
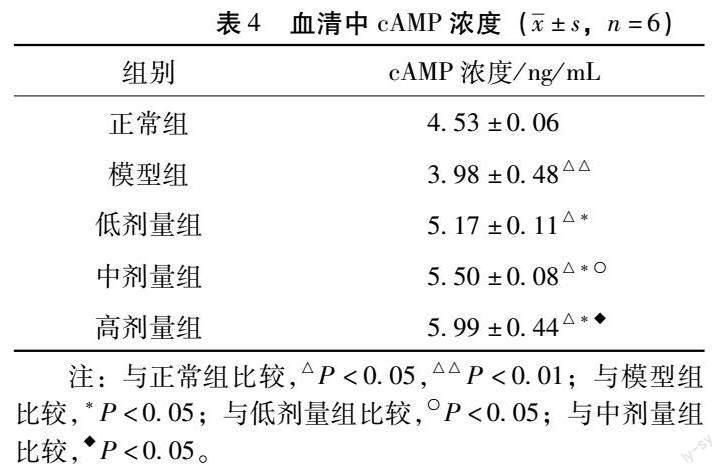
4.4 大鼠血清中cAMP含量 与正常组比较,模型组血清中cAMP含量下降(P<0.01),中药各剂量组血清中cAMP含量升高(P<0.05);与模型组比较中药各剂量组血清中cAMP含量升高(P<0.05);与低剂量组比较中剂量组血清中cAMP含量升高;与中剂量组比较高剂量组血清cAMP含量升高(P<0.05)。见表4。
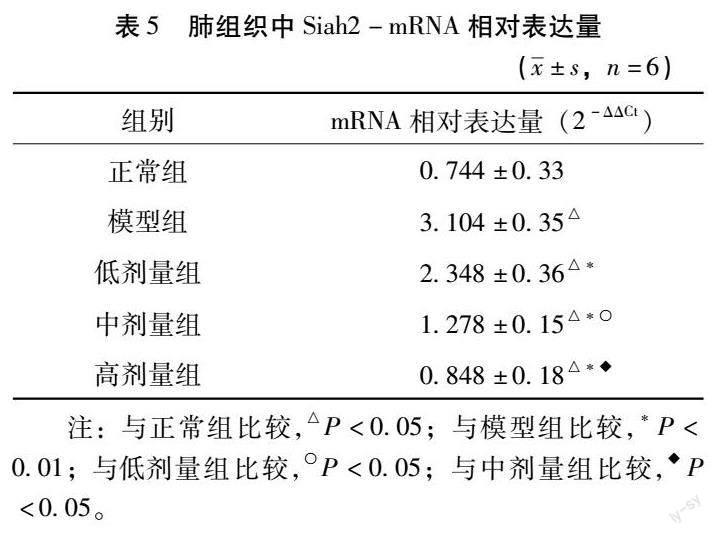
4.5 Siah2-mRNA相对表达量 与正常组比较,模型肺组织中mRNA相对表达量升高(P<0.05);与模型组比较,中药各剂量组的肺组织中mRNA相對表达量下降(P<0.01);与低剂量组比较,中剂量组mRNA相对表达量下降;与中剂量组比较,高剂量组mRNA相对表达量下降(P<0.05)。见表5。
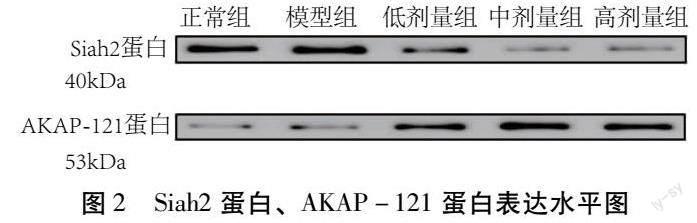
4.6 Western Blot 检测蛋白表达水平 与正常组比较,模型组的Siah2蛋白表达增大;中药各组Siah2蛋白表达均少于正常组及模型组;中药各组大鼠的肺组织中AKAP-121蛋白的表达均明显上调。如图2所示。
5 讨论
本课题组提出饮瘀同治法自拟复方葶苈子汤;葶苈子通脉平喘,作为君药;桂枝、茯苓、白术、甘草取苓桂术甘汤之意以温化痰饮共为臣药;桃仁、红花、水蛭为活血祛瘀,矮地茶止咳平喘均为佐药,黄芩清热泄肺为使药。现代药理学研究发现葶苈子中有效成分可降低肺循环压力,减轻肺瘀血,亦可解痉平喘[12]。还有强心、扩张血管的作用,对肺动脉高压引起的肺心病均具有较好的疗效[13] 。
氧化应激(oxidative stess,OS),是指机体组织或细胞内的氧自由基生成增加或清除能力降低,导致活性氧簇(reactive oxygen species, ROS)在组织或细胞内蓄积而引起的氧化损伤过程。当肺组织里抗氧化应激的能力下降不足以应付氧化应激因子的攻击时常导致肺组织和肺血管的损伤[14]。超氧化物歧化酶(superoxide dismutase, SOD)是一种在机体抗氧化的关键生物酶。氧化应激是肺动脉高压始动因素之一,氧自由基本身及相关产物可损害肺动脉血管的上皮组织,引起肺血管壁细胞的纤维化,肺血管的增厚导致肺动脉高压形成。环磷酸腺苷(cyclic adenosine monophosphate,cAMP)参与多种细胞功能的生理调节。Carly Jones等[15]发现,cAMP在肺动脉高压患者的血清中表达上调,而且细胞外cAMP通路的激活可以抑制肺血管细胞的增殖和肺血管重塑,缓解肺动脉高压的进展。Siah2(siah E3 ubiquitin protein ligase 2)是泛素连接酶家族的重要成员。研究发现,Siah2与细胞缺氧下的线粒体功能密切相关,主要是因为缺氧会刺激细胞内糖酵解的发生,稳定缺氧诱导因子(hypoxia-inducible factor ,HIF)及其控制相关基因的表达(如Glut1、PDK1),而Siah2通过调节生理性缺氧下脯氨酰羟化酶的稳定性来激活HIF,从而间接地调节线粒体的功能[16-17]。另一方面,线粒体A激酶锚定蛋白(AKAPs)为一个独特的蛋白家族,它们与线粒体外膜结合并靶向蛋白激酶A(PKA)[18]。根据C端结构的不同,AKAPs中的AKAP-121在氧化代谢和细胞存活中发挥重要作用。当敲降细胞的AKAP-121的表达会出现严重的线粒体结构异常、活性氧的产生增加及线粒体功能的下降等,与肺心病的进展密切相关[19-20]。
丙二醛(malonic dialdehyde,MDA)是体内自由基与不饱和脂肪酸氧化后的终产物,可反应氧化应激反应对机体细胞的损伤程度,MDA本身还可对线粒体多种酶活性产生影响。实验结果表明,模型组血清中MDA含量明显高于正常组,说明在慢性阻塞性肺疾病相关的模型中机体内慢性缺氧状态可导致氧化应激水平的上调。灌服复方葶苈子汤低、中和高各剂量组的大鼠血清中MDA含量均明显降低,表明复方葶苈子汤中某些成分可抑制缺氧状态下氧自由基对细胞的损伤。
SOD和cAMP均是抗氧化因子,cAMP还可以对心肌细胞产生保护作用,细胞cAMP通路的激活可以抑制肺血管细胞的增殖和肺血管重塑,缓解肺动脉高压的进展[28]。我们发现中药各组大鼠血清中SOD和cAMP的含量均高于模型组,这表明复方葶苈子汤中的某些成分可以上调SOD和cAMP的表达以达到对抗氧化应激的作用。
Siah2可与多种底物蛋白特异性结合参与多种信号通路分子的传导调控细胞增殖、分化和凋亡[17]。研究[21]表明AKAP-121表达下调时会出现严重的线粒体结构异常、活性氧的产生增加及线粒体功能的下降等,与肺心病的进展密切相关。而氧化应激可激活Siah2诱导AKAP-121的蛋白酶体迅速降解[22]。实验结果表明,慢阻肺模型大鼠的肺组织中Siah2蛋白表达上调,AKAP-121蛋白表达受到抑制。COPD-PAH模型大鼠的肺组织中的Siah2表达受到抑制下调的程度与复方葶苈子汤的剂量呈正相关,以及 AKAP-121蛋白表达的;HE染色光镜下模型大鼠的肺组织中血管壁增厚,官腔狭窄,复方葶苈子干预后血管壁变薄,官腔相对扩大;模型大鼠的平均肺动脉压较正常组升高,中药干预后可部分降低模型大鼠的平均肺动脉压。因此认为,复方葶苈子汤可能通过调控cAMP-Siah2-AKAP121通路,减少氧化应激对COPD-PAH大鼠的肺血管壁的损伤,降低肺动脉压,为临床上复方葶苈子汤能有效治疗 COPD-PAH 患者提供机制支持。
参考文献
[1]HOOD K Y,MAIR K M,HARVEY A P,et al. Serotonin Signaling Through the 5-HT1 Receptor and NADPH Oxidase 1 in Pulmonary Arterial Hypertension[J]. Arteriosclerosis,Thrombosis,and Vascular Biology,2017,37(7):1361-1370.
[2]SARTORI C,RIMOLDI S F,DUPLAIN H,et al. Developmental Origins of Hypoxic Pulmonary Hypertension and Systemic Vascular Dysfunction: Evidence from Humans[J]. Advances in experimental medicine and biology,2016,903:17-28.
[3] SARTORI C,RIMOLDI S F,REXHAJ E,et al. Epigenetics in Cardiovascular Regulation[J]. Adv Exp Med Biol,2016(903):55-62.
[4]KATO G J,STEINBERG M H,GLADWIN M T. Intravascular hemolysis and the pathophysiology of sickle cell disease[J]. The Journal of clinical investigation,2017,127(3):750-760.
[5] SHAO J,WANG P,LIU A,et al. Punicalagin Prevents Hypoxic Pulmonary Hypertension via Anti-Oxidant Effects in Rats[J]. The American journal of Chinese medicine,2016,44(4):785-801.
[6]WANG R,PAN J,HAN J,et al. Melatonin Attenuates Dasatinib-Aggravated Hypoxic Pulmonary Hypertension via [J]. Frontiers in cardiovascular medicine,2022(9):790921.
[7]JIN H,LIU M,ZHANG X,et al. Grape seed procyanidin extract attenuates hypoxic pulmonary hypertension by inhibiting oxidative stress and pulmonary arterial smooth muscle cells proliferation[J]. The Journal of nutritional biochemistry,2016(36):81-88.
[8]柏正平,卜献春,谭光波,等. 复方葶苈子胶囊治疗肺心病心衰疗效评价及机理探讨[J]. 中国中医药信息杂志,2003(10):2.
[9]柏正平,郑兵. 复方葶苈子胶囊对肺动脉高压和心肌收缩力影响的实验研究[J]. 湖南中医杂志,2000(1):57-58.
[10]刘敏,王启芝,刘雨,等. 复方葶苈子汤改善COPD相关性肺动脉高压大鼠的肺血管重塑的机制研究[J]. 湖南中医大学学报,2022,42(3):380-386.
[11] 舒家泽,卢文菊,李德富,等. 应用烟草烟雾口鼻暴露联合脂多糖方法建造慢性阻塞性肺疾病及相关肺动脉高压小鼠模型[J]. 中華结核和呼吸杂志,2015,38(12):907-911.
[12]徐明,张静,邱建平, 等. 葶苈子的炮制历史沿革及其药理作用研究进展[J]. 中医药导报,2021,27(10):132-137.
[13]ZENG M,LI M,ZHANG L,et al. Different meridian tropism in three Chinese medicines: Tinglizi (Semen Lepidii Apetali),Yiyiren (Semen Coicis),Cheqianzi (Semen Plantaginis)[J]. Journal of traditional Chinese medicine = Chung i tsa chih ying wen pan,2019,39(2):213-220.
[14 ] HALPIN D M G,GRINER G J, PAPI A,et al. Global Initiative for the Diagnosis,Management,and Prevention of Chronic [J]. American journal of respiratory and critical care medicine,2021,203(1):24-36.
[15 ]JONES C,BUENO-Beti C. A novel secreted-cAMP pathway inhibits pulmonary hypertension via a feed-forward mechanism[J]. Cardiovascular research,2020,116(8):1500-1513.
[16]NAKAYAMA K,RONAI Z. The ubiquitin ligase Siah2 and the hypoxia response[J]. Molecular cancer research: MCR,2009,7(4):443-451.
[17]MA B,CHEN Y,CHEN L,et al. Hypoxia regulates Hippo signalling through the SIAH2 ubiquitin E3 ligase[J]. Nature cell biology,2015,17(1):95-103.
[18]SURYAVANSHI S V,MCONNELL B K. Polymorphisms/Mutations in A-Kinase Anchoring Proteins (AKAPs): Role in the Cardiovascular System[J]. Journal of cardiovascular development and disease,2018,5(1):7.
[19]ZHAG J,FENG J,MA D,et al. Neuroprotective Mitochondrial Remodeling by AKAP121/PKA Protects HT22 Cell from Glutamate-Induced Oxidative Stress[J]. Molecular neurobiology,2019,56(8):5586-5607.
[20]CZACHOR A,ATHENA F,LOCKEY R,et al. Pivotal role of AKAP121 in mitochondrial physiology[J]. American journal of physiology, Cell physiology,2016,310(8):C625-C628.
[21]CARLUCCI A,SCORZIELLO A,MARIA J,et al. Proteolysis of AKAP121 regulates mitochondrial activity during cellular hypoxia and brain ischaemia[J]. The EMBO journal,2008,27(7):1073-1084.
(收稿日期:2022-11-07 編辑:刘 斌)
