组蛋白去甲基化酶3调控SESN2介导的线粒体自噬在脓毒症心肌损伤中的机制研究
2023-09-22金光军喻雯赵金凯张建成
金光军 喻雯 赵金凯 张建成
脓毒症是临床上最常见的危重病症[1],全球每年有高达700 万人患脓毒症,且致死率高达40%,在特定的患者群体(如老年人或患有慢性基础疾病的人群)中死亡率甚至高达70%[2]。脓毒症发病机制复杂,是由内部或外部的感染引发的机体免疫功能障碍或凝血功能障碍综合征,最终导致器官组织损伤[3]。在脓毒症导致的多器官功能障碍中,心脏是最易受累的器官之一,约40%的严重脓毒症患者发生心肌损伤[4]。心肌细胞凋亡在脓毒症诱导的心肌损伤过程中起到重要作用。前人的研究表明心肌细胞线粒体损伤在脓毒症诱导的心肌细胞凋亡过程中起关键作用,线粒体自噬是细胞清除受损线粒体的重要机制,此过程受阻会导致受损线粒体在细胞内积累进而导致H2O2等活性氧积累,从而诱导心肌细胞凋亡[5]。因此,线粒体自噬是脓毒症对心肌细胞自救的重要途径,但在此过程中心肌细胞线粒体自噬的诱导机制尚不完全清楚。研究表明,组蛋白去甲基化酶3(jumonji domaincontaining protein 3,JMJD3)是介导免疫细胞激活和炎症细胞因子表达的关键调控因子,SESTRIN 2 蛋白重组蛋白(sestrin 2 recombinant protein,SESN2)是一种新型的应激诱导蛋白,可调节腺苷酸依赖的蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)哺乳动物靶标并抑制氧化损伤。研究发现,JMJD3 通过抑制SESN2 表达介导阿霉素诱导的心肌病[6],但具体机制尚不清楚。因此,本实验旨在探究JMJD3 通过调控SESN2 对脓毒症心肌损伤(sepsis-induced myocardial injury,SIMI)的作用,并分析其机制。
1 材料和方法
1.1 实验动物及细胞 2 月龄SD 雄性大鼠20 只,体重200~250 g,由杭州医学院实验动物中心提供[生产许可证:SCXK(浙)2019-0002],饲养于杭州医学院实验动物中心SPF 级动物房[使用许可证:SYXK(浙)2019-0011]。本实验经浙江省实验动物中心实验动物福利伦理委员会审查通过(批准文号:ZJCLA-IACUC-20010220)。大鼠心肌细胞H9C2(批号:CL-0089)购自普诺赛生命科技有限公司(武汉)。
1.2 试剂及仪器 心肌肌钙蛋白T(cardiac troponin T,cTnT)(批号:ml003374)、TNF-α(批号:ml002859)、IL-6(批号:ml064292)ELISA 检测试剂盒均购自上海酶联生物科技有限公司;脂多糖(lipopolysaccharide,LPS)(批号:L8880)、细胞计数试剂盒-8(cell counting kit-8,CCK-8)(批号:CA1210)均购自北京索莱宝科技有限公司;微管相关蛋白轻链3(light chain 3,LC3)抗体(批号:4108S)、重组人自噬效应蛋白(recombinant Beclin 1,Beclin1)抗体(批号:3495T)、选择性自噬接头蛋白(prostacyclin,p62)抗体(批号:23214S)、B 淋巴细胞 瘤-2(B-cell lymphoma-2,Bcl-2)抗 体(批 号:3869S)、Bcl-2 关联X 基因(Bcl-2-associated X,Bax)抗体(批号:14796S)均购自美国Cell Signaling Technology公司;JMJD3 抗体(批号:ab169197)、SESN2 抗体(批号:ab178518)均购自英国Abcam 公司;JMJD3 表达的小干扰RNA(siRNA-JMJD3,si-JMJD3)和SESN2 表达的小干扰RNA(siRNA-SESN2,si-SESN2)由吉玛基因股份有限公司(苏州)合成,携带JMJD3、SESN2 质粒的腺相关病毒由维真生物科技有限公司(山东)合成。Forma™直热式CO2培养箱购自美国Thermo 公司;微孔板吸光度仪购自美国BIO-RAD 公司;化学发光成像系统(型号:ChemiScope 6200)购自上海勤翔科学仪器有限公司;荧光显微镜购自美国Leica 公司。
1.3 动物分组及模型建立 大鼠适应性喂养1 周,按随机数字表法分为对照组和SIMI 组,每组10 只。LPS粉末溶于0.9%氯化钠溶液,配置成5 mg/mL 溶液,SIMI组大鼠腹腔注射LPS 10 mg/kg(2 mL/kg),对照组大鼠腹腔注射0.9%氯化钠注射液2 ml/kg。12 h 后,采集两组大鼠静脉血,分离血清。然后用正常3 倍剂量的舒泰(150 mg/kg)麻醉处死大鼠,取心脏备用。
1.4 细胞分组及模型制备 H9C2 细胞置于含10%FBS+1%双抗(青/链霉素)的完全培养基中,37 ℃、5% CO2培养箱中培养。细胞实验包括3 个部分。(1)分为对照组和LPS 组两组,LPS 粉末溶于0.9%氯化钠溶液,配置成5 mg/mL 溶液,细胞培养至融合度达60%~70%时,LPS 组使用10 μg/mL(用培养基稀释500 倍)LPS 处理H9C2 细胞48 h 建立脓毒症细胞模型,对照组更换新鲜完全培养基;(2)分为LPS 组、LPS+si-JMJD3 组、LPS+si-JMJD3+si-SESN2 组3 组。利用si-JMJD3、si-SESN2 对 细 胞 中JMJD3 和SESN2 进 行 敲 低。H9C2 细胞按2.5×105个/mL 接种于6 孔板中,在细胞融合度达到60%~80%时,后两组更换为含si-JMJD3 或si-SESN2的无血清培养基,LPS 组更换普通的无血清培养基,转染6 h 后更换完全培养基。(3)分为LPS 组、LPS+SESN2过表达(oe-SESN2)组和LPS+oe-SESN2+JMJD3 过表达(oe-JMJD3)组3 组。利用携带JMJD3、SESN2 质粒的腺相关病毒进行JMJD3 和SESN2 的过表达转染。H9C2细胞按2.5×105个/mL 接种于6 孔板中,在细胞融合度达到60%~80%时,后两组更换为含JMJD3 或SESN2 质粒的腺相关病毒的无血清培养基,LPS 组更换普通的无血清培养基,24 h 后更换为完全培养基。
1.5 大鼠观测指标
1.5.1 组织病理学检测 切取大鼠心脏组织置于4%多聚甲醛中固定24 h,梯度脱水,石蜡包埋。进行HE染色,染色后梯度脱水,二甲苯浸泡,最后将样本切片干燥,封片后在显微镜下观察大鼠心脏组织病理学变化并拍照。
1.5.2 大鼠血清中cTnT、TNF-α 和IL-6 水平检测 采用ELISA 法。根据ELISA 试剂盒操作说明书检测大鼠血清中cTnT、TNF-α 和IL-6 水平。
1.5.3 大鼠心脏组织中JMJD3 和SESN2 蛋白表达水平检测 采用Western blot 法。充分研磨大鼠心脏,使用蛋白裂解液提取心脏组织蛋白,并使用蛋白定量试剂盒完成蛋白定量。在聚丙烯酰氨凝胶电泳中分离等量蛋白质,然后将电泳后的蛋白转移至聚偏二氟乙烯膜上,在5%脱脂牛奶中室温封闭2 h,洗净后加入一抗(JMJD3 和SESN2),4 ℃孵育过夜。将一抗洗净,加入山羊抗兔IgG 二抗,室温下孵育90 min,将二抗洗净,最后利用化学发光成像分析系统收集蛋白条带图像,使用Image J 软件计算各组灰度值。蛋白相对表达水平=各组灰度值/第1 泳道对照组平均灰度值。
1.6 细胞观测指标
1.6.1 细胞活性检测 采用CCK-8 法。H9C2 细胞以5×103个/孔的密度接种在96 孔板中,37 ℃5% CO2培养箱中培养24 h。将CCK-8 试剂添加到孔中继续孵育4 h。使用微孔板吸光度仪检测各组细胞在450 nm波长处吸光度值。结果以细胞活性表述,细胞活性(%)=(实验组-空白组)/(对照组-空白组)×100%。
1.6.2 细胞凋亡水平检测 采用原位末端转移酶标记技术(terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay,TUNEL)染色法。各组H9C2 细胞使用PBS 洗两遍,然后在4%多聚甲醛中室温固定30 min,用70%冷乙醇固定15 min。将细胞置于含0.3% Triton X-100 的PBS 中,在室温下孵育5 min,然后加入TUNEL 染色液,37 ℃黑暗环境中孵育60 min。PBS 洗净,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2- phenylindole,DAPI)染核5 min,PBS 洗净3次,在荧光显微镜下观察并拍照。TUNEL 荧光(红色)强度越强,代表细胞凋亡水平越高。
1.6.3 细胞培养上清液中TNF-α 和IL-6 水平检测采用ELISA 法。收集各组细胞培养上清液,根据ELISA 试剂盒操作说明书检测各组细胞培养上清液中TNF-α 和IL-6 水平。
1.6.4 H9C2 细胞自噬相关蛋白(LC3、Beclin1、p62)、凋亡相关蛋白(Bax、Bcl-2)、JMJD3 和SESN2 蛋白表达水平检测 采用Western blot 法。提取H9C2 细胞蛋白并定量。在聚丙烯酰氨凝胶电泳中分离等量蛋白质,然后将电泳后的蛋白转移至聚偏二氟乙烯膜上,然后在5%脱脂牛奶中室温封闭2 h,洗净后加入一抗(LC3、Beclin1、p62、Bax、Bcl-2、JMJD3 和SESN2),4 ℃孵育过夜。将一抗洗净,加入山羊抗兔IgG 二抗,室温下孵育90 min,将二抗洗净,最后利用化学发光成像分析系统收集蛋白条带图像,使用Image J 软件计算各组灰度值。蛋白相对表达水平=各组灰度值/第1 泳道对照组平均灰度值。
1.7 统计学处理 采用GraphPad Prism 8.0 统计软件。两组比较采用两独立样本t检验;多组间比较采用单因素方差分析,两两比较采用Tukey 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠观测指标结果
2.1.1 两组大鼠心脏组织病理学改变比较 与对照组比较,SIMI 组大鼠心肌纤维束排列松散,部分心肌纤维断裂溶解,伴有间质水肿和炎症细胞浸润,见图1。
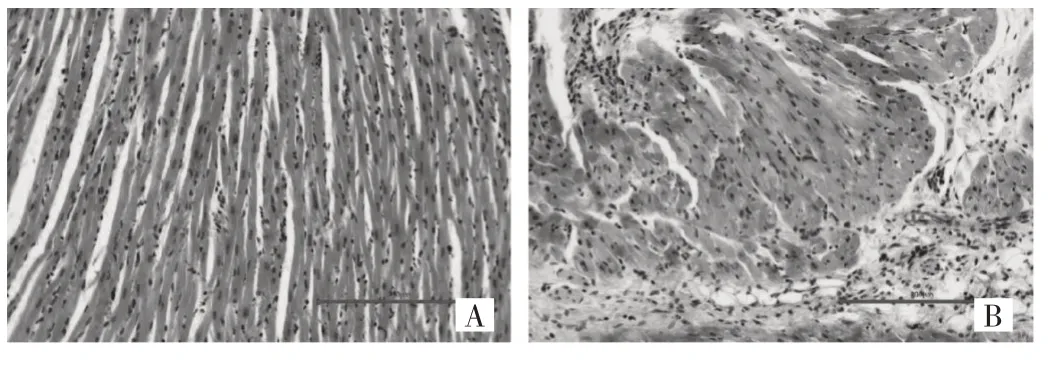
图1 两组大鼠心脏组织病理学切片所见(A:对照组;B:SIMI 组)
2.1.2 两组大鼠血清中cTnT、TNF-α 和IL-6 水平比较 与对照组比较,SIMI 组大鼠血清中cTnT、TNF-α和IL-6 水平均升高(均P<0.01),见图2。
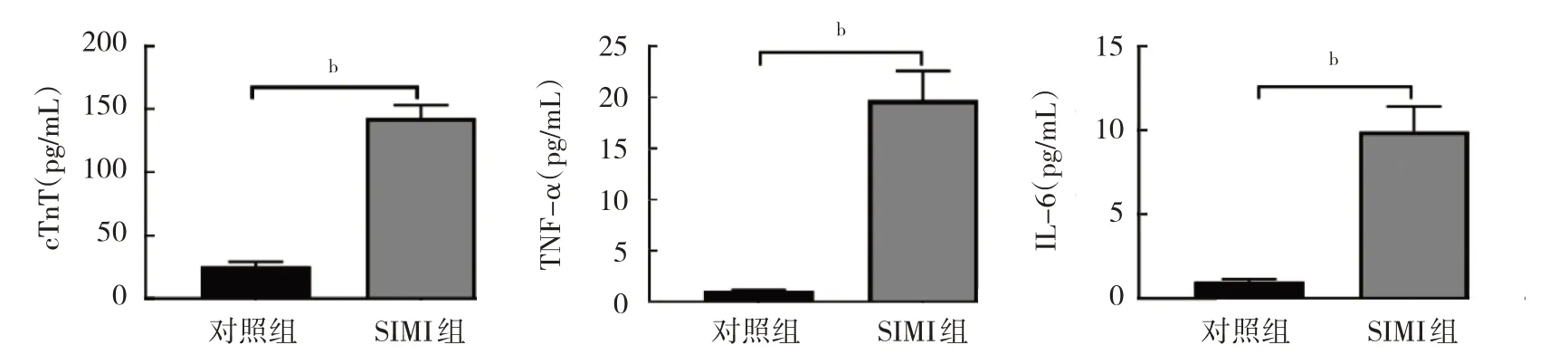
图2 两组大鼠血清中cTnT、TNF-α 和IL-6 水平比较
2.1.3 两组大鼠心脏组织中JMJD3 和SESN2 蛋白表达水平比较 与对照组比较,SIMI 组大鼠心脏组织中JMJD3 蛋白表达水平升高,而SESN2 蛋白表达水平降低,差异均有统计学意义(均P<0.01),见图3。
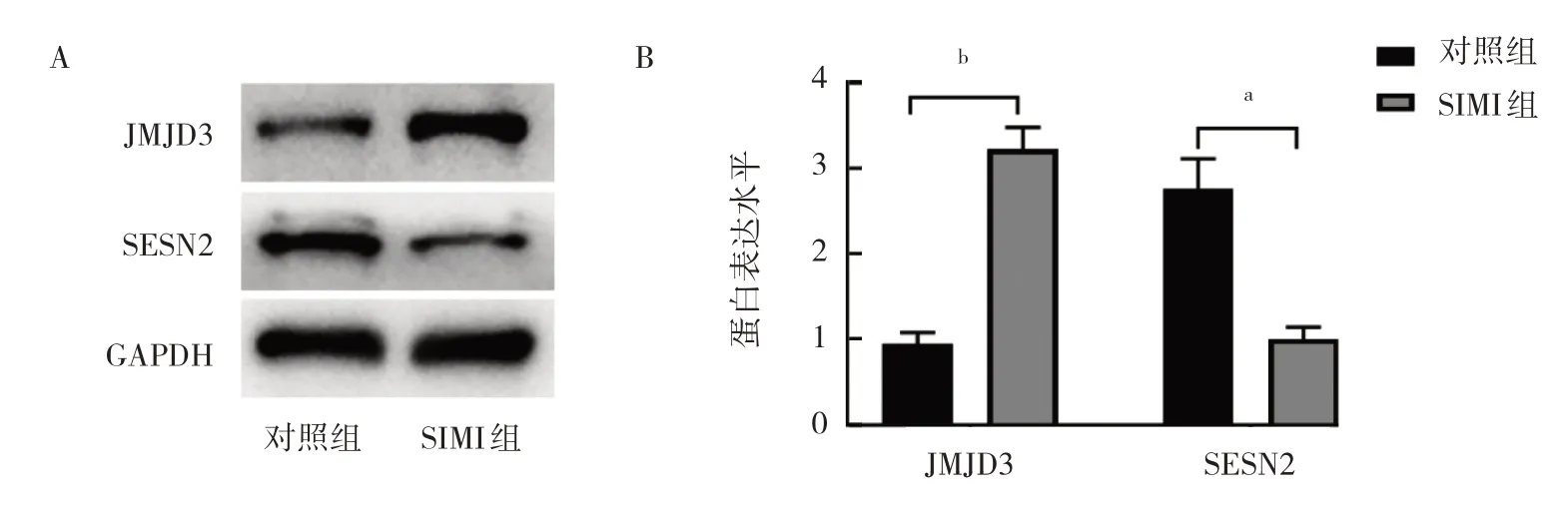
图3 两组大鼠心脏组织中JMJD3 和SESN2 蛋白表达水平比较(A:蛋白表达的电泳图;B:蛋白表达水平的柱状图)
2.2 细胞观测指标结果
2.2.1 脓毒症细胞模型构建指标检测
2.2.1.1 两组细胞活性比较 与对照组比较,LPS 组细胞活性减弱(P<0.05),见图4。
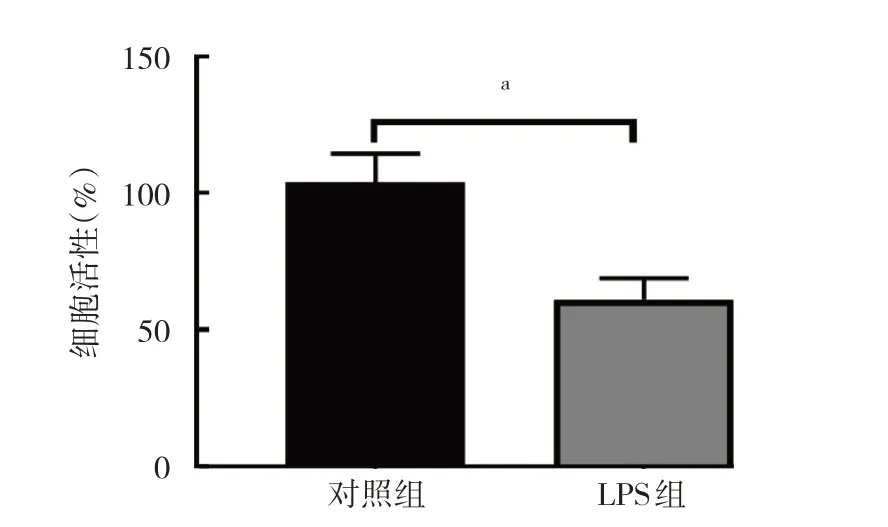
图4 两组细胞活性比较
2.2.1.2 两组细胞凋亡水平比较 与对照组比较,LPS组细胞凋亡水平增加,见图5(插页)。
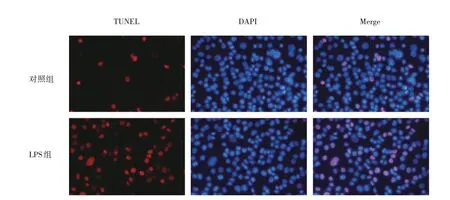
图5 两组细胞凋亡水平比较
2.2.1.3 两组细胞培养上清液TNF-α 和IL-6 水平比较 与对照组比较,LPS 组细胞培养上清液TNF-α 和IL-6 水平均升高(均P<0.01),见图6。较 与对照组比较,LPS 组细胞JMJD3 蛋白表达水平升高,而SESN2 蛋白表达水平降低,差异均有统计学意义(均P<0.01),见图7。
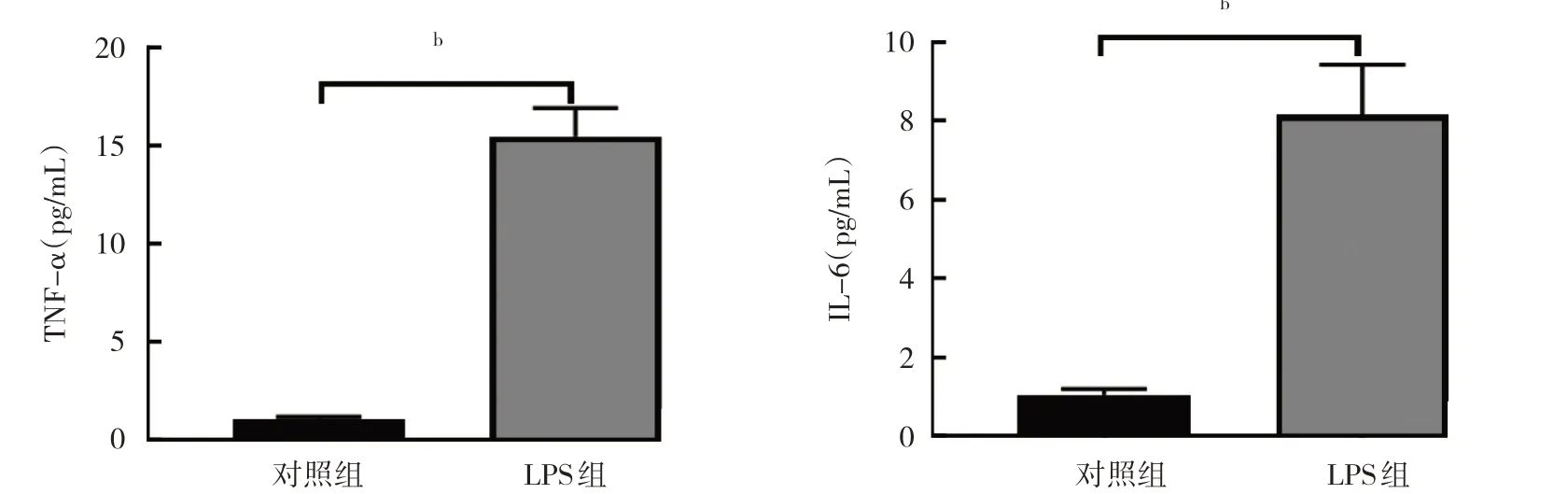
图6 两组细胞培养上清液TNF-α 和IL-6 水平比较
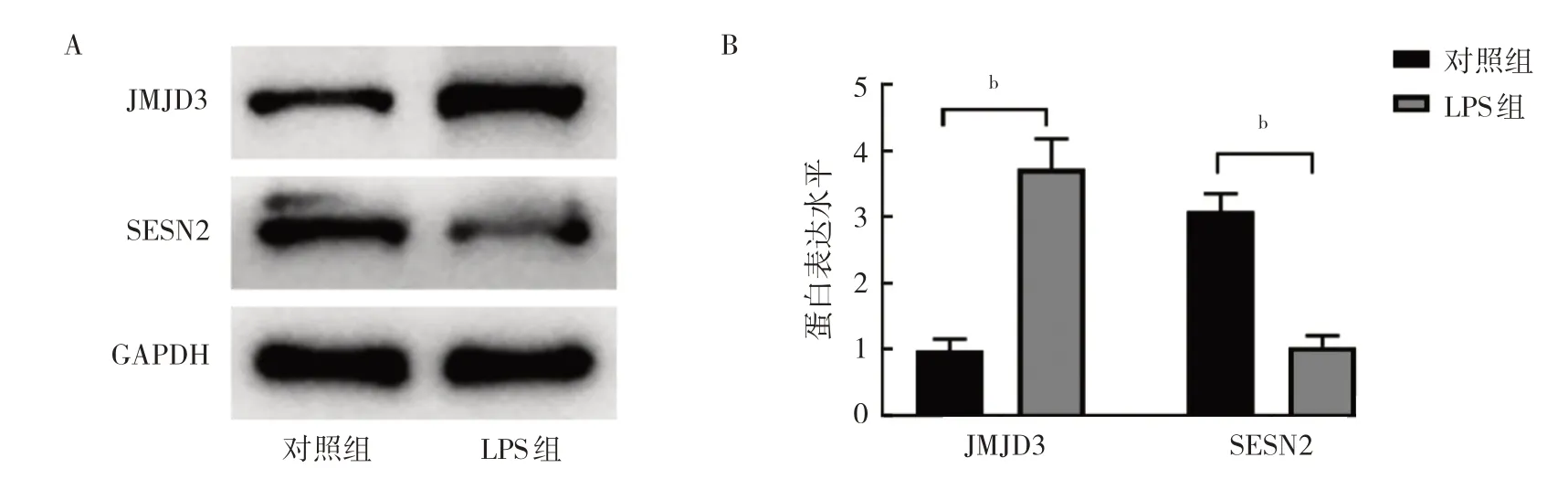
图7 两组细胞JMJD3 和SESN2 蛋白表达水平比较(A:蛋白表达的电泳图;B:蛋白表达水平的柱状图)
2.2.1.4 两组细胞JMJD3 和SESN2 蛋白表达水平比
2.2.2 JMJD3 调控SESN2 影响LPS 诱导的心肌细胞损伤
2.2.2.1 3 组细胞LC3、Beclin1、p62、JMJD3 和SESN2 蛋白表达水平比较 与LPS 组比较,LPS+si-JMJD3 组JMJD3 蛋白表达水平降低,而SESN2 蛋白表达水平升高,同时自噬水平增强(LC3 和Beclin1 蛋白表达水平升高,而p62 蛋白表达水平降低),差异均有统计学意义(均P<0.01)。与LPS+si-JMJD3 组比较,LPS+si-JMJD3+si-SESN2 组进一步下调SESN2 表达,并且减弱了自噬水平,差异均有统计学意义(均P<0.01),见图8。
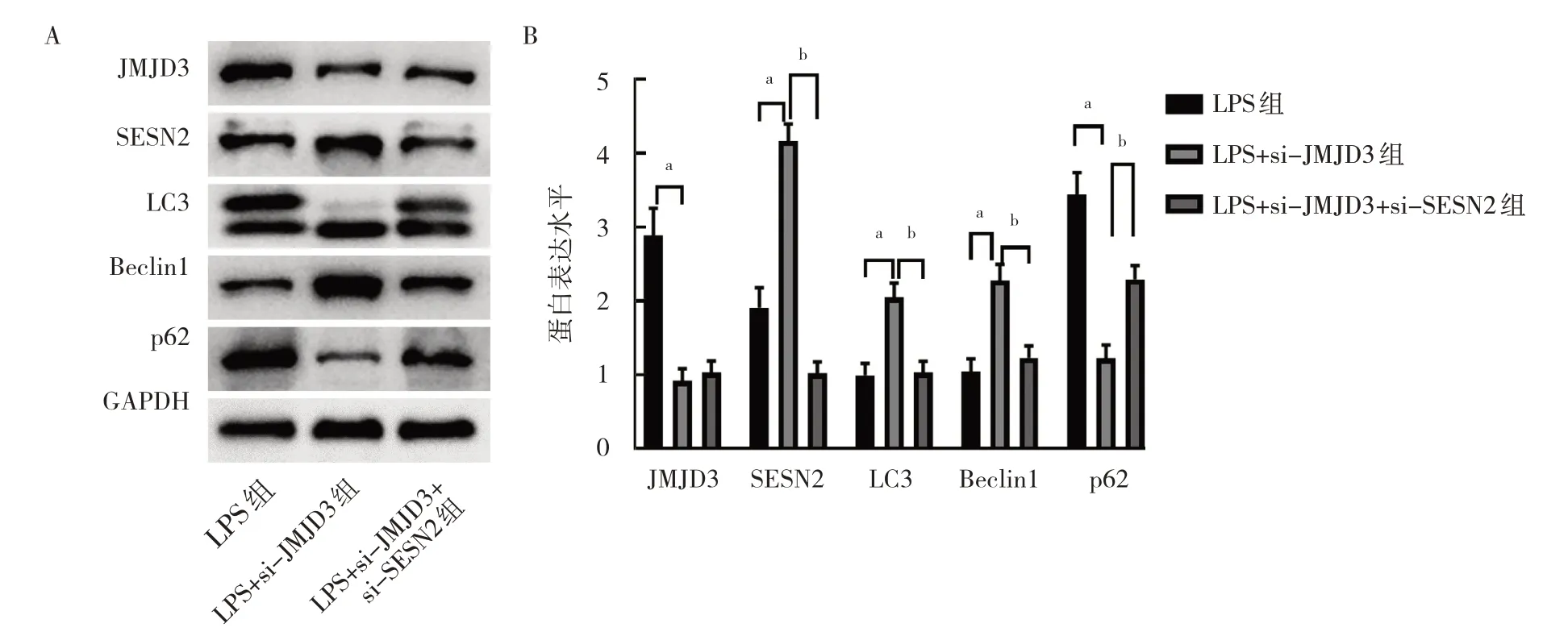
图8 3 组细胞LC3、Beclin1、p62、JMJD3 和SESN2 蛋白表达水平比较(A:蛋白表达的电泳图;B:蛋白表达水平的柱状图)
2.2.2.2 3 组细胞活性比较 与LPS 组比较,LPS+si-JMJD3 组细胞活性增强(P<0.05);而与LPS+si-JMJD3组比较,LPS+si-JMJD3+si-SESN2 组细胞活性减弱(P<0.05),见图9。
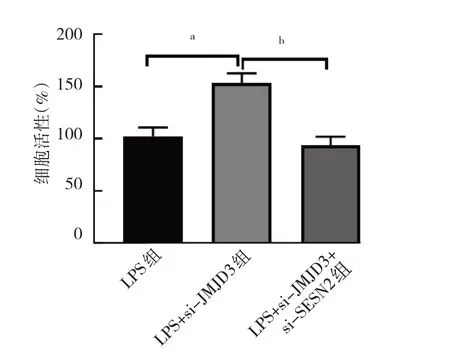
图9 3 组细胞活性比较
2.2.2.3 3 组细胞凋亡水平比较 与LPS 组比较,LPS+si-JMJD3 组细胞凋亡水平减弱;而与LPS+si-JMJD3 组比较,LPS+si-JMJD3+si-SESN2 组细胞凋亡水平增强,见图10(插页)。
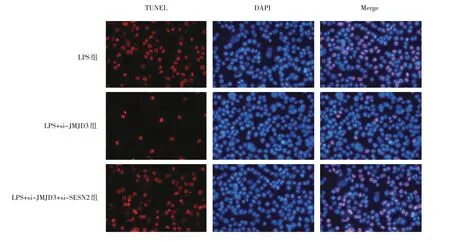
图10 3 组细胞凋亡水平比较
2.2.2.4 3 组细胞Bax 和Bcl-2 蛋白表达水平比较 与LPS 组比较,LPS+si-JMJD3 组Bax 蛋白表达水平降低,Bcl-2 蛋白表达水平增加,差异均有统计学意义(均P<0.01);而与LPS+si-JMJD3 组比较,LPS+si-JMJD3+si-SESN2 组Bax 蛋白表达水平升高,Bcl-2 蛋白表达水平降低,差异均有统计学意义(均P<0.01),见图11。
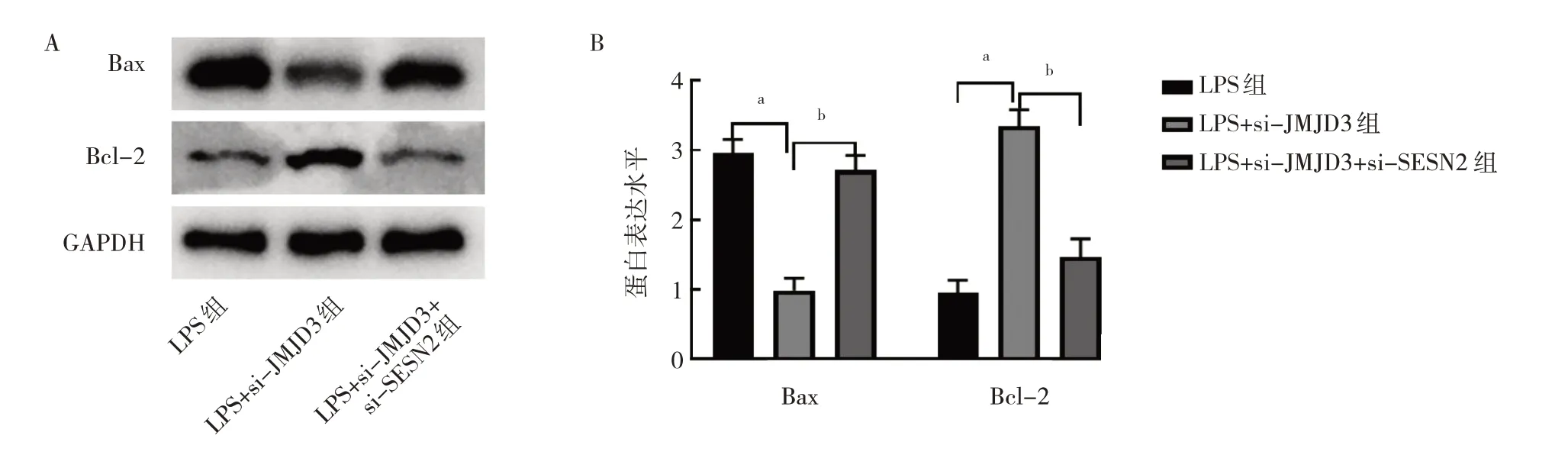
图11 3 组细胞凋亡相关蛋白Bax 和Bcl-2 表达水平比较(A:蛋白表达的电泳图;B:蛋白表达水平柱状图)
2.2.3 JMJD3 调控SESN2 介导的线粒体自噬影响LPS诱导的心肌细胞损伤
2.2.3.1 3 组细胞LC3、Beclin1、p62、Bax、Bcl-2、JMJD3和SESN2 蛋白表达水平比较 与LPS 组比较,LPS+oe-SESN2 组SESN2 蛋白表达水平升高,自噬水平增强(LC3 和Beclin1 蛋白表达水平升高,而p62 蛋白表达水平降低),凋亡水平减弱(Bax 蛋白表达水平降低,Bcl-2 蛋白表达水平升高),差异均有统计学意义(均P<0.01);而与LPS+oe-SESN2 组比较,LPS+oe-SESN2+oe-JMJD3 组JMJD3 蛋白表达水平升高,SESN2 蛋白表达水平降低,自噬水平减弱(LC3 和Beclin1 蛋白表达水平降低,而p62 蛋白表达水平升高),凋亡水平增强(Bax 蛋白表达水平升高,Bcl-2 蛋白表达水平降低),差异均有统计学意义(均P<0.01),见图12。
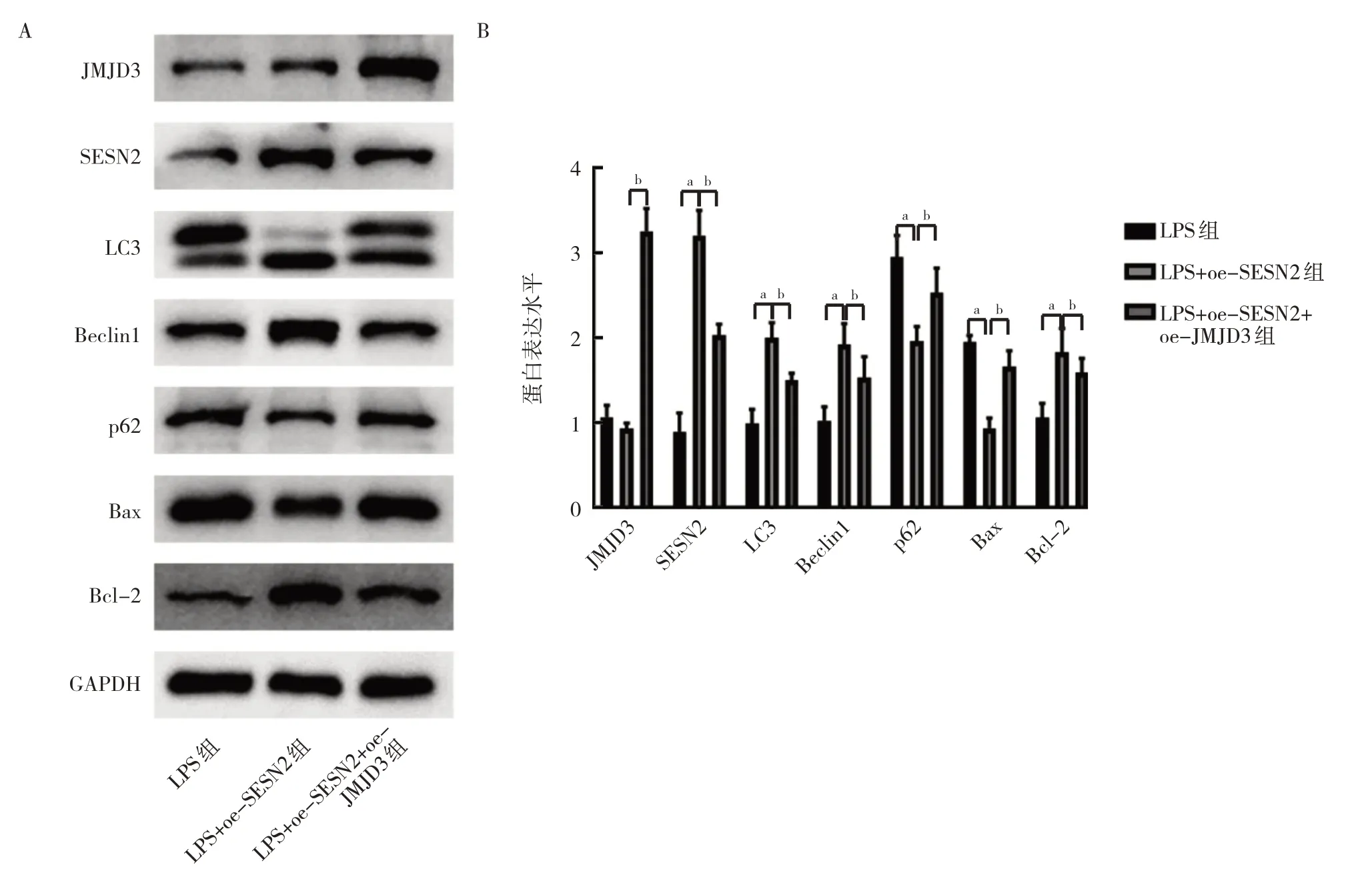
图12 3组细胞LC3、Beclin1、p62、Bax、Bcl2、JMJD3和SESN2蛋白表达水平比较(A:蛋白表达的电泳图;B:蛋白表达水平的柱状图)
2.2.3.2 3 组细胞活性比较 与LPS 组比较,LPS+oe-SESN2 组细胞活性 增强(P<0.01);而与LPS+oe-SESN2 组相比,LPS+oe-SESN2+oe-JMJD3 组细胞活性减弱(均P<0.01),见图13。
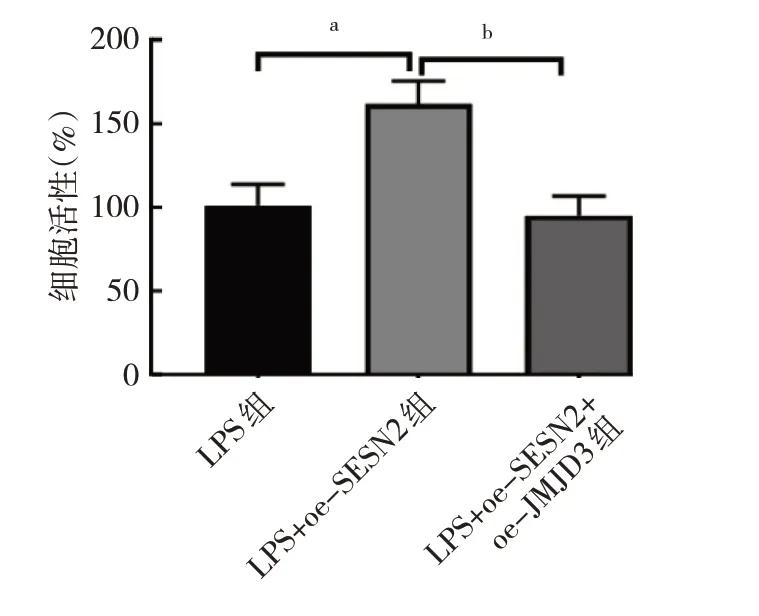
图13 3 组细胞活性比较
2.2.3.3 3 组细胞凋亡水平比较 与LPS 组比较,LPS+oe-SESN2 组凋亡水平减弱;与LPS+oe-SESN2 组比较,LPS+oe-SESN2+oe-JMJD3 组凋亡水平增加,见图14(插页)。
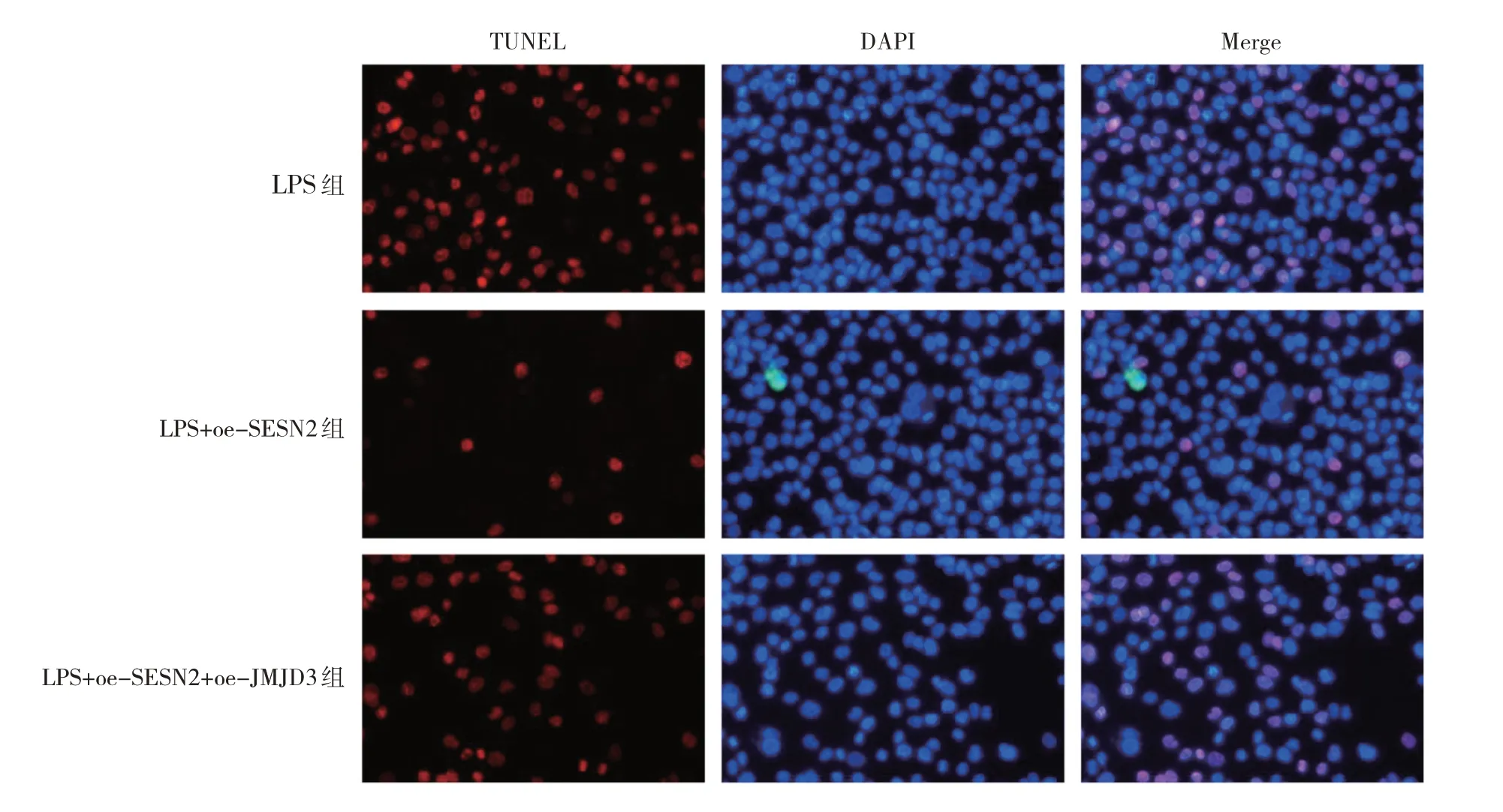
图14 3 组细胞凋亡水平比较
3 讨论
SIMI 是脓毒症多脏器功能障碍的表现之一[7]。本研究发现,SIMI 大鼠的心脏组织发生明显病变,伴有间质水肿和炎症细胞浸润,并且血清cTnT、TNF-α 和IL-6 水平升高。同时,在LPS 诱导的细胞模型中,同样发现细胞活性降低,凋亡水平增强,炎症因子水平升高。本研究成功构建了脓毒症动物和细胞模型。
心脏作为机体最大的耗能器官,其活动的能量需求主要来源于心肌细胞内丰富的线粒体,因此,线粒体功能障碍是脓毒症心肌病的重要原因[8]。心肌线粒体的损伤导致活性氧的过度产生,进一步导致心肌线粒体的结构损伤和功能改变[9]。此外,线粒体内过量的H2O2也是重要的信号因子,不仅会给细胞带来氧化胁迫,还通过激活细胞内的炎症信号通路引起大量的炎症因子释放,进而加重心肌细胞的损伤[10]。线粒体自噬不仅是调节线粒体能量代谢、自我修复和更新的主要机制,也是细胞清除受损线粒体的主要机制[11]。近年研究发现,脓毒症时线粒体自噬对心肌的保护及损伤修复过程具有重要作用[12]。有研究在脓毒症模型鼠中发现施加线粒体自噬抑制剂Bafilomycin 可显著增加细胞内活性氧的积累并加重脓毒症诱导的心肌损伤,而施加线粒体自噬激动剂Urolithin A 可促进线粒体自噬,明显抑制细胞内活性氧的积累并显著减轻脓毒症诱导的心肌损伤,加快心肌损伤后修复[13]。此外,也有研究证实激活AMPK 增加自噬可以减轻LPS 诱导的心肌损伤[9]。因此,有效清除脓毒症时心肌细胞的受损线粒体对降低细胞内活性氧的积累以及减轻心肌损伤具有重要意义。本研究发现,诱导线粒体自噬能够改善LPS 诱导的心肌损伤。
JMJD3 蛋白是一种组蛋白去甲基化酶蛋白,特异性催化甲基化组蛋白H3 赖氨酸27(trimethylation of lysine 27 on histone H3,H3K27)的去甲基化并调节基因表达[14]。有报道表明脓毒症心肌细胞中的H3K27 甲基化修饰水平降低[15],提示JMJD3 可能通过影响心肌细胞中的H3K27 甲基化修饰参与心肌损伤过程。并且研究表明,敲除JMJD3 可以抑制LPS 诱导的炎性级联反应,下调促炎性细胞因子的产生[16],预防腹主动脉瘤[17]。由此可见,JMJD3 是介导免疫细胞激活和炎症细胞因子表达的关键调控因子。同时,有研究发现JMJD3 通过抑制SESN2 表达介导阿霉素诱导的心肌病[6]。SESN2 是一种高度保守的应激诱导蛋白,参与心血管疾病中的线粒体功能和自噬[18]。研究表明,SESN2 可以通过调节氧化应激、自噬等过程对机体生理和病理状态发挥保护作用[19]。过表达SESN2 通过减少活性氧产生、减少ATP 消耗及增加线粒体膜电位等减轻葡萄糖剥夺诱导的细胞凋亡,减轻脓毒症引起的心脏功能障碍[20]。此外,SESN2 还可以通过改善线粒体功能和线粒体自噬来减轻阿霉素诱导的心肌病[21]。本研究进一步探究了JMJD3 和SESN2 在脓毒症心肌损伤中的调控机制。结果发现,在脓毒症体内外模型中JMJD3 都呈现高表达,SESN2 蛋白表达水平降低;且敲低JMJD3 后发现SESN2 蛋白表达水平增强,同时细胞活性增强,凋亡水平减弱,自噬水平增强。同时还发现,过表达SESN2 后,自噬水平增强,细胞活性增强,凋亡水平减弱,而进一步过表达JMJD3 后,以上变化趋势发生逆转。进一步证实了JMJD3 和SESN2 通过调控线粒体自噬影响SIMI。
综上所述,本研究发现JMJD3 可能通过调控SESN2 介导线粒体自噬,促进LPS 诱导的心肌细胞损伤。本研究结果为阐明脓毒症下心肌细胞线粒体自噬的机制和寻找SIMI 新疗法提供了理论依据。
