嘌吗啡胺靶向激活Hedgehog信号通路调控骨髓来源间充质干细胞成骨-成脂分化平衡的机制研究
2023-09-22雷新环朱忠杨海兰袁赤亭郭宇华章礼炜
雷新环 朱忠 杨海兰 袁赤亭 郭宇华 章礼炜
正常机体的骨重建依赖于破骨细胞介导的骨吸收与成骨细胞介导的骨形成之间的动态平衡,两者失衡将引起骨过度形成、硬化相关疾病或骨形成不全、过度吸收相关疾病[1]。在正常生理状态下,为了维持骨量稳定,骨组织始终处于不断的代谢状态,包括成骨细胞形成新的骨组织及破骨细胞重吸收陈旧或受损骨组织,从而保持动态平衡维持骨量稳定。骨髓来源间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)的减少及成骨细胞和脂肪细胞的分化失衡最终导致骨形成减少,是老年骨质疏松的病因基础之一[2]。BMSCs 的成骨分化是影响骨形成乃至骨量的主要因素之一,这一过程受到多个信号通路及细胞因子的调控,诸如β-连环蛋白、Notch、骨形成蛋白家族等相关通路,其中Hedgehog(Hh)信号通路作为一条保守且重要的信号通路,参与多种类型细胞的分化、增殖,在骨发育及骨代谢中同样起着重要作用[3-4]。小分子药物嘌吗啡胺(purmorphamine,PM)可直接结合Hh 信号通路中的Smoothened 蛋白,激活Hh信号通路[5-6]。目前国内外研究表明PM 可显著增强成骨细胞相关特征基因表达,但其在调控BMSCs 成骨-成脂分化中的作用尚缺乏较为系统的报道[7-8]。本研究探讨PM 靶向激活Hh 信号通路后对BMSCs 成骨-成脂分化平衡的影响及其机制。
1 材料和方法
1.1 实验动物 6~8 周龄SPF 级C57BL/6 小鼠15 只,购于上海杰思捷实验动物有限公司[生产许可证号:SCXK(沪)2018-0004],饲养于浙江省台州医院公共科研平台SPF 动物房[使用许可证号:SYXK(浙)2019-0030]。小鼠在室温20~25 ℃,湿度40%~60%,24 h 自然光暗循环条件下饲养,不限制饮水及进食。本研究相关动物饲养及操作经浙江省台州医院动物伦理委员会审查通过(批准文号:tzyy-2019033)。
1.2 试剂和仪器 PM(货号:S3042)购于美国Selleck Chemicals 公司,高速离心后使用二甲基亚砜(货号:ST038,上海碧云天生物技术有限公司)溶解制成100 mmol/L 母液,分装后置于-80 ℃冰箱保存。维生素C(货号:S13001)、β-甘油磷酸钠(货号:S30003)、地塞米松(货号:S17003)、胰岛素(货号:S24703)、罗格列酮(货号:S70212)均购于上海源叶生物科技有限公司;α-MEM 培养基(货号:SH30265.01)购于美国Hyclone 公司;异丙醇(货号:A507048)购于上海生物工程有限公司;特级FBS(货号:FB25015)购于美国Clark Bioscience 公司;细胞计数试剂盒-8(cell count kit 8,CCK-8)试剂盒(货号:K1018)购于美国APExBIO 公司;cDNA 第一链合成试剂盒(货号:R123-01)、SYBR Green 荧光实时定量PCR 试剂盒(货号:Q121-02)均购于南京诺唯赞生物科技股份有限公司;总RNA 提取试剂(货号:R1100)、Von Kossa 矿化结节染色液(货号:G3282)均购于北京索莱宝科技有限公司;油红O 染色试剂盒(货号:C0157)、5-溴-4-氯-3-吲哚磷酸(5-bromo-4-chloro-3-indolyl phosphate,BCIP)/硝基氯化四氮唑蓝(nitro blue tetrazolium chloride,NBT)ALP 显色试剂盒(货号:C3206)、PBS(货号:C0221)、红细胞裂解液(货号:C3702)、胰酶细胞消化液(货号:C0201)、青霉素-链霉素双抗溶液(货号:C0222)均购于上海碧云天生物技术有限公司;4%多聚甲醛固定液(货号:G1101)购于武汉赛维尔生物科技有限公司;FITC Anti-CD44(货号:FITC-65117)、FITC Anti-CD45(货号:FITC-65109)抗体均购于武汉三鹰生物技术有限公司;FITC Anti-CD105(货号:ab184667)、PE Anti-CD34(货号:ab23830)抗体均购于美国Abcam 公司。Multiskan Sky-High 全波长酶标仪购于美国Thermo Fisher 公司;ABI 7500 实时荧光定量PCR 仪购自于美国Applied Biosystems 公司;DM IL LED 倒置实验室显微镜购于德国Leica公司;FACSCalibur流式细胞仪购于美国BD公司。
1.3 方法
1.3.1 BMSCs 的分离培养与鉴定 将小鼠麻醉后脱颈处死,分离小鼠双下肢踝关节、膝关节、髋关节,取出胫骨、股骨放置于装有PBS 的细菌皿中,剃净肌肉、生长板及黏附其上的韧带等结缔组织,3 次无菌PBS 漂洗后,于股骨近端、胫骨远端暴露骨髓腔,使用1 mL 针筒抽取PBS 反复冲洗骨髓腔直至骨髓腔无明显血色。将分离的骨髓使用α-MEM 完全培养基(含有10%FBS)重悬后1 500 r/min 离心4 min,倒掉上清液后使用红细胞裂解液重悬细胞沉淀,5 min 后再次离心,弃上清液并重悬于含10%特级FBS、1%青霉素-链霉素双抗溶液的完全培养基,接种于10 cm 细胞培养皿中,每2 天换液1 次,待细胞长至80%时胰酶消化,计数后备用。为明确所收集的细胞是否为BMSCs,将部分细胞1 500 r/min 离心10 min,吸弃上清液,加入10 mL PBS吹匀后1 500 r/min 离心10 min,洗涤2 次。吸弃上清液,加入PBS 制成单细胞悬液。随后将细胞调整密度为1×106个/mL,分管后1 500 r/min 离心10 min,吸弃上清液,加入90 μL PBS 后吹打为细胞悬液,分别加入流式抗体(FITC Anti-CD44、FITC Anti-CD45、FITC Anti-CD105、PE Anti-CD34)及其同型对照各10 μL,37 ℃避光孵育30 min后加入400 μL PBS,上流式细胞仪检测。
1.3.2 BMSCs 增殖活性检测 采用CCK-8 法。将BMSCs 按0.6×104细胞/孔的密度种于96 孔板内,设置1 个对照组和9 个浓度(0.5、1、2、5、10、25、50、100、200 μmol/L)PM 处理组,共10 组,每组3 个重复孔。待细胞过夜贴壁后,将孔内液体更换为对应组别包含不同浓度PM 的完全培养基进一步培养,隔天换液1 次。分别培养48、72、96 h 后,向每孔中加入10 μL CCK-8试剂,于细胞培养箱中继续培养2 h 后,使用酶标仪测定各孔450 nm 波长处吸光度(optical density,OD)值。
1.3.3 BMSCs 成骨、成脂分化诱导 首先,为进行成骨诱导,将BMSCs 按20×104细胞/孔的密度种于12 孔板(ALP 染色)或40×104细胞/孔的密度种于6 孔板(抽提RNA 或Von Kossa 矿化结节染色)。过夜贴壁后,使用成骨诱导培养基(完全培养基+50 μg/mL 维生素C+10 mmol/L β-甘油磷酸钠+100 nmol/L 地塞米松)进行成骨分化诱导,隔天换液,中期(7 d 左右)可见细胞收缩、聚集,后期(14 d 左右)可见磨砂样钙结节生成。与此同时,为进行成脂诱导,将BMSCs 按30×104细胞/孔的密度种于12 孔板(油红O 染色)或60×104细胞/孔的密度种于6 孔板(抽提RNA)。过夜贴壁后,使用成脂诱导培养基(完全培养基+1 μg/mL 胰岛素+10 μmol/L 罗格列酮+250 nmol/L 地塞米松)进行成脂分化诱导,隔天换液,中期(4 d 左右)可见细胞内出现少量透亮的小脂滴,后期(8 d 左右)可见细胞内堆积大量肥大透亮的成熟脂滴。
1.3.4 ALP 表达检测 采用ALP 染色法。首先,吸除12 孔板中培养基后使用PBS 洗涤2 次,以去除细胞碎片、漂浮物等。随后向每孔加入500 μL 4%多聚甲醛固定液固定细胞5 min,后吸除固定液并用双蒸水漂洗2 次。根据ALP 显色试剂盒说明书步骤,将BCIP 溶液(300X)、NBT 溶液(150X)加入ALP 显色缓冲液,配制成ALP 染色工作液,每孔加入500 μL 进行染色,置于37 ℃烘箱中避光孵育30 min。最后,吸除染色液并用双蒸水漂洗2 次,置于倒置显微镜下拍照。
1.3.5 钙结节检测 采用Von Kossa 矿化结节染色法。Von Kossa 矿化结节染色法利用硝酸银与钙盐的复分解反应形成可被还原的银盐,在强光或紫外光下或强还原剂作用下使其还原为黑色的金属银的特性,可以将矿化结节染成黑色。首先,吸除6 孔板中培养基后使用PBS 洗涤2 次,向每孔加入1 mL 4%多聚甲醛固定液固定细胞5 min,后吸除固定液并用双蒸水漂洗2 次。每孔加入1 mL Von Kossa 硝酸银溶液,置于阳光下照射20 min。最后,吸除染色液并用双蒸水漂洗2次,置于倒置显微镜下拍照。
1.3.6 脂滴形成检测 采用油红O 染色法。首先,吸除6 孔板中培养基后使用PBS 洗涤2 次,向每孔加入500 μL 4%多聚甲醛固定液固定细胞5 min,后吸除固定液并用双蒸水漂洗2 次。随后每孔加入1 mL 60%异丙醇溶液清洗细胞,吸弃后每孔加入1 mL 现配的油红O 染色工作液。染色15 min 后吸弃,60%异丙醇溶液清洗残留油红O 2 次。最后使用双蒸水漂洗2 次,并向每孔加入1 mL 双蒸水保持孔板底面湿润,置于倒置显微镜下拍照。
1.3.7 PM 对Hh 信号通路活性Gli1 及成骨-成脂过程中核心转录因子Sp7、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptors γ,Pparg)、CCAAT 增强子结合蛋白α(CCAAT enhancer-binding protein α,Cebpa)及特征基因ALP、整合素结合唾液酸蛋白(bone sialoprotein,Ibsp)、围脂滴蛋白1(perilipin 1,Plin1)、脂联素(adiponectin,Adipoq)、脂肪酸转位酶(fatty acid translocase,Cd36)表达的影响 采用qRTPCR 法。吸去各个培养孔中的培养基,预冷的PBS 冲洗1 次后每孔加入500 μL 总RNA 提取试剂,置于冰上按说明书提取细胞总RNA。RNA 样品测定浓度后使用,cDNA 第一链合成试剂盒反转录合成cDNA(1 μg RNA,使用20 μL 反转录体系,反应结束后使用双蒸水稀释至100 μL备用)。后续qPCR 所用引物序列见表1。所使用的qPCR 反应体系为20 μL(SYBR Green 10 μL,cDNA 2 μL,前后链引物mix 0.5 μL,ddH2O 7.5 μL),反应条件为95 ℃5 min 预变性,随后95 ℃10 s 变性,65 ℃30 s 扩增共循环40 次。分析结果时,以18S 核糖体RNA(18S ribosomal RNA,Rn18s)为内参,使用2-ΔΔCt法计算各个基因转录水平的相对表达水平。

表1 qRT-PCR 所用引物序列
1.4 统计学处理 采用SPSS 18.0 统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs 鉴定 BMSCs 表面抗原CD44、CD105、CD45、CD34 阳性率分别为98.26%、99.07%、0.08%、0.12%,本实验所用小鼠原代细胞符合BMSCs 表面抗原特征,鉴定为BMSCs,见图1。

图1 流式细胞仪鉴定本实验所用原代细胞是否为BMSCs(A:细胞表面抗原CD44 表达阳性率流式图;B:细胞表面抗原CD105 表达阳性率流式图;C:细胞表面抗原CD45 表达阳性率流式图;D:细胞表面抗原CD34 表达阳性率流式图)
2.2 PM 对BMSCs 增殖及Hh 信号通路活性的影响在PM 处理BMSCs 48 h 后,50 μmol/L PM 处理组OD450值由对照组0.88±0.02 降低至0.71±0.04(P<0.01);72 h 后,25 μmol/L PM 处理组OD450值由对照组1.38±0.02 降低至1.23±0.05(P<0.01);96 h 后,25 μmol/L PM 处理组OD450值由对照组1.81±0.03 降低至1.49±0.05(P<0.01)。CCK-8 实验提示,10 μmol/L 及以下浓度的PM 对BMSCs 增殖无明显毒性反应,见图2。随后,通过检测Hh 下游靶基因Gli1 mRNA 水平的变化,以进一步明确PM 对BMSCs 细胞内Hh 信号通路活性的影响。与对照组的1.00±0.34 相比,2 μmol/L PM 处理组Gli1 mRNA 水平增加至117.20±27.74(P<0.01),并且5 μmol/L PM 处理组、10 μmol/L PM 处理组与2 μmol/L PM 处理组Gli1 mRNA 水平比较差异均无统计学意义(均P>0.05),因此选择2 μmol/L 浓度的PM进行后续实验,见图3。
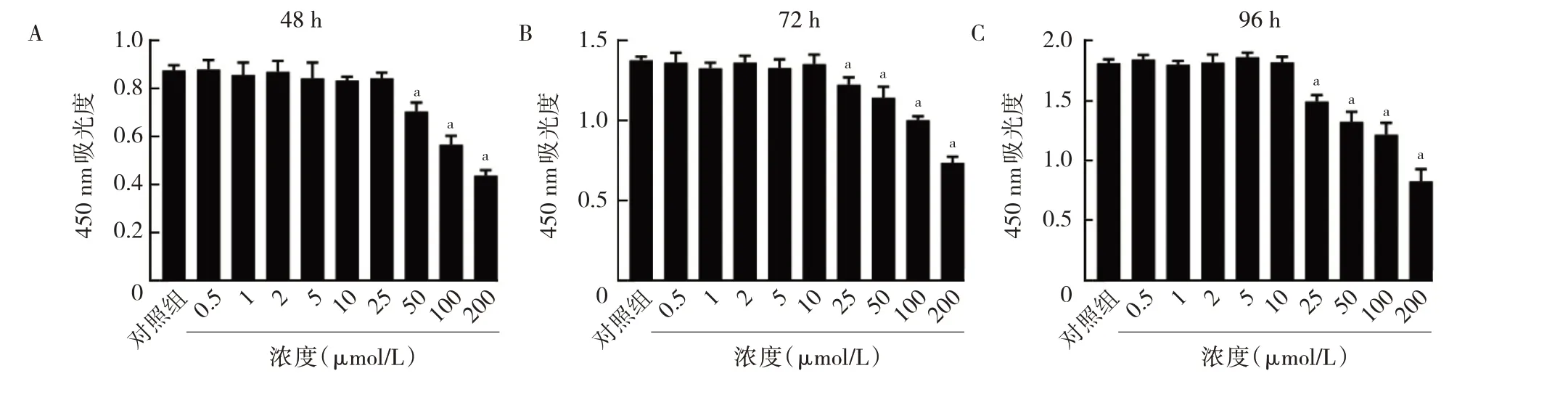
图2 不同浓度PM 对BMSCs 增殖活性的影响(A:不同浓度PM 处理下共培养48 h 对BMSCs 增殖活性的影响;B:不同浓度PM 处理下共培养72 h 对BMSCs 增殖活性的影响;C:不同浓度PM 处理下共培养96 h 对BMSCs 增殖活性的影响)

图3 不同浓度PM 对BMSCs 细胞内Hh 信号通路活性Gli1 的影响
2.3 PM 对BMSCs 成骨-成脂分化的影响 首先,对照组和2 μmol/L PM 处理组BMSCs 分别经过7 d 的成骨诱导进行ALP 染色、14 d 的成骨诱导进行Von Kossa 矿化结节染色,结果提示在2 μmol/L PM 的作用下,可明显促进BMSCs 成骨分化过程中ALP 的表达和钙结节的形成。与此同时,对照组和2 μmol/L PM 处理组BMSCs 经过8 d 的成脂诱导后进行油红O 染色,结果提示在2 μmol/L PM 的作用下,可显著抑制BMSCs 成脂分化过程中细胞内脂滴的形成与堆积(图4,见插页)。
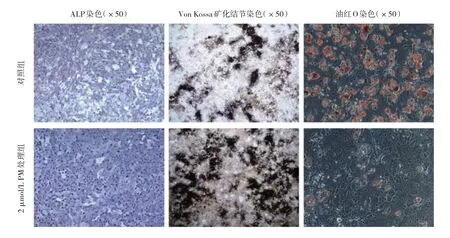
图4 2 μmol/L PM 处理下对BMSCs 成骨分化过程中ALP 表达、钙结节形成及成脂分化过程中脂滴形成的影响
2.4 PM 对BMSCs成骨-成脂分化过程中相关核心转录因子、特征基因转录的影响 与对照组比较,2 μmol/L PM 处理组BMSCs 成骨分化7 d 时细胞内ALP、Sp7、Ibsp 基因转录水平均升高(均P<0.01)。与此同时,与对照组比较,2 μmol/L PM 处理组BMSCs 成脂分化8 d时细胞内Pparg、Cebpa、Plin1、Adipoq、Cd36 基因转录水平均降低(均P<0.05),见图5。

图5 2 μmol/L PM 对BMSCs 成骨-成脂分化过程中相关基因转录的影响(A:2 μmol/L PM 对BMSCs 成骨诱导7 d 后核心转录因子Sp7 及特征基因ALP、Ibsp 转录的影响;B:2 μmol/L PM 对BMSCs 成脂诱导8 d 后核心转录因子Pparg、Cebpa 及特征基因Plin1、Adipoq、Cd36 转录的影响)
3 讨论
骨作为运动系统的重要组成部分,为机体提供结构依托及保护作用,参与体内造血、钙代谢、内分泌调节等生理过程。骨重建贯穿人的一生,并且大部分骨代谢相关疾病均影响骨重建过程[9]。骨质疏松症是多种原因导致的骨密度和骨质量下降,骨微结构破坏,造成骨脆性增加,从而容易发生骨折的全身性骨病,与机体衰老密切相关[10]。更年期妇女绝经后体内破骨细胞数目增多、活性增强,引起松质骨的大量丢失,目前临床中使用的双膦酸盐类药物(唑来膦酸等)、降钙素、雌激素受体调节剂等均以破骨细胞作为靶点[11]。此外,成骨细胞所介导的骨形成能力降低也是骨质疏松症发生的重要因素,特别是在老年骨质疏松症中尤为重要。随着机体的衰老和体内慢性炎症状态,BMSCs 的成骨分化能力减弱,成脂分化能力增强,导致人体骨形成速度显著下降[10]。针对机体成骨-成脂失衡这一靶点,开展相关机制研究、药物研发,进而增强骨形成能力,不仅可以延缓骨质疏松症的发生,而且可以逆转骨量的丢失,是目前骨代谢领域研究的热点之一。Hh 信号通路高度保守,脊椎动物体内存在3 种Hh 配体蛋白,即Sonic hedgehog(Shh)、Indian hedgehog(Ihh)和Desert hedgehog(Dhh),3 者表达位置存在差异但以相同的方式激活Hh 信号通路[12]。其中Shh 是成骨细胞分化早期的关键信号之一,是早期胚胎形成和颅面部形态发生的主要调节因子;而Ihh 主要在后期参与分化的调控,是软骨成骨生长和骨化的关键调节因子[13]。目前,大量针对Hh 信号通路的研究主要集中在MC3T3-E1、C3H10 T1/2 等细胞系,尚未有研究报道直接在BMSCs 中靶向激活Hh 信号通路对其成骨-成脂分化的影响。
本研究首先通过流式细胞仪鉴定了所提取培养的BMSCs 细胞表面特征蛋白情况,发现其可高表达CD44、CD105(均>95%),低表达CD45、CD34(均<2%)。结合所提取的BMSCs 贴壁生长的同时,可在特定诱导条件下分化为成骨细胞、脂肪细胞,符合目前公认的间充质干细胞认定标准。随后通过使用PM靶向激活Smoothened 蛋白,Smoothened 移动到初级纤毛的顶端并向Sufu 发出信号以释放Gli 激活剂,Gli 激活剂迁移到细胞核并激活靶基因如Gli1 的表达。在2 μmol/L PM 处理下,Hh 信号通路得到了有效激活,下游转录因子Gli1 的表达显著升高。与此同时,PM 可显著促进BMSCs 成骨分化过程中ALP 的表达和钙结节的形成,同时抑制BMSCs 成脂分化过程中脂滴的形成。在此基础之上,qRT-PCR 结果进一步揭示了在BMSCs 成骨-成脂分化过程中,PM 刺激Hh 信号通路后可导致成骨相关基因Sp7、ALP、Ibsp 在转录水平表达显著增强,而成脂相关基因Pparg、Cebpa、Plin1、Adipoq、Cd36 在转录水平表达明显下降。在既往研究中,Hh 信号通路能通过转录因子Gli2 增强骨形成蛋白(bone morphogenetic protein,BMP)的启动子活性,促进BMP2、BMP4 表达从而部分调控BMP 诱导成骨分化的过程[14-17]。同时Hh 通路既能增强Smad1/5/8 转录活性,也能促进BMP9 诱导RUNX2 和DLX5 等基因表达的作用,从而促进BMP9 的早期和晚期成骨分化诱导作用[18]。本研究首次利用小鼠来源的BMSCs 作为研究对象,发现通过使用PM 激活Hh 信号通路后可直接调控成骨分化、成脂分化的3 种核心转录因子Sp7、Pparg、Cebpa 表达,影响BMSCs 分化命运。
综上所述,本研究揭示了PM 可直接靶向激活Hh信号通路活性,进而调节BMSCs 成骨-成脂分化平衡,可促进成骨分化的同时抑制成脂分化,为防治骨质疏松症等骨量丢失疾病提供新的靶点与思路。
