PET/CT 中18F-FDG 摄取值联合血清CEA 水平预测肺腺癌EGFR突变的价值
2023-09-22王运朱红洲高心逸嵇建峰庞伟强易贺庆靳水龙斌吴红霞叶雪梅李林法
王运 朱红洲 高心逸 嵇建峰 庞伟强 易贺庆 靳水 龙斌 吴红霞 叶雪梅 李林法
肺癌是全球发病率和死亡率最高的恶性肿瘤。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的85%,其中肺腺癌是最常见的病理类型,近70%的NSCLC 初诊时已处于晚期[1-2]。具有表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的NSCLC 对EGFR 酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)高度敏感。这部分患者在EGFR 靶向治疗辅助下,中位总生存期和无进展生存期均可以得到改善[3]。因此,确定EGFR 突变对肺腺癌治疗优化具有重要意义,临床指南建议在治疗前进行初步EGFR 基因检测。然而,目前EGFR 基因分型须通过组织活检进行,存在缺乏可用组织、有创检查不良事件以及并发症的局限[4]。因此,探索一种无创、便捷的方法来预测EGFR 的突变状态显得尤为重要。最近报道,氟18-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)摄取程度是NSCLC 的一个重要预后因素[5]。血清癌胚抗原(carcinoembryonic antigen,CEA)是评价肺腺癌最常用的肿瘤标志物,最近有研究进一步证明NSCLC 患者血清CEA 水平是吉非替尼治疗是否有效的重要预测指标,它可能与EGFR 突变有关[6]。目前肺腺癌EGFR 突变与正电子发射型计算机断层显像(positron emission tomography,PET)/CT 中18F-FDG FDG 摄取值和血清CEA 水平之间是否存在相关性尚不清楚。因此,本研究对肺腺癌患者行PET/CT 中18F-FDG 摄取值联合CEA 水平检测,探讨两者预测肺腺癌EGFR 突变的价值,现报道如下。
1 对象和方法
1.1 对象 选取2016 年12 月至2020 年4 月在浙江省肿瘤医院治疗前接受血清CEA 水平、EGFR 突变检测并行PET/CT 检查的肺腺癌患者196 例,其中男104 例,女92 例;年龄29~89(62.0±11.4)岁。纳入标准:(1)经病理检查证实为肺腺癌;(2)术前或活检前1 个月内行18F-FDG PET/CT 检查;(3)PET/CT 检查前没有进行相关治疗;(4)未合并其他恶性肿瘤;(5)单个肺部病灶最大直径>1 cm,避免部分容积效应。排除标准:(1)糖尿病患者血糖水平未达标(>11.1 mmol/L);(2)严重肝肾功能不全;(3)不配合或检查前准备不足;(4)注射给药后检查时间超过60 min。本研究经本院医学伦理委员会审查通过[批准文号:IRB-2022-804号(科)],所有患者均知情同意。
1.2 资料收集 收集患者性别、年龄、吸烟史、肿瘤直径、TNM 分期、原发灶最大标准化摄取值(maximum standardized uptake value,SUVmax)、治疗前血清CEA 水平(正常范围0~5 ng/mL)和有无毛刺等资料。
1.3 检查方法 PET/CT 检查采用Discovery 710 型PET/CT 扫描仪(美国GE 公司),同机CT 为64 排螺旋CT,示踪剂18F-FDG 由上海原子科兴药业有限公司供药,放化纯度>95%。患者检查时禁食至少6 h,血糖水平低于11.1 mmol/L,1 周内未进行胃肠造影检查。静脉注射0.1~0.15 mCi/kg18F-FDG 1 h 后进行检查。患者取仰卧位,双手抱头,范围自头部至大腿上部1/3。CT 扫描参数:管电压120 kV,管电流170 mA,CT 重建层厚3.0 mm。PET 采集7~8 个床位,每个床位3 min。CT 衰减校正后的PET 图像采用有序子集期望值最大化的方法进行重建。
1.4 图像分析 所有PET/CT 数据均由两名主治及以上医师(均不知晓患者的EGFR状态)勾画。在横断位图像上将感兴趣区(region of interest,ROI)置于原发肿瘤部位,测量每个病灶的18F-FDG SUVmax。记录原发肿瘤的CT影像学特征,包括肿瘤的大小、位置和有无毛刺。
1.5 EGFR 突变分析 对手术切除或穿刺获得的组织标本行EGFR 突变分析。具体步骤按照EGFR 突变检测试剂盒(批号:20143402001,厦门艾德生物医药科技有限公司)说明书执行,检测EGFR 第18~21 外显子的突变情况。如果检测到EGFR 外显子18~21 的任何外显子突变,则该肿瘤被认为是EGFR 突变型;否则,将肿瘤归类为EGFR 野生型。
1.6 统计学处理 采用SPSS 17.0 统计软件。符合正态分布的计量资料以表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验。采用二元logistic 回归分析影响肺腺癌患者EGFR 突变的因素。ROC 曲线评估PET/CT 中18F-FDG SUVmax联合血清CEA 水平预测肺腺癌EGFR 突变的效能。P<0.05 为差异有统计学意义
2 结果
2.1 肺腺癌患者临床EGFR 突变状态分析 196 例肺腺癌患者中,EGFR 突变型109 例(55.6%),EGFR 突变亚型以外显子19 缺失和外显子21 的L858R 点突变为主;EGFR 野生型87 例(44.4%)。
2.2 影响肺腺癌患者EGFR突变的单因素分析 EGFR突变型患者女性比例、无吸烟史比例、血清CEA 水平≥5 ng/mL 比例、无毛刺比例均高于EGFR 野生型患者,而肿瘤直径、18F-FDG SUVmax均低于EGFR 野生型患者,差异均有统计学意义(均P<0.05);不同EGFR 突变组间年龄和TNM 分期比较差异均无统计学意义(均P>0.05),见表1。典型EGFR 突变型和野生型患者的18F-FDG PET/CT 表现见图1、2。
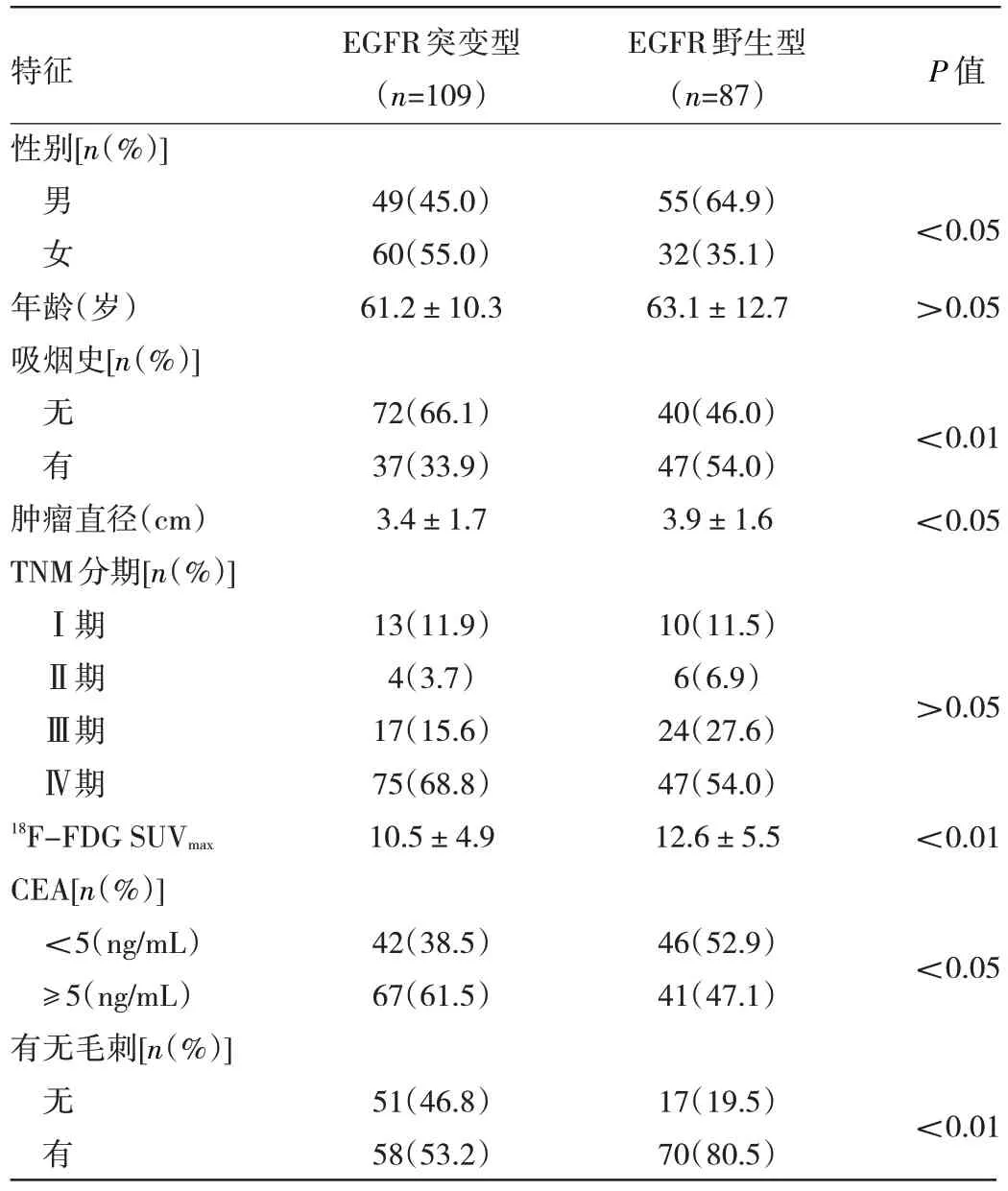
表1 影响肺腺癌患者EGFR 突变的单因素分析
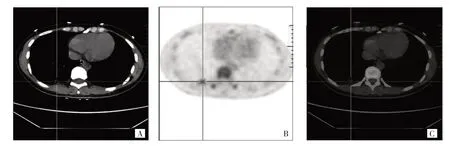
图1 患者,女,39 岁。表皮生长因子受体突变型,融合PET/CT 图像显示右肺下叶一直径约1.4 cm 结节,边缘无毛刺,放射性摄取增高(原发灶18F-FDG SUVmax=4.03),血清CEA 为87.09 ng/mL(A:CT 图像;B:PET 图像;C:PET/CT 图像)
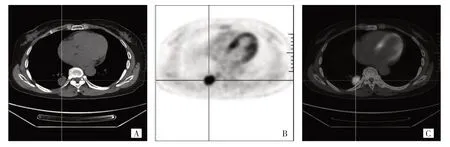
图2 患者,女,60 岁。表皮生长因子受体野生型,融合PET/CT 图像显示右肺下叶一直径约2.9 cm 结节,边缘有毛刺,放射性摄取异常增高(原发灶18F-FDG SUVmax=18.62),血清CEA 为2.52 ng/mL(A:CT 图像;B:PET 图像;C:PET/CT 图像)
2.3 影响肺腺癌患者EGFR 突变的多因素分析 将上述单因素分析有统计学意义的指标纳入二元logistic回归分析,结果显示18F-FDG SUVmax<12.8(ROC 曲线分析得出)、血清CEA 水平≥5 ng/mL、肿瘤直径较小、无毛刺是影响EGFR 突变的独立预测因素(均P<0.05),见表2。
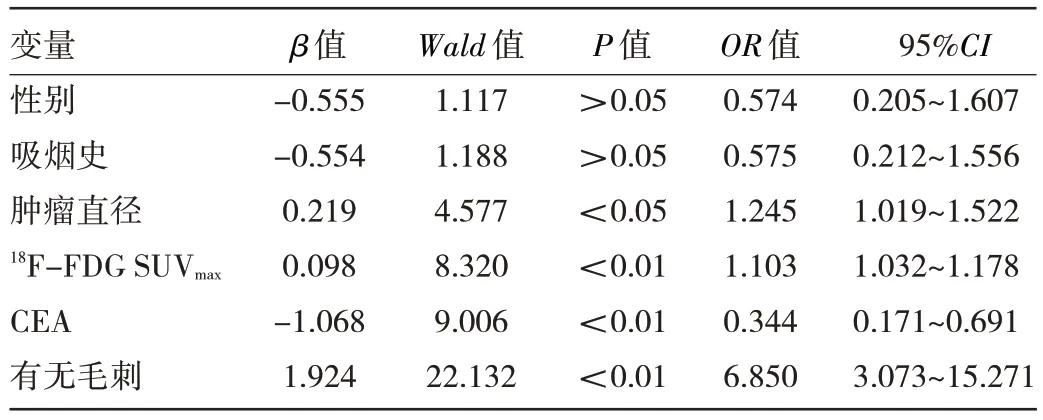
表2 影响肺腺癌患者EGFR 突变的多因素分析
2.4 PET/CT 中18F-FDG 摄取联合血清CEA 水平预测肺腺癌EGFR 突变的价值 ROC 曲线显示18F-FDG SUVmax临界 值为12.8,相应的AUC 为0.613(95%CI:0.534~0.692)。当SUVmax<12.8 时,其预测EGFR 突变的灵敏度为0.725,特异度为0.483,准确度为61.7%,阳性预测值为63.7%,阴性预测值为58.3%。当18F-FDG SUVmax联合血清CEA 水平、肿瘤直径、有无毛刺时,相应的AUC 为0.754(95%CI:0.686~0.823),见图3。

图3 18F-FDG SUVmax联合血清CEA 水平、肿瘤直径、有无毛刺预测肺腺癌患者EGFR 突变的ROC 曲线
3 讨论
肺腺癌是NSCLC 中最常见的病理亚型,近年来发病率有上升趋势。与整体NSCLC 患者相比,带有EGFR 激酶区域突变的NSCLC 患者更有可能是亚洲人或女性,有肺腺癌组织学亚型和非吸烟史[7]。本研究中,109 例(55.6%)患者检测到EGFR 突变,这与亚洲人群中之前的研究结果一致(49%~64%),但高于美国报道的患病率(10%~24%)[8]。这些差异可能反映了肺腺癌发生的不同机制,可归因于种族差异。此外,吸烟史和性别也是EGFR 突变状态的预测因素。不同EGFR 突变组患者年龄、TNM 分期比较差异均无统计学意义。
既往研究报道EGFR 突变预示着接受TKI 治疗的患者预后良好[9-10]。确定EGFR 突变状态对于选择可能受益于EGFR TKI 治疗的患者和预测临床患者预后至关重要。然而,肺腺癌EGFR 检测可能具有一定的局限性[11-12]。
PET 摄取18F-FDG 可能是潜在肿瘤基因型的无创性生物标志物。EGFR 基因的突变激活蛋白激酶B 信号通路,进一步促进癌细胞消耗葡萄糖,刺激其生长和存活[13]。以往与EGFR 基因分型相关的18F-FDG PET/CT 研究主要集中在基于肉眼或定量18F-FDG PET参数的主观传统特征分析来预测EGFR 突变状态。以往的研究报道了不同18F-FDG SUVmax阈值来预测肺癌EGFR 的突变状态[7,14-15]。Kim 等[16]发现EGFR 突变组的所有代谢参数和体积参数均显著低于EGFR 野生型肺腺癌。本研究中,EGFR 突变型组18F-FDG SUVmax低于EGFR 野生型组。尽管18F-FDG SUVmax具有显著的区分能力,但在之前的研究中,EGFR 突变型组和野生型组之间存在很大的重叠,导致了相互矛盾的结果。Lv等[7]发现在849 例NSCLC 患者中,18F-FDG SUVmax<7.0时是EGFR 突变的预测因子,AUC 值为0.557。Na 等[17]发现在100 例NSCLC 患者中,18F-FDG SUVmax截断值<9.2 是EGFR 突变的预测因子,其AUC 值为0.74。Mak等[8]发现在100 例NSCLC 患者中,18F-FDG SUVmax<5.0是EGFR 突变的预测因子,其AUC 值为0.62。Cho 等[18]发现在61 例NSCLC 患者中,18F-FDG SUVmax<9.6 是EGFR 突变的预测因子,其AUC 值为0.68。此外,Guan等[19]发现在316 例NSCLC 患者中,18F-FDG SUVmax<8.1是EGFR 突变的预测因子,其AUC 值为0.65。但有两组报道的结果相反,Ko 等[20]发现18F-FDG SUVmax≥6 是132 例肺腺癌患者EGFR 突变的预测因子,其AUC 值为0.63;Huang 等[21]发现,在77 例肺腺癌患者中,18FFDG SUVmax≥9.5 是EGFR 突变的预测因子。以往研究的不一致性和相对较低的区分能力可能是因为传统的SUV 测量未能捕捉到空间体素之间的SUV 特征。本研究中,虽然通过ROC 曲线分析确定18F-FDG SUVmax的临界值为12.8,但必须强调的是,18F-FDG SUVmax是一个半定量的指标,在不同的中心或PET 扫描仪之间会有所不同,这取决于禁食时间、血糖水平、成像时间、重建算法和ROI 参数。
目前,血清CEA 水平测定是肺癌常用的肿瘤标志物,因为有报道称35%~70%的NSCLC 患者CEA 水平升高,特别是在肺腺癌和晚期疾病患者[22]。Okamoto等[23]研究报道,与低CEA 水平相比,接受TKI 治疗的患者治疗前CEA 水平高与更长的生存期和更好的反应相关。Shoji 等[24]首次研究了EGFR 突变与CEA 水平的关系,并报道了血清CEA 水平>5 ng/mL 的患者的EGFR突变率显著高于CEA 水平<5 ng/mL 的患者。可能的潜在机制是突变的EGFR 途径的抗凋亡信号,它可能上调CEA 蛋白的表达水平。Ko 等[25]对132 例肺腺癌患者的研究发现,18F-FDG SUVmax≥6 和CEA 水平≥5 ng/mL的患者更有可能发生EGFR 突变(均P<0.05)。较大肿瘤(≥3 cm)和边缘无毛刺的肿瘤的CT 特征也与EGFR 突变相关(均P<0.05)。多因素分析显示,较高的18F-FDG SUVmax和CEA 水平、从不吸烟和肿瘤边缘无毛刺是EGFR 突变的最有意义的预测因素。联合使用这4 个指标,得出的AUC 较高,为0.82。本研究结果与Shoji 等[24]的结果一致,尽管预测EGFR 突变的灵敏度和特异度分别只有0.725 和0.483。肺腺癌患者的CT 表现和分子状态之间的相关性尚不清楚,只有少数研究解决了这一问题。本研究结果显示,肿瘤边缘无毛刺是EGFR 突变的预测因素。本研究结果与Ko等[25]的结果一致。早些时候的一项研究指出,在有淋巴结转移或血管侵犯的晚期肺腺癌中,肿瘤边缘常出现粗糙且有毛刺的情况[25]。Meniga 等[26]也报道称边缘有毛刺的NSCLC 患者预后更差。本研究发现与这些概念是一致的,因为在本研究EGFR 野生型组中,有毛刺的肿瘤(80.5%)倾向于观察到更晚期(Ⅲ~Ⅳ)的肿瘤。此外,众所周知,EGFR 野生型患者较EGFR 突变型患者预后更差。因此,本研究推测无毛刺的肿瘤边缘与EGFR 突变有关。
综上所述,本研究结果提示,在亚洲肺腺癌人群中,EGFR 突变与临床和影像学因素有关,包括FDG 摄取、血清CEA 水平、CT 影像上的有无毛刺和肿瘤直径。这4 个因素的联合评估可能有助于区分突变状态,特别是在采样不足或基因检测不可用的情况下。
