IL-34介导的NF-кB信号通路对根尖牙乳头干细胞增殖、迁移的调节作用
2023-09-21武峻捷朱永娜姜丽娜武庆华张伟健
武峻捷,朱永娜,姜丽娜,武庆华,张伟健,石 昕,刘 茜
2006年SONOYAMA等[1]分离培养人第三磨牙根尖部组织后,发现一种具有高增殖、分化潜能的间充质干细胞(mesenchymal stem cells,MSCs),命名为根尖牙乳头干细胞(stem cells from apical papilla,SCAPs)。作为MSCs的一种,SCAPs具有较高的增殖潜能、迁移能力,且易获取[2-4]。因此SCAPs有望作为种子细胞用于牙组织再生,其相关研究在一定程度上可促进牙组织工程的发展。白细胞介素(IL)-34是LIN等[5]发现的一种炎症因子。本课题组前期研究发现, IL-34 对 SCAPS 的增殖、迁移具有调节作用[6-8],但其调节机制尚不清楚。核因子-κB 受体( nuclear factor-kappa B,NF-кB)是细胞内重要的核转录因子[9]。研究[10-11]发现, TNF-α、IL-1β等炎症因子可介导NF-кB信号通路, 提高SCAPs的增殖、迁移能力。而抑制 NF-кB信号通路后,SCAPs的增殖和迁移能力受到显著抑制[12]。此外IL-34也已被证明可以调节MSCs中NF-κB信号通路[13]。本课题组推测IL-34可能通过介导NF-кB信号通路从而调节SCAPs的增殖和迁移。本课题以小鼠SCAPs为研究对象,探讨体外条件下IL-34通过NF-кB信号通路对SCAPs增殖、迁移的影响,现作报道。
1 材料和方法
1.1 主要仪器及试剂 离心机(上海卢湘仪离心机仪器有限公司);流式细胞仪(BD,美国);细胞培养板(TRUELINE,美国);CO2恒温培养箱(Thermo,美国);倒置显微镜(OLYMPUS,日本);胎牛血清(GIBCO,美国);DMEM(Hyclone,美国);胰蛋白酶-EDTA消化液(0.25%)(Solarbio,美国);CCK-8(SAB,美国);酶标分析仪(北京普朗新技术有限公司)。
1.2 方法
1.2.1 SCAPs的分离培养 取10只1周龄的小鼠麻醉处死后,将小鼠下颌中切牙在无菌条件下拔出,转入无菌超净工作台中,显微镜下用含双抗的磷酸缓冲液(PBS)冲洗分离小鼠根尖牙乳头组织,将其剪碎成约为1 mm3的小块。然后将组织块消化30~40 min,然后1 000 r/min离心5 min后弃上清液,加入含20%FBS和1%双抗的高糖DMEM培养基中,37 ℃,5%CO2培养。待细胞融合达到70%~80%时,用0.25%的胰蛋白酶按1∶3消化传代[14]。后续实验使用生长状态良好的P3代细胞。
1.2.2 SCAPs的鉴定 取P3代SCAPs,将其计数并以107个/孔接种于12孔培养板中,10%PBS洗涤2次后,离心弃上清液,吹打均匀细胞悬液,分别加入适量的CD44、CD45、CD90,同时设立阴性对照组,避光孵育1 h后,上流式细胞仪检测表面标志物。
1.2.3 SCAPs中CSF-1R的表达检测 2.5 g/L胰蛋白酶消化SCAPs,离心收集生长状态良好的P3代细胞,调整细胞密度为107个/毫升。待细胞悬液吹打均匀后,每个EP管内加入100 μL细胞悬液,然后分别加入适量的APC-labeled anti-CSF-1R,同时设立阴性对照组。4 ℃环境中避光孵育30 min,加入200 μL PBS重悬,移入流式管内,上流式细胞仪,检测上述CSF-1R的表达情况。
1.2.4 实验分组 实验分为4组包括空白对照组、IL-34 组(100 ng/mL IL-34)、CSF-1R 组(100 ng/mL IL-34+25 ng/mL anti-CSF-1R,CSF-1R受体抑制剂)、NF-кB 组(100 ng/mL IL-34+1μmol/L BMS-345541,NF-кB信号通路抑制剂)。
1.2.5 IL-34对SCAPs中NF-κB信号通路的调节检测 取生长状态良好的P3代细胞,以2×105个/孔接种于6孔培养板,以 10%FBS 的α-MEM 培养细胞。待细胞融合至 70%时,饥饿24 h。在各组培养液中培养 30、60、120 min 时,根据相关文献[12]提取细胞质蛋白和细胞核蛋白的方法收集SCAPs细胞质和细胞核中的总蛋白,Western blotting 分析各组中各时间点 IкBα、p-IкBα、p65及p-P65 的表达情况。实验重复3次。
1.2.6 IL-34/CSF-1R/NF-кB 信号对 SCAPSs增殖的影响检测 取生长状态良好的P3代细胞,以2×103个/孔接种到96孔板中培养,待细胞贴壁后饥饿培养24 h,更换无血清培养液进行同步化处理,按照上述实验方法分为4组,IL-34的浓度更换为50 ng/mL。在培养1、3、5、7 d后,将CCK-8试剂添加到每个孔中,并在37 ℃下培养2 h, 在450 nm波长处测量吸光度(OD)值。实验重复3次。
1.2.7 IL-34/CSF-1R/NF-кB 信号对 SCAPSs迁移的影响检测 取生长状态良好的P3代细胞,以2×105个/孔接种于24孔膜孔径8 μm的transwell培养板中,分别加入500 μL培养液。各组按照上述实验分组加入相应试剂后并加入0.1%FBS+α-MEM培养液。用酶消化法消化细胞,用0.1%FBS的α-MEM制成均匀的细胞悬液,将transwell小室放入24孔板,按照2×104个/孔在上层小室接种细胞,下层的24孔板中加入0.7 mL含10%FBS的RPMI-1640培养基,每组3复孔,将培养板放置在37 ℃含5%CO2的培养箱中,20 h后取出小室,棉签抹去上室中残余的细胞,用4%多聚甲醛固定,0.1%结晶紫染色,PBS洗3遍,400倍显微镜下随机5个视野观察细胞,记数。实验重复3次。
1.3 统计学方法 采用t检验、方差分析及q检验。
2 结果
2.1 SCAPS的分离培养 酶消化法原代培养小鼠根尖处SCAPs镜下可见梭形细胞,传代至第三代镜下可见SCAPs呈成纤维细胞样(见图1)。
2.2 SCAPs的鉴定 流式细胞仪鉴定SCAPs表面间充质细胞表面标志物CD44(89.8%)、CD90(92.0%)表达阳性,造血干细胞表面标志物CD45(4.7%)表达阴性(见图2)。


2.3 SCAPs中CSF-1R的表达情况 流式细胞术鉴定SCAPs表面CSF-1R阳性(23.1%)(见图3)。

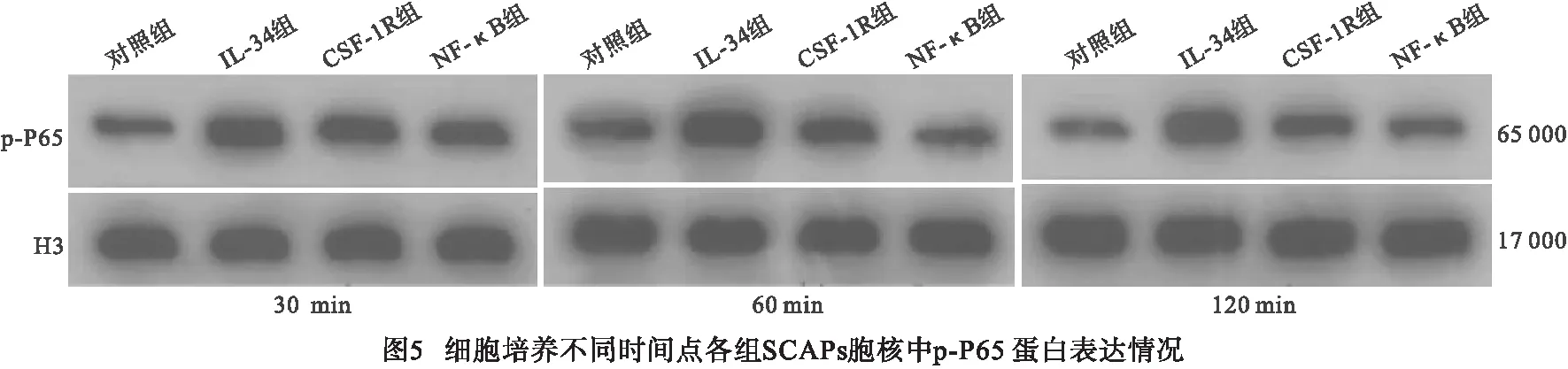
2.4 IL-34对SCAPs中NF-κB信号通路的调节 在细胞培养各时间点SCAPs细胞质中,与对照组相比较,IL-34组p-P65、p-IκBα蛋白表达量均显著上调(P<0.01)。细胞培养30 min时,与IL-34组相比,CSF-1R组中SCAPs细胞质中p-P65和NF-κB组中SCAPs细胞质中p-P65、p-IκBα显著降低(P<0.01)。细胞培养60 min、120 min时,与IL-34组相比,CSF-1R组、NF-κB组中SCAPs细胞核中p65、IκBα磷酸化水平均显著降低(P<0.01)。细胞核蛋白结果显示:在细胞培养各时间点,与对照组相比,IL-34组p-P65表达量显著上调(P<0.05);细胞培养60 min后CSF-1R组、NF-кB组中p-P65表达量较IL-34组呈下降趋势(P<0.01)(见表1~2、图4~5)。

表1 各组SCAPs细胞浆中IкBα、p-IкBα、p65 及 p-P65蛋白的相对表达量

表2 各组SCAPs胞核中p-P65蛋白的相对表达量
2.5 IL-34/CSF-1R/NF-кB 信号对 SCAPs 增殖的影响 实验各组SCAPs生长曲线均呈现逐渐增长趋势。与对照组相比,50 ng/mL IL-34刺激SCAPs后,细胞OD值显著增高(P<0.01)。与IL-34组相比,经过anti-CSF-1R和NF-кB 信号通路抑制剂处理后的CSF-1R组、NF-кB组,SCAPs增殖效率显著降低(P<0.01)(见表3)。

表3 CCK-8检测IL-34组、CSF-1R组、NF-кB组对 SCAPSs增殖的影响(OD值;
2.6 IL-34/CSF-1R/NF-кB信号对SCAPs迁移的影响 细胞培养20 h后检测Transwell下层细胞数,结果显示:IL-34组迁移细胞数目显著高于对照组(P<0.01)。阻断IL-34与CSF-1R结合进而抑制NF-кB 信号通路的路径后,CSF-1R组小室下方迁移细胞数目较IL-34组显著降低(P<0.01)。直接通过BMS-345541抑制剂直接阻断NF-кB 信号通路后,NF-кB 组较IL-34组相比,SCAPs的迁移效率显著降低(P<0.01)(见表4)。

表4 Transwell检测IL-34组、CSF-1R组、NF-кB组迁移细胞数目
3 讨论
SCAPs是外源性间充质干细胞的一种,通常位于未完全发育的牙根尖组织中。有研究[15]证实,相比于牙髓干细胞(dental pulp stem cells,DPSCs),SCAPs具有更好的增殖、迁移效能。SCAPs同其他牙源性干细胞相比,表现出更强的增殖效率和迁移能力,且较易获取,因此被视为目前发现的最理想的牙源性种子细胞[16]。研究中通过酶消化法分离培养SCAPs,流式细胞仪检测显示SCAPs对造血干细胞特异性表面标志物CD45表达阴性,排除SCAPs是造血干细胞来源的可能性。同时SCAPs表达间充质干细胞标志物CD44、CD90,证实SCAPs的间充质来源。
NF-кB、wnt/β-Catenin、cAMP/PKA等信号通路均可影响SCAPs增殖、迁移的过程[17]。NF-кB是细胞中重要的核转录因子,通常以p65:p50异二聚体的形式存在于细胞中。当受到微生物、真菌、病毒和致炎细胞因子等刺激物时,可激活该信号通路,促使NF-κB进入细胞核,与DNA结合继而进行各种基因的转录,进而调节各种细胞的生物功能。已有研究[18]证实氢氧化钙激活NF-κB信号通路可调节同为MSCs的DPSCs的增殖、迁移能力,促使受损的牙髓组织快速修复。此外LI等[12]研究发现,激活NF-κB信号通路后,SCAPs增殖效能、迁移速率显著增高,而通过BMS-345541抑制剂抑制NF-кB信号通路时,SCAPSs的增殖及迁移能力受到明显抑制。
本实验发现IL-34可以刺激SCAPs细胞质中IκBα的磷酸化,继而引发了下游蛋白p65的入核后磷酸化。BMS-345541是NF-кB的信号通路抑制剂,可以有效抑制NF-кB蛋白的磷酸化,进而抑制NF-кB信号通路。实验中,当加入抑制剂BMS-345541后,p-IκBα、p-P65蛋白含量明显降低,此时细胞核内p-P65的含量同样呈下降趋势。由此进一步证实了IL-34可以调节SCAPs的NF-кB信号通路。
IL-34作为髓系细胞(包括单核细胞、巨噬细胞和破骨细胞)增殖及存活的关键调节因子,通过巨噬细胞集落刺激因子受体发挥功能[20]。有研究[21]发现,IL-34促进关节炎成纤维细胞和类风湿关节炎成纤维样滑膜细胞的增殖、迁移[8]。基于IL-34对各类细胞增殖、迁移的影响,课题组前期通过MTT、划痕实验证实了,IL-34可以调节SCAPs的增殖与迁移。本实验通过CCK-8、Transwell检测方法再次设置适宜浓度的IL-34刺激SCAPs,证实IL-34可以调节SCAPs的增殖效能和迁移细胞数目。

通过NF-κB组CCK-8、Transwell实验结果可知,抑制NF-κB信号通路后,与对照组相比,SCAPs的增殖、迁移能力显著降低。结合Western Blotting实验结果,证实了IL-34可以通过介导NF-κB信号通路,从而促进SCAPs的增殖、迁移能力。相关研究[7]显示,IL-34通过其他信号通路调节MSCs增殖和迁移。本实验发现同时加入IL-34和NF-κB抑制剂后,SCAPs的增殖、迁移高于对照组,推测IL-34可能通过其他信号通路调节SCAPs的增殖和迁移。
CCK-8检测、Transwell实验中CSF-1R组的OD值、迁移细胞数目显著较IL-34组降低,这一发现进一步证明,抑制IL-34与CSF-1R受体结合,可以有效抑制NF-κB信号通路。由此证实,IL-34可以通过与CSF-1R受体结合激活NF-κB信号通路,继而调节SCAPs的增殖与迁移能力。
综上所述,本实验证实IL-34可以通过与CSR-1R受体结合激活SCAPs中NF-κB信号通路,并且IL-34可能通过激活NF-κB信号通路,进而促进SCAPs增殖、迁移。
